人源类肿瘤组织细胞簇用于癌症药敏检测研究取得进展
来源:北京大学 2020-07-09 12:27
北京大学工学院席建忠教授课题组、北京大学人民医院王殊教授课题组与北京大学肿瘤医院等团队联合,在Science Translational Medicine(IF=17.2)《科学转化医学杂志》杂志上发表题为“Patient-Derived Tumor-Like Cell Clusters for Drug Testing in Cancer Th
北京大学工学院席建忠教授课题组、北京大学人民医院王殊教授课题组与北京大学肿瘤医院等团队联合,在Science Translational Medicine(IF=17.2)《科学转化医学杂志》杂志上发表题为“Patient-Derived Tumor-Like Cell Clusters for Drug Testing in Cancer Therapy(人源类肿瘤组织细胞簇用于癌症药敏检测)”的文章。研究创建了一种全新原代肿瘤细胞自己“任性游走”组装形成微肿瘤的方法,建立了乳腺癌等癌种的微肿瘤模型。临床实验结果显示,该微肿瘤模型预测患者药效的准确性高达90%以上。
Science Translational Medicine系美国科学促进会(AAAS)的官方刊物, 聚焦转化医学的综合性科学期刊,在国际学术界享有一定的影响力。
近年来,随着肿瘤精准医学概念的提出,作为肿瘤精准医学基础的肿瘤基因检测应运而生,各种基因组学技术在精准医疗中得到广泛应用,通过分析肿瘤患者的基因突变情况,为每位肿瘤患者量身定制治疗方案,进而达到疗效最大化、损害最小化、资源最优化的目的。但基因组学技术临床应用的潜力和效果也受到一定的限制,很大比例的基因突变致癌患者,即使能找到改变的目标基因组,却没有可用的对症药,缺乏可以有效指导临床方案的实用模型。因此,肿瘤精准医学的研究热点(行业痛点)就在于发展一个能及时、直接、准确地反映患者药物敏感的辅助治疗技术。
过去的60年里,先后有上百种的肿瘤药敏检测模型或方法被报道,其中,比较有影响的有类器官(Patient-Derived Organoids,PDO)、患者来源的肿瘤异种移植模型等,但这些技术在检测周期、准确率、检测药物通量、检测成本等方面有局限性,因此指导临床用药的前景并不清晰。
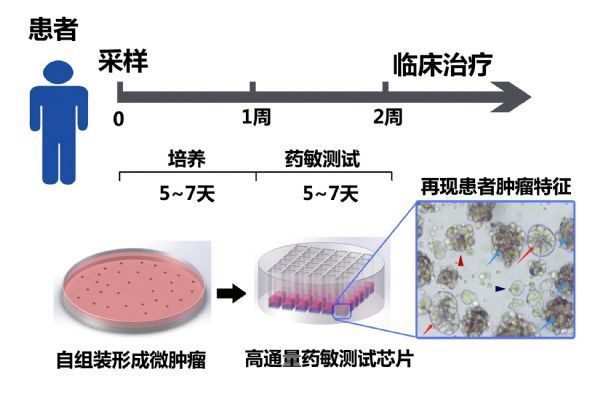
不同于传统的类器官等培养技术,北京大学团队研发的微肿瘤PTC模型(patient derived tumor-like cell cluster,人源类肿瘤组织细胞簇)在检测周期、准确性以及临床转化应用等方面,取得机制和技术上的重大突破进展,有望在2~3年得到大规模推广应用。
研究团队发展了原代细胞自组装形成微肿瘤的新方法,即通过改良培养基和培养微环境,优化微肿瘤培养条件。微肿瘤PTC在培养时间、细胞组成等方面,具有明显的优势。无论是手术样本,还是穿刺样本,2周之内可以检测100~2000种药物;此外,微肿瘤PTC是由肿瘤干细胞、上皮细胞、成纤维细胞、巨噬细胞等多种细胞组成,能够很好地再现肿瘤组织本身的多细胞微环境与肿瘤上皮细胞的相互作用。研究团队通过免疫荧光、流式细胞分析、转录组测序等大量方法分析,表明微肿瘤PTC与肿瘤组织在分子、细胞以及组织结构等方面,具有高度的一致性。
乳腺癌微肿瘤与原发肿瘤的表型比较
特别值得一提的是,团队采用微肿瘤PTC药敏检测模型进行临床双盲验证。对入组并获得PTC的35位乳腺癌患者,采用影像学结合Miller & Payne分级系统评估临床疗效,PTC检测结果与临床疗效的一致率达到91.4%。团队还进行了病理评估的同期验证,对于化疗无效患者的预测率达到87.5%,对于乳腺癌患者的精准治疗意义重大。
PTC药敏检测技术是近年来肿瘤诊治方法的重要的技术创新,克服了其他药敏检测技术的局限性,目前已成功应用于乳腺癌患者的药物疗效预测,可在临床决策中准确、前瞻性地指导肿瘤患者地个体化治疗,不仅使患者获益,延长生命周期,而且可以节省国家宝贵的医疗资源。
作为一种较有前景的肿瘤研究模型,PTC平台可有力地推动肿瘤临床医学在机制探索、新药开发、临床辅助诊断等领域的研究。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。