Nature子刊综述深度解读!NK细胞介导的癌症转移的免疫编辑机制!
来源:本站原创 2020-06-29 22:23
2020年6月29日 讯 /生物谷BIOON/ --近日,一项刊登在国际杂志Nature Cancer上题为“Immunoediting of cancer metastasis by NK cells”的综述报告中,来自澳大利亚QIMR Berghofer医学研究所的科学家们论述了NK细胞所介导的癌症转移的免疫编辑机制,自然杀伤细胞(NK细胞)在控制疾病转
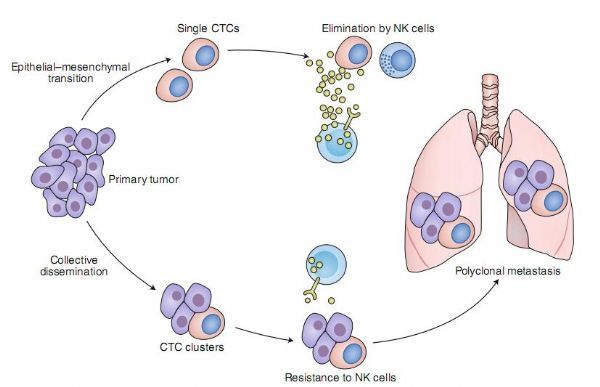
2020年6月29日 讯 /生物谷BIOON/ --近日,一项刊登在国际杂志Nature Cancer上题为“Immunoediting of cancer metastasis by NK cells”的综述报告中,来自澳大利亚QIMR Berghofer医学研究所的科学家们论述了NK细胞所介导的癌症转移的免疫编辑机制,自然杀伤细胞(NK细胞)在控制疾病转移过程中扮演着关键角色,有研究表明,NK细胞能优先控制来源于单个循环肿瘤细胞的单克隆转移,而不是来源于细胞簇所衍生的多克隆转移,相关研究结果进一步证明了NK细胞或与转移性细胞的免疫编辑有关。
尽管最近研究人员在癌症治疗上取得了很大的进展,但癌症转移依然是诸如乳腺癌等实体瘤癌症患者发生死亡的主要原因,癌症转移是一个多步骤的过程,其包括肿瘤侵袭、内渗入血液循环、远端脏器的实质性外渗以及从微转移到大转移的进展;这一系列步骤是一个高度选择性的过程,其受到了肿瘤内在因素和外在因素的复杂调控;实际上,仅有一小部分循环肿瘤细胞(CTCs)能在转移过程中存活下来,并能启动转移病灶;NK细胞能被控制转移的关键先天性免疫细胞所识别,而且NK细胞介导的免疫压力还可能被预测会对CTCs的命运产生效应;这就好像达尔文的选择进化机制一样,免疫细胞的选择性压力被认为可以塑造肿瘤的表型和基因型,这一过程称之为“癌症的免疫编辑”(cancer immunoediting),研究者表示,NK细胞能够选择性地控制单一CTC衍生的单克隆转移,但并不能控制CTC簇衍生的多克隆转移,这或许就能为研究人员提供新的思路来揭示NK细胞介导的转移性肿瘤细胞的免疫编辑。
图片来源:Nakamura, K.,et al. Nat Cancer. doi:10.1038/s43018-020-0081-z
为了理解单个CTCs和CTCs簇对免疫系统介导的消除的不同易感性,研究者利用一种已经建立的实验模型来区分单克隆转移和多克隆转移;研究者利用GFP(绿色)和mCherry(红色)荧光标记小鼠的乳腺癌细胞,并将GFP阳性细胞和mCherry阳性细胞按照1:1的混合物注入小鼠体内,随后评估癌细胞的肺部转移情况,混合颜色的肺部转移病灶反映了来自CTC簇的多克隆来源,相反,单个CTCs也会产生单色、单克隆的转移性病灶。研究者发现,在同系免疫活性的小鼠体内,有高达50%的转移性病灶是多克隆的,然而,令人惊讶的是,当研究者在缺乏成熟淋巴细胞的免疫缺陷小鼠体内重复同样的实验时,单色单克隆转移的频率会显著增加到转移性病灶的80%,值得注意的是,在免疫缺陷小鼠机体中,抗体介导的NK细胞的缺失也会增加单克隆转移的发生率,而NK细胞过继转移到免疫缺陷小鼠体内则会显著减少单克隆的转移,相关研究结果表明,NK细胞会优先控制单一CTC衍生的单克隆转移。
上皮间充质转化(EMT)是上皮肿瘤细胞获得迁移和侵袭特性的关键过程,通常情况下,单个CTCs拥有间充质的特性,相比而言,较大的粘液性肿瘤细胞的集体扩散会导致CTC簇的产生,因此CTC簇还包含有能保留上皮特征的肿瘤细胞。研究者推测,间质vs上皮CTC的表型可能是其对NK细胞介导的消除敏感性差异的原因,为了解决这一问题,研究人员使用了8种具有上皮细胞特性或间充质细胞特性的乳腺癌细胞系俩进行NK细胞共培养实验,实际上,NK细胞对具有间充质特性的非聚类细胞系显示出强大的细胞毒性,而具有上皮特征的细胞系往往对NK细胞介导的细胞毒性具有一定的抗性。
随后研究人员分析了NK细胞介导的细胞毒性的敏感性差异的机制,NK细胞的活性能被激活受体信号和抑制性受体信号之间的平衡所调节,而NKG2D(自然杀伤受体2群,D成员,natural-killer receptor group 2, member D)则是一种关键的活性受体,其能识别恶性转化细胞上压力诱导的自配体,而NK细胞抑制性受体则会识别自身主要组织相容性1类复合体从而保护正常细胞免受NK细胞所介导的细胞毒性。使用细胞因子TGF-β来刺激EMT过程及诱导miR-200c来抑制EMT,研究者发现,携带间充质表型的肿瘤细胞中多重NKG2D会发生高表达,而主要组织相容性1类复合体的表达水平则较低,这或许就能帮助解释为何间充质肿瘤要比NK细胞所介导的细胞毒性更具有易感性,实际上,间充质肿瘤在体内的转移性肿瘤的生长水平要低于miR-200c所诱导的上皮样肿瘤。值得注意的是,NK细胞的剔除或被NKG2D的阻滞也会在较小的程度上加剧间充质肿瘤的转移性肿瘤负荷,这或许就支持了一种假设,即NKG2D依赖性的NK细胞细胞毒性在控制间充质肿瘤中发挥着关键角色,总的来讲,本文研究揭示了在抵御转移性肿瘤细胞过程中NK细胞介导的免疫选择性压力。
这篇综述文章中,研究人员阐释了CTC簇在NK细胞介导的免疫监督下的生存优势,然而,以下几方面也可能与NK细胞所介导的转移控制的敏感性和耐药性密切相关,首先,EMT过程是一个高度可塑性的过程,能够抵达远端器官的CTCs可能会通过间充质上皮转化的逆向过程来逃脱NK细胞的监视,NK细胞和表型重塑的肿瘤细胞之间的动态相互作用也需要进一步的研究。其次,免疫抑制转移生境也可能会促进肿瘤细胞逃脱NK细胞介导的消除,特别是,目前研究人员并不清楚控制免疫系统介导的休眠和转移性生长之间平衡的机制,第三,有研究证据表明,具有间充质特性的先导细胞在CTC簇的集体迁移和传播过程中扮演着关键作用,有可能是NK细胞介导的先导细胞的消除可以改善CTC簇的转移性潜能。由于CTC簇可能是癌症转移的主要原因,因此研究人员就需要更好地了解CTC簇的生物学特性,从而为开发治疗性干预措施提供更多线索,特别是在远端转移性病灶建立和进展的早期阶段,最后,尽管CTC簇对NK细胞所介导的天然免疫监督能够表现出更强的抵抗力,但研究人员仍然非常感兴趣研究揭示是否旨在增加NK细胞的免疫治疗性手段(比如NK细胞检查点分子到底阻滞)能够改善对癌症转移的控制;总的来讲,本文研究揭示了NK细胞介导癌症免疫编辑对转移性肿瘤细胞的作用,同时还拓展了研究人员对转移过程中CTC簇和免疫监视机制的深入研究。(生物谷Bioon.com)
参考资料:
Nakamura, K., Smyth, M.J. Immunoediting of cancer metastasis by NK cells. Nat Cancer (2020). doi:10.1038/s43018-020-0081-z
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。