特应性皮炎靶向生物制剂:赛诺菲达必妥®(Dupixent®)在中国批准,治疗中重度成人患者!
来源:本站原创 2020-06-22 18:13
达必妥®是全球首个也是唯一获批治疗成人中重度特应性皮炎的靶向生物制剂,能快速、显著、持续地改善特应性皮炎患者的皮损程度和瘙痒症状。

2020年06月22日讯 /生物谷BIOON/ --赛诺菲(Sanofi)近日宣布,中国国家药品监督管理局(NMPA)已批准达必妥®(英文名:Dupixent®,通用名:度普利尤单抗,dupilumab),用于治疗成人中重度特应性皮炎(AD)。
达必妥®是全球首个也是唯一获批治疗成人中重度特应性皮炎的靶向生物制剂,填补了国内临床未被满足的需求,能快速、显著、持续地改善特应性皮炎患者的皮损程度和瘙痒症状。得益于药监改革的推动,达必妥®提前两年在中国获批,为中国患者提供了全新的治疗选择。
“双靶点”创新机制,填补中国临床未满足需求
特应性皮炎(atopic dermatitis,AD)是一种难治性、复发性、炎症性皮肤病,以反复发作的剧烈瘙痒和皮疹为主要临床表现,患者常合并过敏性鼻炎、哮喘等其他特应性疾病。多数患者存在由皮肤开裂、结痂和渗液等引起的疼痛和不适症状,如得不到有效控制,会影响患者的情绪和心理状态,导致焦虑和抑郁以及孤独感。有患者曾表示,12小时不停止的剧烈瘙痒在夜里最难熬,只能不停抓,用疼痛盖过瘙痒,一个正常睡眠都是奢侈。
中华医学会皮肤性病学分会13届主任委员,北京大学人民医院皮肤科主任张建中教授表示:“在中国,特应性皮炎的患病率以及疾病负担的严重性在皮肤类疾病中数一数二。目前治疗仍然以外部用药如局部外用糖皮质激素,口服糖皮质激素和免疫抑制剂为主,缺乏有效且安全的手段。中重度特应性皮炎患者及其家庭饱受这一疾病给身体、生活和精神带来的痛苦,亟需安全有效且可长期使用的全身性治疗手段。”
达必妥®是一款全人单克隆抗体,能够通过“双靶点”的创新作用机制,选择性地抑制关键信号通路白介素4(IL-4)和白介素13(IL-13),阻断2型炎症通路,降低2型炎症的病理性反应,从机制上治疗2型炎症相关疾病。来自达必妥®临床试验的数据表明,IL-4和IL-13是2型炎症的关键驱动因子,而2型炎症在特应性皮炎、哮喘和慢性鼻-鼻窦炎伴鼻息肉(CRSwNP)等疾病中起着主要作用。达必妥®具有良好的安全性和耐受性,能够在快速、显著、持续地缓解瘙痒、皮损等症状的同时,有效改善患者生存质量。今年2月《中国特应性皮炎治疗指南(2020)》发布,将尚未上市的达必妥®列入推荐,以期待这一新药能够填补目前药物无法满足的需求。
中华医学会皮肤性病学分会候任主任委员,中国医科大学附属第一医院副院长高兴华教授表示:“作为一项针对性疗法,达必妥®的获批在我国特应性皮炎的诊疗发展历程中具有突破性的意义,也为特应性皮炎患者带来了希望,有望帮助他们摆脱难以忍受的瘙痒、皮损,改善患者和家人的生存质量,帮助他们回归正常生活。”
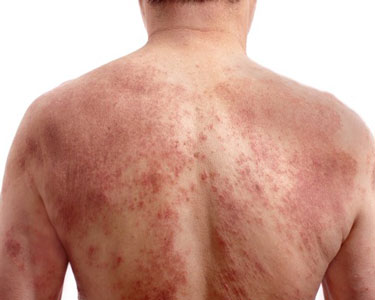
特应性皮炎(图片来源:icresearch.net)
创新药物先行引入,提前两年在中国快速获批
这项批准基于全球LIBERTY AD临床试验的积极数据,该试验入组近3000名疾病控制不佳的中重度特应性皮炎患者。试验评估了达必妥®(单药疗法或与局部糖皮质激素联用)的安全性和疗效,包括皮损清除、总体疾病严重程度和瘙痒。
为了满足特应性皮炎患者迫切的治疗需求,让国内患者更早地享受全球领先创新药物,得益于“国九条”,达必妥®于2019年2月被引进博鳌超级医院皮肤病临床医学中心,一位中重度特应性皮炎患者率先接受了首针注射。受惠于国家药监改革的持续推动,达必妥®于2019年5月被纳入国家药品监督管理局药品审评中心(CDE)第二批临床急需境外新药名单,加速了上市审批的进程,比原计划提前了两年获批。
赛诺菲首席执行官韩保罗(Paul Hudson)表示:“赛诺菲与中国渊源深厚,中国一直以来都是重要的增长市场。中国医疗体制改革的逐步深入也为达必妥®等创新药物更早地惠及患者铺平了道路。我们将积极响应‘健康中国’2030规划,预计在2025年底前引入超过25款创新药物和疫苗,造福更多中国患者。”
赛诺菲特药全球事业部中国区总经理王柏康表示:“患者为先,科学领先是我们一切工作之本,赛诺菲很自豪又将一种创新的治疗方案带到中国。达必妥®在中国获批,意味着这一‘2型炎症疾病治疗’在中国进入了生物制剂时代,将帮助饱受疾病困扰的患者回归正常生活。我们由衷感谢中国政府为加速创新药物上市所做出的努力,致敬各方专家长期以来的支持。我们将全力以赴,使达必妥®尽快惠及患者。”
根据一项全球合作协议,达必妥®由赛诺菲和再生元联合开发。2017年3月,达必妥®批准上市,成为全球首个治疗中重度特应性皮炎的生物制剂。截至目前,该药已获全球40多个国家和地区批准,包括美国、欧盟和日本。在美国,Dupixent现在被批准治疗3种由2型炎症导致的疾病:中度至重度特应性皮炎(≥6岁患者)、中度至重度哮喘(≥12岁患者)、伴鼻息肉的慢性鼻-鼻窦炎(CRSwNP,成人患者)。
目前,赛诺菲和再生元也正在开展一项广泛的临床项目,评估Dupixent治疗由过敏和其他2型炎症引起的疾病,包括:儿童哮喘(6-11岁,III期)、儿童特应性皮炎(6个月至5岁,II/III期)、嗜酸性食管炎(III期)、慢性阻塞性肺病(III期)、大疱性类天疱疮(III期) 、结节性痒疹(III期)、慢性自发性荨麻疹(III期)、食物和环境过敏(II期)。
Dupixent是赛诺菲与再生元继PCSK9抑制剂类降脂药Praluent之后合作开发的另一个重要产品,也是一款改变游戏规则的药物。目前,Dupixent适应症正在稳步增加,知名医药市场调研机构EvaluatePharma之前预测,该药在2024年的全球销售额或将达到80亿美元。(生物谷Bioon.com)
原文出处:赛诺菲
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


