全文编译!我国科学家发表Science论文,发现两种非竞争性人类中和抗体可阻断SARS-CoV-2病毒结合人ACE2受体
来源:本站原创 2020-05-17 19:20
2020年5月17日讯/生物谷BIOON/---由新型冠状病毒SARS-CoV-2引起的2019年冠状病毒病(COVID-19)已成为一种大流行病。这种病毒已在全球范围内传播,引起发热、重症呼吸道疾病和肺炎。系统发育分析表明这种病毒与严重急性呼吸综合征冠状病毒(SARS-CoV)密切相关,但似乎更容易在人与人之间传播。到目前为止,尚无特异性药物或疫苗。SAR
2020年5月17日讯/生物谷BIOON/---由新型冠状病毒SARS-CoV-2引起的2019年冠状病毒病(COVID-19)已成为一种大流行病。这种病毒已在全球范围内传播,引起发热、重症呼吸道疾病和肺炎。系统发育分析表明这种病毒与严重急性呼吸综合征冠状病毒(SARS-CoV)密切相关,但似乎更容易在人与人之间传播。到目前为止,尚无特异性药物或疫苗。
SARS-CoV-2病毒属于β冠状病毒属,β冠状病毒属包括5种能够感染人类的病原体。在这5种病原体中,SARS-CoV和中东呼吸综合征冠状病毒(MERS-CoV)是两种高致病性冠状病毒。与其他冠状病毒一样,位于SARS-CoV-2病毒表面上的刺突糖蛋白(S蛋白)同源三聚体在受体结合和病毒进入中起着至关重要的作用。S蛋白是一种I类融合蛋白---每个S蛋白原体由S1和S2结构域组成,受体结合结构域(RBD)位于S1结构域上。先前的研究显示,与SARS-CoV类似的是,SARS-CoV-2也利用人ACE2(hACE2)受体进入细胞。科学家们已经发现了许多靶向SARS-CoV或MERS-CoV RBD的中和抗体。因此,筛选出靶向SARS-CoV-2 RBD的中和抗体是当务之急。
在一项新的研究中,来自中国科学院、中国科学院大学、首都医科大学、中国科学技术大学、深圳市第三人民医院、中国农业大学、山西高等创新研究院、中国疾病预防控制中心和中国食品药品检定研究院的研究人员表达了SARS-CoV-2 RBD蛋白作为诱饵,从COVID-19患者外周血单核细胞(PBMC)中分离出特异性的记忆B细胞。编码抗体重链和轻链的可变区分别从不同的B细胞中扩增出来,然后与抗体恒定区一起被克隆到pCAGGS质粒载体中,以产生IgG1抗体。相关研究结果于2020年5月13日在线发表在Science期刊上,论文标题为“A noncompeting pair of human neutralizing antibodies block COVID-19 virus binding to its receptor ACE2”。
他们扩增出17个配对的B细胞克隆,其中的3个是相同的(B5、B59和H1)。为了确定抗体结合能力,将含有成对重链和轻链的质粒共同转染到HEK 293T细胞中,以产生单克隆抗体(MAb)。随后用生物层干涉仪(bio-layer interferometry, BLI)筛查上清液与RBD的结合能力。用不相关的抗SFTSV Gn抗体和SARS-CoV特异性抗体作为对照。四种不同抗体(B5、B38、H2和H4)的上清液与SARS-CoV-2 RBD结合,但与SARS-CoV RBD不结合,这表明这两种冠状病毒RBD的表位在免疫学上是不同的。
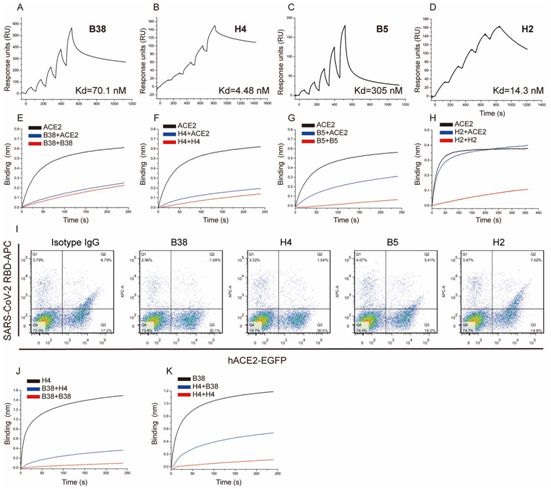
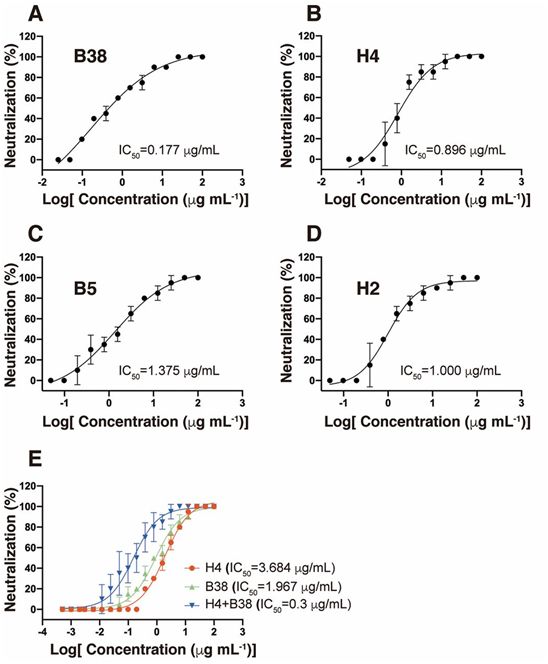
用表面等离子共振(SPR)技术测量的这四种抗体与SARS-CoV-2 RBD结合的解离常数(Kd)在10-7~10-9 M之间(图1,A~D)。接下来,他们研究了这四种抗体对SARS-CoV-2病毒(BetaCoV/Shenzhen/SZTH-003/2020)的中和活性。这四种抗体都表现出中和活性,IC50值从0.177 μg/ml到1.375 μg/ml不等(图2,A到D)。B38和H4的混合物表现出协同中和能力,即使在病毒滴度较高的情况下,也是如此(图2E)。
为了评估每种抗体抑制RBD和ACE2之间的结合能力,他们利用BLI进行了竞争测试,并且利用荧光激活细胞分选术(FACS)进行阻断测试。对于BLI测定而言,用生物素化RBD标记的链霉亲和素生物传感器与抗体饱和结合,然后在可溶性ACE2存在的情况下,让测试抗体流过。B38和H4与ACE2完全竞争与RBD之间的结合。相反,B5显示出部分竞争,而H2不与ACE2竞争与RBD之间的结合(图1,E至H)。利用FACS进行的阻断测试显示了相同的结果(图1I)。为了确定B38和H4是否靶向结合相同的表位,他们利用BLI进行了表位竞争测定。用RBD标记的Ni-NTA传感器与B38 IgG饱和结合,然后让H4 IgG流过,或Ni-NTA传感器先与H4 IgG饱和结合,让B38 IgG流过。虽然RBD被第一种抗体饱和结合,但第二种抗体仍能与RBD结合,但存在一定的抑制作用。这表明B38和H4识别RBD上不同的表位,并有部分重叠(图1,J和K)。
为了探讨B38和H4在体内对SARS-CoV-2病毒挑战的保护功效,在病毒挑战12小时后,给hACE2转基因小鼠注射单剂量25mg/kg的B38或H4。与PBS对照组和H4组相比,B38组的体重缓慢下降,并在感染3天后康复(图3A)。在在感染3天后也测量了小鼠肺部中的病毒RNA拷贝数。B38组和H4组的RNA拷贝数均明显低于PBS组,分别减少32.8%和26%(图3B)。这些结果显示出与中和能力相同的趋势。组织病理学检查表明,在PBS对照组小鼠中可观察到严重的支气管肺炎和间质性肺炎,并且出现水肿、支气管上皮细胞脱落和肺泡腔内淋巴细胞浸润(图3,C和F)。在H4组(图3,E和H)中观察到轻度支气管肺炎,而在B38组(图3,D和G)中没有观察到肺部病变。
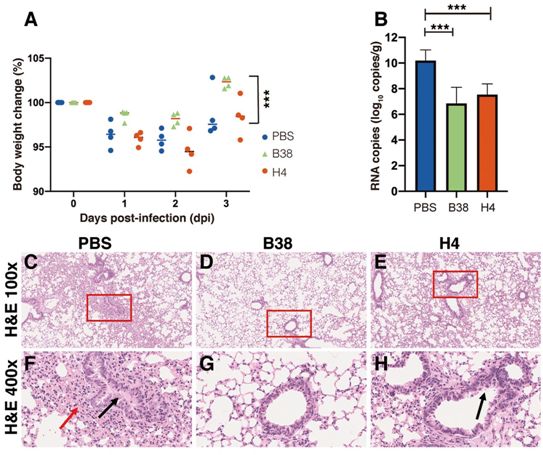
图3.hACE2转基因小鼠模型感染SARS-CoV-2病毒后单克隆抗体的保护作用。
与RBD与B38或H4之间的结合亲和力相一致的是,在RBD-B38和RBD-H4混合物中均获得稳定的复合物。在1.9埃分辨率下解析出RBD-B38 Fab复合物的晶体结构。B38抗体重链上的三个互补性决定区(CDR)和轻链上的两个CDR参与与RBD的相互作用(图4,A,B和G到K)。B38抗体重链和轻链在表位上的埋藏表面积分别为713.9埃和497.7埃。RBD中有36个残基参与与B38的相互作用,其中21个残基和15个残基分别参与与重链和轻链之间的相互作用(图4B)。序列比对表明,RBD表位的36个残基中只有15个残基(定义为被B38掩埋的残基)在SARS-CoV-2和SARS-CoV之间是保守的(图4,D至F和图S3)。值得注意的是,在B38和RBD之间的界面上的大多数接触是亲水性的相互作用。水分子在SARS-CoV-2 RBD和B38之间的结合中起着重要作用(图4,G和I至K)。这些差异解释了B38与SARS-CoV-2 RBD而非SARS-CoV RBD之间的特异性结合。
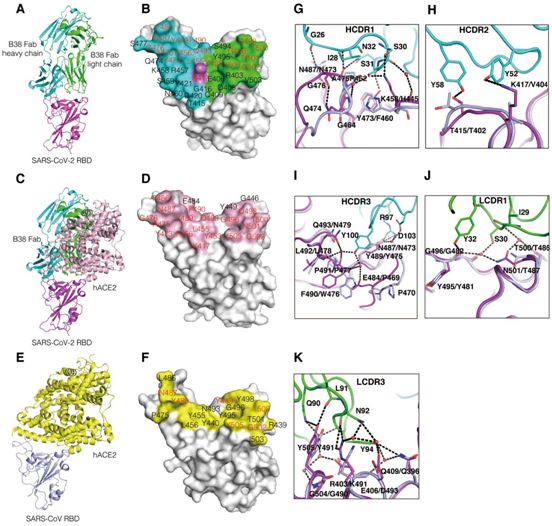
为了探讨B38阻断SARS-CoV-2 RBD和hACE2之间的相互作用的结构基础,将RBD/B38-Fab和RBD/hACE2复合物的结构进行了叠加。B38的重链可变区和轻链可变区都会在立体结构上阻碍hACE2结合(图4C)。值得注意的是,与B38或hACE2结合在一起的RBD没有显著的构象变化,Cα根均方偏差为0.489埃(194个原子)。进一步的分析表明RBD上的21个氨基酸中有18个参与了RBD与B38和hACE2的结合(图4D),这也解释了B38能够破坏SARS-CoV-2 RBD和hACE2受体之间的结合。
随着COVID-19疫情的持续蔓延,对SARS-CoV-2 RBD上表位的表征将为疫苗开发提供有价值的信息。此外,靶向RBD表位的中和抗体的分子特征有助于小分子或多肽类药物/抑制剂的开发。这些中和抗体本身也是预防和治疗SARS-CoV-2病毒的有希望的候选药物。(生物谷 Bioon.com)
参考资料:
Yan Wu et al. A noncompeting pair of human neutralizing antibodies block COVID-19 virus binding to its receptor ACE2. Science, 2020, doi:10.1126/science.abc2241.
SARS-CoV-2病毒属于β冠状病毒属,β冠状病毒属包括5种能够感染人类的病原体。在这5种病原体中,SARS-CoV和中东呼吸综合征冠状病毒(MERS-CoV)是两种高致病性冠状病毒。与其他冠状病毒一样,位于SARS-CoV-2病毒表面上的刺突糖蛋白(S蛋白)同源三聚体在受体结合和病毒进入中起着至关重要的作用。S蛋白是一种I类融合蛋白---每个S蛋白原体由S1和S2结构域组成,受体结合结构域(RBD)位于S1结构域上。先前的研究显示,与SARS-CoV类似的是,SARS-CoV-2也利用人ACE2(hACE2)受体进入细胞。科学家们已经发现了许多靶向SARS-CoV或MERS-CoV RBD的中和抗体。因此,筛选出靶向SARS-CoV-2 RBD的中和抗体是当务之急。
在一项新的研究中,来自中国科学院、中国科学院大学、首都医科大学、中国科学技术大学、深圳市第三人民医院、中国农业大学、山西高等创新研究院、中国疾病预防控制中心和中国食品药品检定研究院的研究人员表达了SARS-CoV-2 RBD蛋白作为诱饵,从COVID-19患者外周血单核细胞(PBMC)中分离出特异性的记忆B细胞。编码抗体重链和轻链的可变区分别从不同的B细胞中扩增出来,然后与抗体恒定区一起被克隆到pCAGGS质粒载体中,以产生IgG1抗体。相关研究结果于2020年5月13日在线发表在Science期刊上,论文标题为“A noncompeting pair of human neutralizing antibodies block COVID-19 virus binding to its receptor ACE2”。
他们扩增出17个配对的B细胞克隆,其中的3个是相同的(B5、B59和H1)。为了确定抗体结合能力,将含有成对重链和轻链的质粒共同转染到HEK 293T细胞中,以产生单克隆抗体(MAb)。随后用生物层干涉仪(bio-layer interferometry, BLI)筛查上清液与RBD的结合能力。用不相关的抗SFTSV Gn抗体和SARS-CoV特异性抗体作为对照。四种不同抗体(B5、B38、H2和H4)的上清液与SARS-CoV-2 RBD结合,但与SARS-CoV RBD不结合,这表明这两种冠状病毒RBD的表位在免疫学上是不同的。

图1.对SARS-CoV-2病毒特异性中和抗体进行表征。
用表面等离子共振(SPR)技术测量的这四种抗体与SARS-CoV-2 RBD结合的解离常数(Kd)在10-7~10-9 M之间(图1,A~D)。接下来,他们研究了这四种抗体对SARS-CoV-2病毒(BetaCoV/Shenzhen/SZTH-003/2020)的中和活性。这四种抗体都表现出中和活性,IC50值从0.177 μg/ml到1.375 μg/ml不等(图2,A到D)。B38和H4的混合物表现出协同中和能力,即使在病毒滴度较高的情况下,也是如此(图2E)。

图2.四种抗体能有效中和SARS-CoV-2病毒,其中的两种抗体具有加性抑制作用。
为了评估每种抗体抑制RBD和ACE2之间的结合能力,他们利用BLI进行了竞争测试,并且利用荧光激活细胞分选术(FACS)进行阻断测试。对于BLI测定而言,用生物素化RBD标记的链霉亲和素生物传感器与抗体饱和结合,然后在可溶性ACE2存在的情况下,让测试抗体流过。B38和H4与ACE2完全竞争与RBD之间的结合。相反,B5显示出部分竞争,而H2不与ACE2竞争与RBD之间的结合(图1,E至H)。利用FACS进行的阻断测试显示了相同的结果(图1I)。为了确定B38和H4是否靶向结合相同的表位,他们利用BLI进行了表位竞争测定。用RBD标记的Ni-NTA传感器与B38 IgG饱和结合,然后让H4 IgG流过,或Ni-NTA传感器先与H4 IgG饱和结合,让B38 IgG流过。虽然RBD被第一种抗体饱和结合,但第二种抗体仍能与RBD结合,但存在一定的抑制作用。这表明B38和H4识别RBD上不同的表位,并有部分重叠(图1,J和K)。
为了探讨B38和H4在体内对SARS-CoV-2病毒挑战的保护功效,在病毒挑战12小时后,给hACE2转基因小鼠注射单剂量25mg/kg的B38或H4。与PBS对照组和H4组相比,B38组的体重缓慢下降,并在感染3天后康复(图3A)。在在感染3天后也测量了小鼠肺部中的病毒RNA拷贝数。B38组和H4组的RNA拷贝数均明显低于PBS组,分别减少32.8%和26%(图3B)。这些结果显示出与中和能力相同的趋势。组织病理学检查表明,在PBS对照组小鼠中可观察到严重的支气管肺炎和间质性肺炎,并且出现水肿、支气管上皮细胞脱落和肺泡腔内淋巴细胞浸润(图3,C和F)。在H4组(图3,E和H)中观察到轻度支气管肺炎,而在B38组(图3,D和G)中没有观察到肺部病变。

图3.hACE2转基因小鼠模型感染SARS-CoV-2病毒后单克隆抗体的保护作用。
与RBD与B38或H4之间的结合亲和力相一致的是,在RBD-B38和RBD-H4混合物中均获得稳定的复合物。在1.9埃分辨率下解析出RBD-B38 Fab复合物的晶体结构。B38抗体重链上的三个互补性决定区(CDR)和轻链上的两个CDR参与与RBD的相互作用(图4,A,B和G到K)。B38抗体重链和轻链在表位上的埋藏表面积分别为713.9埃和497.7埃。RBD中有36个残基参与与B38的相互作用,其中21个残基和15个残基分别参与与重链和轻链之间的相互作用(图4B)。序列比对表明,RBD表位的36个残基中只有15个残基(定义为被B38掩埋的残基)在SARS-CoV-2和SARS-CoV之间是保守的(图4,D至F和图S3)。值得注意的是,在B38和RBD之间的界面上的大多数接触是亲水性的相互作用。水分子在SARS-CoV-2 RBD和B38之间的结合中起着重要作用(图4,G和I至K)。这些差异解释了B38与SARS-CoV-2 RBD而非SARS-CoV RBD之间的特异性结合。

图4.对B38与SARS-CoV-2 RBD复合物的结构分析以及对B38与hACE2的RBD结合表位进行比较。
为了探讨B38阻断SARS-CoV-2 RBD和hACE2之间的相互作用的结构基础,将RBD/B38-Fab和RBD/hACE2复合物的结构进行了叠加。B38的重链可变区和轻链可变区都会在立体结构上阻碍hACE2结合(图4C)。值得注意的是,与B38或hACE2结合在一起的RBD没有显著的构象变化,Cα根均方偏差为0.489埃(194个原子)。进一步的分析表明RBD上的21个氨基酸中有18个参与了RBD与B38和hACE2的结合(图4D),这也解释了B38能够破坏SARS-CoV-2 RBD和hACE2受体之间的结合。
随着COVID-19疫情的持续蔓延,对SARS-CoV-2 RBD上表位的表征将为疫苗开发提供有价值的信息。此外,靶向RBD表位的中和抗体的分子特征有助于小分子或多肽类药物/抑制剂的开发。这些中和抗体本身也是预防和治疗SARS-CoV-2病毒的有希望的候选药物。(生物谷 Bioon.com)
参考资料:
Yan Wu et al. A noncompeting pair of human neutralizing antibodies block COVID-19 virus binding to its receptor ACE2. Science, 2020, doi:10.1126/science.abc2241.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


