Science:我国科学家揭示细胞毒性淋巴细胞在靶细胞中引发细胞焦亡机制
来源:本站原创 2020-05-02 13:11
2020年5月2日讯/生物谷BIOON/---细胞毒性淋巴细胞,主要是细胞毒性T淋巴细胞(CTL)和自然杀伤细胞(NK),是杀死受到病毒感染的细胞或发生癌变的细胞或组织移植物的主要效应细胞。这种细胞介导的细胞毒性位于FAS死亡受体途径或更常见的颗粒胞吐途径的下游。颗粒胞吐途径依赖于穿孔素(perforin)来递送称为颗粒酶(granzyme)的丝氨酸蛋白酶到
2020年5月2日讯/生物谷BIOON/---细胞毒性淋巴细胞,主要是细胞毒性T淋巴细胞(CTL)和自然杀伤细胞(NK),是杀死受到病毒感染的细胞或发生癌变的细胞或组织移植物的主要效应细胞。这种细胞介导的细胞毒性作用于FAS死亡受体途径或更常见的颗粒胞吐途径的下游。颗粒胞吐途径依赖于穿孔素(perforin)来递送称为颗粒酶(granzyme)的丝氨酸蛋白酶到靶细胞中。理解细胞毒性淋巴细胞如何利用这两种途径来杀死靶细胞是免疫学中的一个至关重要的问题,特别是考虑到CTL在癌症免疫疗法中的关键作用。从1990年代开始的大量研究给出了一个主要的观点:FAS途径和穿孔素/颗粒酶途径诱导靶细胞凋亡。然而,这些早期的研究是在细胞凋亡被认为是唯一的或主要的程序性细胞死亡形式的时候开展的。确定细胞凋亡的测定方法并不特别准确,而且是在体外针对有限类型的靶细胞进行的。确实,已有零星的报告指出细胞毒性淋巴细胞可诱导非凋亡性细胞死亡。比如,当遭受NK细胞靶向攻击时,K562和CHP134细胞会经历坏死,Jurkat细胞表现出混合的细胞死亡形式。在某些环境下,CTL也会诱导非凋亡性细胞死亡。因此,淋巴细胞的细胞毒性可能是环境依赖性的。
颗粒酶家族在人类中包括5个成员:颗粒酶A(GZMA)、颗粒酶B(GZMB)、颗粒酶H(GZMH)、颗粒酶K(GZMK)和颗粒酶M(GZMM),而在小鼠中包括11个成员,每个成员都具有它自己的底物特异性。人们对颗粒酶的研究已有30多年了,主要的关注点是两个大量存在的成员(GZMA和GZMB)及其在杀死癌细胞中的作用。GZMB被认为通过切割caspase-3或caspase-3底物来诱导靶细胞凋亡。GZMB的作用并不那么明确。利用装载穿孔素的GZMA进行的体外研究已鉴定出单链DNA损伤和线粒体电子传递链中的多种底物。这导致人们提出一种复杂的不依赖于caspase的细胞凋亡途径,该途径的作用机理是未知的。已知的GZMA切割活性对CTL和NK细胞介导的杀伤作用作出的贡献尚未确定。再者,GZMA敲除小鼠在细胞凋亡上不存在明显的缺陷,而且小鼠GZMA可诱导呈现扭动形态(writhing morphology)的非凋亡性细胞死亡。因此,GZMA的真实功能和作用机制仍然不明确,这可能是因为缺乏足够相关的实验系统。
作为一种促炎性细胞死亡形式,细胞焦亡是先天免疫中的一种至关重要的效应机制。历史上,细胞焦亡曾被认为是caspase-1介导的单核细胞死亡,并伴有IL-1β和IL-18分泌。近期的研究已表明小鼠caspase-11以及它的人类同源蛋白caspase-4和caspase-5也可在脂多糖的直接激活下诱导细胞焦亡。此外,gasdermin D(GSDMD)已被发现是作用于caspase-1和caspase-11/4/5下游的细胞焦亡执行分子。因此,细胞焦亡如今被重新定义为gasdermin介导的程序性坏死(也称为坏死性凋亡)。
GSDMD携带着一个N端穿孔结构域和一个C端抑制性结构域。caspase-1或caspase-11/4/5对GSDMD的结构域间切割(inter-domain cleavage)允许这个N端结构域结合膜磷脂并发生寡聚体化从而在质膜上形成一个较大的大约18nm的孔。作为对细胞焦亡的重新定义的支持,四种其他的gasdermin(GSDMA、GSDMB、GSDMC和GSDME)都具有自我抑制的穿孔结构域,但没有caspase-1/11切割位点。作为另一种得到很好描述的gasdermin,GSDME被caspase-3切割和激活,其方式类似于GSDMD被caspase-1/11切割和激活。GSDME表达可在仅大约10%的癌细胞中明显地检测到。GSDME可将caspase-3介导的细胞死亡从细胞凋亡切换到细胞焦亡,从而使得癌细胞对杀伤试剂更加敏感。这些结果支持早期提出的一个观点:GSDME可能作为一种肿瘤抑制蛋白发挥作用。除了GSDMD和GSDME之外,gasdermin蛋白家族其他成员的激活机制是未知的。
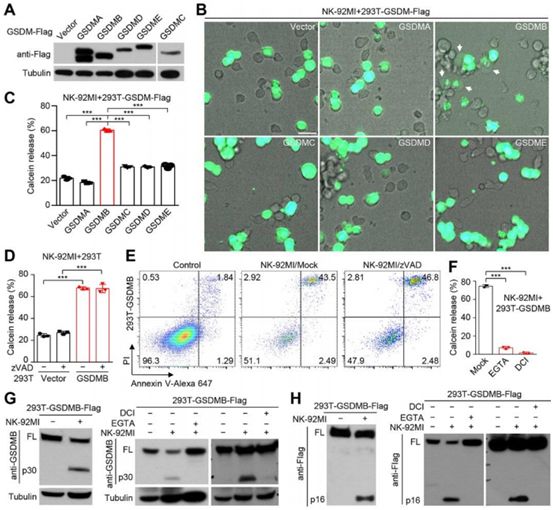
在一项新的研究中,来自中国医学科学院、中国国家生命科学研究所、清华大学、解放军总医院、北京大学和中国科学院生物物理研究所的研究人员报道NK细胞和CTL通过细胞焦亡途径杀死GSDMB阳性细胞。这种杀死作用源自于淋巴细胞产生的GZMA对GSDMB进行结构域间切割,从而激活GSDMB的穿孔活性。干扰素γ(IFN-γ)上调GSDMB表达,并促进细胞焦亡。此外,GSDMB在某些组织---特别是消化道上皮及其衍生性肿瘤---中高度表达。将可被GZMA切割的GSDMB导入小鼠癌细胞可促进小鼠中的肿瘤清除。这些结果确定gasdermin介导的细胞焦亡是一种细胞毒性淋巴细胞杀伤机制,这可能增强抗肿瘤免疫反应。相关研究结果近期发表在Science期刊上,论文标题为“Granzyme A from cytotoxic lymphocytes cleaves GSDMB to trigger pyroptosis in target cells”。
细胞焦亡的促炎性质提示着这种类型的淋巴细胞杀伤作用是免疫原性的,可提高免疫反应。GSDMB在多种健康组织(特别是消化道系统)中的存在表明除了癌症之外,这种GZMA-GSDMB轴可能也在对微生物感染的免疫反应中发挥着重要作用。GZMA在体外表现出较低的细胞毒性,但是在体外表现出较大的促炎性。这种看似矛盾的现象似乎可以通过这项研究中的发现---GZMA介导的细胞焦亡杀伤作用需要GSDMB,但是GSDMB并不在之前用于研究GZMA的细胞中表达---来加以很好的解释。再者,IFN-γ可转录启动GSDMB表达也支持了GSDMB在细胞毒性淋巴细胞介导的杀伤作用中发挥的功能。这就对人们在理解IFN-γ在 针对肿瘤等疾病的免疫反应中所发挥的多种作用提供了新的见解。
重要的是,这项研究发现GSDMB作用于颗粒酶下游,这突显了诸如caspase之类的蛋白裂解酶以及颗粒酶本质上并不是细胞死亡执行蛋白(cell death executor protein)。相反,这些酶切割包括gasdermin在内的多种下游底物,这接着可以启动特定的细胞死亡程序。表达多种死亡执行分子的靶细胞可能对相同的蛋白裂解活性(比如颗粒酶的蛋白裂解活性)作出不同的反应。这提示着不同的靶细胞,即便当它们被相同类型的细胞毒性淋巴细胞类似地识别时,也可能经历不同类型的细胞死亡。因此,在未来对淋巴细胞介导的免疫反应的研究应当更多地关注靶细胞内的死亡执行相关事件,而不是细胞表面分子,比如PD-1。(生物谷 Bioon.com)
参考资料:
Zhiwei Zhou et al. Granzyme A from cytotoxic lymphocytes cleaves GSDMB to trigger pyroptosis in target cells. Science, 2020, doi:10.1126/science.aaz7548.
颗粒酶家族在人类中包括5个成员:颗粒酶A(GZMA)、颗粒酶B(GZMB)、颗粒酶H(GZMH)、颗粒酶K(GZMK)和颗粒酶M(GZMM),而在小鼠中包括11个成员,每个成员都具有它自己的底物特异性。人们对颗粒酶的研究已有30多年了,主要的关注点是两个大量存在的成员(GZMA和GZMB)及其在杀死癌细胞中的作用。GZMB被认为通过切割caspase-3或caspase-3底物来诱导靶细胞凋亡。GZMB的作用并不那么明确。利用装载穿孔素的GZMA进行的体外研究已鉴定出单链DNA损伤和线粒体电子传递链中的多种底物。这导致人们提出一种复杂的不依赖于caspase的细胞凋亡途径,该途径的作用机理是未知的。已知的GZMA切割活性对CTL和NK细胞介导的杀伤作用作出的贡献尚未确定。再者,GZMA敲除小鼠在细胞凋亡上不存在明显的缺陷,而且小鼠GZMA可诱导呈现扭动形态(writhing morphology)的非凋亡性细胞死亡。因此,GZMA的真实功能和作用机制仍然不明确,这可能是因为缺乏足够相关的实验系统。
作为一种促炎性细胞死亡形式,细胞焦亡是先天免疫中的一种至关重要的效应机制。历史上,细胞焦亡曾被认为是caspase-1介导的单核细胞死亡,并伴有IL-1β和IL-18分泌。近期的研究已表明小鼠caspase-11以及它的人类同源蛋白caspase-4和caspase-5也可在脂多糖的直接激活下诱导细胞焦亡。此外,gasdermin D(GSDMD)已被发现是作用于caspase-1和caspase-11/4/5下游的细胞焦亡执行分子。因此,细胞焦亡如今被重新定义为gasdermin介导的程序性坏死(也称为坏死性凋亡)。
GSDMD携带着一个N端穿孔结构域和一个C端抑制性结构域。caspase-1或caspase-11/4/5对GSDMD的结构域间切割(inter-domain cleavage)允许这个N端结构域结合膜磷脂并发生寡聚体化从而在质膜上形成一个较大的大约18nm的孔。作为对细胞焦亡的重新定义的支持,四种其他的gasdermin(GSDMA、GSDMB、GSDMC和GSDME)都具有自我抑制的穿孔结构域,但没有caspase-1/11切割位点。作为另一种得到很好描述的gasdermin,GSDME被caspase-3切割和激活,其方式类似于GSDMD被caspase-1/11切割和激活。GSDME表达可在仅大约10%的癌细胞中明显地检测到。GSDME可将caspase-3介导的细胞死亡从细胞凋亡切换到细胞焦亡,从而使得癌细胞对杀伤试剂更加敏感。这些结果支持早期提出的一个观点:GSDME可能作为一种肿瘤抑制蛋白发挥作用。除了GSDMD和GSDME之外,gasdermin蛋白家族其他成员的激活机制是未知的。

图片来自Science, 2020, doi:10.1126/science.aaz7548。
在一项新的研究中,来自中国医学科学院、中国国家生命科学研究所、清华大学、解放军总医院、北京大学和中国科学院生物物理研究所的研究人员报道NK细胞和CTL通过细胞焦亡途径杀死GSDMB阳性细胞。这种杀死作用源自于淋巴细胞产生的GZMA对GSDMB进行结构域间切割,从而激活GSDMB的穿孔活性。干扰素γ(IFN-γ)上调GSDMB表达,并促进细胞焦亡。此外,GSDMB在某些组织---特别是消化道上皮及其衍生性肿瘤---中高度表达。将可被GZMA切割的GSDMB导入小鼠癌细胞可促进小鼠中的肿瘤清除。这些结果确定gasdermin介导的细胞焦亡是一种细胞毒性淋巴细胞杀伤机制,这可能增强抗肿瘤免疫反应。相关研究结果近期发表在Science期刊上,论文标题为“Granzyme A from cytotoxic lymphocytes cleaves GSDMB to trigger pyroptosis in target cells”。
细胞焦亡的促炎性质提示着这种类型的淋巴细胞杀伤作用是免疫原性的,可提高免疫反应。GSDMB在多种健康组织(特别是消化道系统)中的存在表明除了癌症之外,这种GZMA-GSDMB轴可能也在对微生物感染的免疫反应中发挥着重要作用。GZMA在体外表现出较低的细胞毒性,但是在体外表现出较大的促炎性。这种看似矛盾的现象似乎可以通过这项研究中的发现---GZMA介导的细胞焦亡杀伤作用需要GSDMB,但是GSDMB并不在之前用于研究GZMA的细胞中表达---来加以很好的解释。再者,IFN-γ可转录启动GSDMB表达也支持了GSDMB在细胞毒性淋巴细胞介导的杀伤作用中发挥的功能。这就对人们在理解IFN-γ在 针对肿瘤等疾病的免疫反应中所发挥的多种作用提供了新的见解。
重要的是,这项研究发现GSDMB作用于颗粒酶下游,这突显了诸如caspase之类的蛋白裂解酶以及颗粒酶本质上并不是细胞死亡执行蛋白(cell death executor protein)。相反,这些酶切割包括gasdermin在内的多种下游底物,这接着可以启动特定的细胞死亡程序。表达多种死亡执行分子的靶细胞可能对相同的蛋白裂解活性(比如颗粒酶的蛋白裂解活性)作出不同的反应。这提示着不同的靶细胞,即便当它们被相同类型的细胞毒性淋巴细胞类似地识别时,也可能经历不同类型的细胞死亡。因此,在未来对淋巴细胞介导的免疫反应的研究应当更多地关注靶细胞内的死亡执行相关事件,而不是细胞表面分子,比如PD-1。(生物谷 Bioon.com)
参考资料:
Zhiwei Zhou et al. Granzyme A from cytotoxic lymphocytes cleaves GSDMB to trigger pyroptosis in target cells. Science, 2020, doi:10.1126/science.aaz7548.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


