基因编辑领域研究进展
来源:本站原创 2020-04-21 22:58
本期为大家带来的是基因编辑相关领域的最新研究进展,希望读者朋友们能够喜欢。
2020年4月22日讯/生物谷BIOON/---本期为大家带来的是基因编辑相关领域的最新研究进展,希望读者朋友们能够喜欢。

近日,一项刊登在国际杂志Nature Biotechnology上的研究报告中,来自多伦多大学等机构的科学家们通过研究开发了一种新技术能同时对基因组中多个位点进行编辑,从而就有望帮助研究不同DNA的组合与人类健康和疾病的关联。基于CRISPR的DNA编辑技术能通过对任何人类基因进行精确剔除来研究其功能,从而就能彻底改变科学家们对人类基因组的研究,但目前研究人员仍然面临众多挑战,比如如何在相同细胞中同时移除多个基因或基因片段,这种类型的基因组“手术”对于科学家们而言,了解基因组不同部分在正常生理和疾病状况下是如何协同发挥作用的似乎更为重要。
如今研究人员开发了一种名为CHyMErA(Cas Hybrid for Multiplexed Editing and Screening applications)的新技术,其能应用到任何哺乳动物细胞中,同时系统性地靶向作用多个位点的DNA片段,CRISPR剪刀能通过导向RNA分子将DNA切割酶运送到基因组上的预想位点中,而使用最为广泛的DNA切割酶就是Cas9酶,自Cas9问世以来,科学家们一直寻找其它具有独特特性的Cas酶,以寻求改进和扩展该技术的应用;与CRISPR-Cas9技术不同的是,ChyMErA技术能将Cas9和Cas12a两种不同的DNA切割酶进行结合,从而实现多种用途,Cas12a酶是一种能用来在相同细胞中产生多个导向RNA分子的关键酶类,而这是同时进行DNA编辑的关键。
研究者Thomas Gonatopoulos-Pournatzis表示,我们花费了多年来开发能同时检测Cas9和Cas12a酶的组合性基因编辑技术,随后我们将这些酶类进行结合开发出了ChyMErA系统;研究人员尝试了多种方法来诱导基因片段缺失,但并没有哪一种手段会比ChyMErA更加有效;研究者发现,ChyMErA能够成功剔除基因片段,随后研究者在大规模筛查中利用该技术来系统性地分析基因如何进行结合来发挥作用。在ChyMErA技术的帮助下,研究人员就能够使用两种酶中最好的酶类来进行基因编辑,Cas9已经被广泛改进拥有较高的编辑效率,而Cas12a则能允许多种导向RNAs的使用,因此其在寻找能在基因组中进行位点切割上具有更大的灵活性。
在ChyMErA技术的一项应用中,研究人员靶向作用了称之为旁系同源基因(paralogs)的一对基因,其拥有相似的DNA代码,但由于研究难度极大,因此研究者对其研究很少;因为旁系同源基因是由祖先基因复制而产生的,所以研究者推测其在很大程度上扮演着相似的角色,但通过当前用于基因筛选的单基因靶向技术并不能揭示该基因的功能,更重要的是因为其它的旁系同源基因会弥补所缺失的基因。
研究者Kevin Brown表示,在ChyMErA技术的帮助下,我们就能成对地对这两个基因进行分析来观察是否其祖先基因的功能对于细胞存活至关重要;如今我们就能研究以前被忽略的一类基因了。当敲除了人类基因组上几乎存在的所有(大约700对)旁系同源基因后,研究者通过分析证实,其中很多基因对在细胞生存中都发挥着非常相似的作用,而其它基因则拥有不同的功能。
ChyMErA技术的另一个特点就是,Cas9和Cas12a都能被部署到附近的基因组位点中,来切割诸如外显子等基因片段,这就能够帮助研究人员单独剔除数千个与癌症和大脑功能相关的外显子(这些外显子并不适合单独使用Cas9进行靶向治疗)。外显子通常会以不同的方式被包含在基因的转录物中,并能修饰编辑蛋白的功能,尽管研究者并不清楚单一外显子对细胞过程的贡献量到底如何;研究人员利用ChyMErA技术对2000个外显子进行了分析,他们发现,有超过100个外显子都会细胞存活至关重要,这或许就有望帮助研究人员聚焦这些外显子在多种疾病发生中所扮演的关键角色。
doi:10.1038/s41587-020-0455-x.

许多遗传和育种研究表明,点突变和插入/缺失(插入和缺失, indel)可以改变农作物的优良性状。尽管核酸酶启动的同源介导修复(homology-directed repair, HDR)可以产生这种变化,但它受到效率低的限制。碱基编辑器是用于进行碱基转换的强大工具,但不能用于进行碱基颠换、插入或缺失。因此,迫切需要在植物中可使用的新型基因组工程方法。
在此之前,美国哈佛大学的David R. Liu和他的同事们开发出一种新的称为引导编辑(prime editing)的基因组编辑方法。这种方法使用工程化的Cas9切口酶(H840A)-逆转录酶(RT)融合蛋白和引导编辑向导RNA(prime editing guide RNA, pegRNA),可在人细胞中进行所需的编辑。
在一项新的研究中,中国科学院遗传与发育生物学研究所的高彩霞(Gao Caixia)教授及其研究团队对一种引导编辑系统(prime editing system, PPE)进行优化,从而在两种主要的谷类作物中产生所需的点突变、 插入和缺失。PPE系统的主要成分是Cas9切口酶-RT融合蛋白和pegRNA。相关研究 结果近期发表在Nature Biotechnology期刊上,论文标题为“Prime genome editing in rice and wheat”。
通过使用这种PPE系统,这些研究人员在原生质体中在9个水稻位点和7个小麦位点上产生了所有12种类型的单碱基替换,以及多种点突变和小DNA片段插入,效率高达19.2%。这种PPE系统的编辑效率受到引导结合位点(primer binding site, PBS)和RT模板长度的强烈影响。
尽管这种PPE系统会产生副产物(脱靶效应),但是可以通过优化RT模板长度来减少这些副产物。此外,通过使用针对植物优化的PPE系统,他们发现初始的RT可以被CaMV-RT(来自花椰菜花叶病毒)和反转录子衍生性RT(来自大肠杆菌BL21)替换。通过使用PPE-Ribozyme(PPE-R)并在37°C下孵育,针对一些靶标的引导编辑效率也可得到改善。
高彩霞教授说,“尽管这种PPE系统的效率低于碱基编辑器,但是它仍然是一种吸引人的新工具,可用于产生所有12种类型的单点突变、不同替换的混合物以及插入和缺失。这种系统因此具有巨大的潜力用于开展植物育种和功能基因组学研究。”
DOI:10.1038/s41589-020-0490-4
“基因魔剪”CRISPR-Cas9引起能在特殊靶向位点切割DNA而彻底改变了遗传学领域的研究,如今研究人员能利用Cas9酶来专门关闭基因的表达,或将新型DNA片段插入到基因组中,但不论Cas9有多么专一特殊,其都会切开一些不该切开的位点;近日,一项刊登在国际杂志Nature Chemical Biology上的研究报告中,来自德国马丁路德大学的科学家们通过研究报道了一种新型的Cas9突变体,其或能增加基因编辑的特异性。
为了能让Cas9切割DNA靶点,其就需要在导向RNA的带领下被引入到靶点位置,导向RNA含有DNA靶点的互补序列,其工作原理就好像是邮政编码一样能将Cas9引导到目的靶点,然而有时候Cas9会切割与实际靶点非常相似的DNA序列,这就被称为脱靶效应;CRISPR-Cas9不受欢迎的特性就是可能会导致基因编辑的不准确性,在人类基因组中的错误位置出现意外的切割可能会产生非常深远的影响。
如今科学家们尝试利用不同的方法来优化Cas9的特异性,当前研究中,研究人员就对Cas9中名为螺旋桥(bridge helix)的进化保守结构域进行了深入研究。研究者发现,这种螺旋桥在Cas9与其导向RNA和DNA靶点相互作用上的机制上扮演着关键角色,随后他们识别出了一组氨基酸残基,其能与导向RNA的磷酸骨架接触,从而促进稳定回路结构的形成,后者对于Cas9的活性非常重要,在这种回路结构中,Cas9结合导向RNA就能与DNA靶向序列的互补链进行配对,同时还会替换第二股DNA链,从而使得Cas9就能切割两条DNA链。
doi:10.1126/sciadv.aax2941.
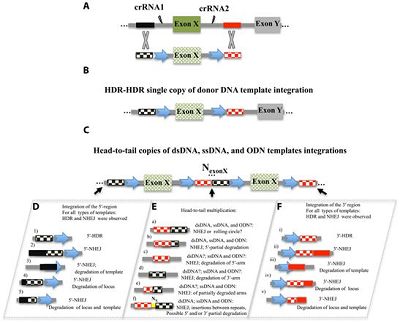
在一项新的研究中,来自德国明斯特大学的研究人员发现,在小鼠进行常规的CRISPR-Cas9基因插入过程中,不必要的DNA重复频率很高。相关研究结果发表在2020年2月21日的Science Advances期刊上,论文标题为“Pervasive head-to-tail insertions of DNA templates mask desired CRISPR-Cas9–mediated genome editing events”。他们描述了他们如何发现不必要的DNA重复,并针对这一点提醒了其他的研究人员。
CRISPR-Cas9是一种在过去十年中开发的基因编辑技术。它切割出基因组中不需要的部分,并插入新的DNA片段。人们已经进行了许多研究来测试这种技术,以期有一天可以将它用于修复导致疾病的遗传缺陷。有关脱靶编辑的报道阻碍了这一目标的实现,这导致了旨在阻止脱靶编辑的新研究。在这项新的研究中,这些研究人员发现这种技术还可以导致大量不想要的DNA重复。
这一发现是偶然的,这是因为作为免疫学研究工作的一部分,他们当时正在研究基因S100A8编码的一种钙结合蛋白。为此,他们使用了CRISPR-Cas9来让这个基因无法表达蛋白,这是一种敲除编辑(knockout editing,即利用CRISPR-Cas9基因编辑剔除靶基因)的形式。他们先进行标准的PCR测试和随后进行更专业的PCR测试来检测靶基因,以确保一切按计划进行。研究结果表明,只有两次编辑取得了成功,这让他们感到吃惊。他们接着将一只成功进行基因编辑的小鼠与一只野生小鼠交配,以了解为何编辑成功率如此之低。通过使用一种特殊类型的PCR对小鼠后代进行的测试显示七只小鼠后代携带经过编辑的基因S100A8,其余的小鼠后代具有不想要的DNA重复。
这些研究人员表示,他们的经验表明,其他人在先前的研究工作中可能具有不想要的基因插入片段拷贝,但是它们并没有记录在案。他们进一步提出科学家们在未来可使用更专业的测试技术。
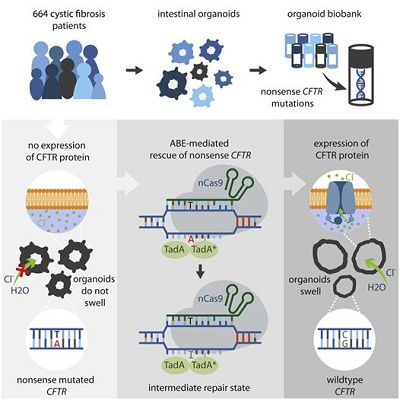
2012年开发的基因组编辑工具CRISPR/Cas9可以将基因中的突变片段切割掉,并用一个未发生突变的片段进行替换,而一种称为碱基编辑器的新型CRISPR可以在不切割DNA的情况下修复突变。因此,使用碱基编辑器进行基因组编辑被认为更安全。如今,在一项新的研究中,来自荷兰乌得勒支研究所和乌得勒支大学等研究机构的研究人员首次证实碱基编辑器可以安全地治愈源自患者的干细胞中的囊性纤维化(cystic fibrosis)。相关研究结果于2020年02月20日在线发表在Cell Stem Cell期刊上,论文标题为“CRISPR-Based Adenine Editors Correct Nonsense Mutations in a Cystic Fibrosis Organoid Biobank”。论文通讯作者为乌得勒支研究所的Hans Clevers和乌得勒支大学的Jeffrey Beekman。
根据乌得勒支研究所生物学家Maarten Geurts和乌得勒支大学生物学家Eyleen de Poel的说法,2018年开发出的一种新的CRISPR酶使得CRISPR技术更精确,更不易出错。Maarten说,“在传统的CRISPR/Cas9基因组中,切割特定的DNA片段会导致DNA损伤。这样做的目的是,细胞使用实验室制造出的'健康'DNA片段来修复这种切割。在称为碱基编辑器的新型CRISPR技术中,对Cas9进行了改进,使得它不再切割DNA,但仍能检测到突变位点,因此,无需切割DNA并替换有缺陷的DNA片段,突变位点可在现场直接修复,从而使得它成为一种更有效的基因组编辑工具。”
微型肠道(minigut)
乌得勒支类器官技术基金会(Hubrecht Organoid Technology foundation)和乌得勒支大学医学中心已构建出一个由肠道类器官组成的生物库。这些肠道类器官都是肠道的微型版本,是在实验室中使用囊性纤维化患者的干细胞建立的。它们用于疾病建模和新疗法的开发。这个生物库由欧洲的许多囊性纤维化中心和荷兰囊性纤维化基金会共同建立。
在这项新的研究中,肠道类器官被用于测试这种新的碱基编辑技术是否可以应用于人类干细胞。Maarten解释了它的作用机制:“囊性纤维化是由CFTR基因中的突变引起的,这种突变导致基因功能异常。结果就是包括肺部在内的许多器官的粘液含水较少,从而导致粘液堆积和器官衰竭。利用这种新的碱基编辑技术就可检测和修复CFTR基因中的突变,同时不会对基因组造成进一步的破坏。”
即使这项新研究表明这种新的CRISPR工具在实验室中是有效的,但这并不意味着患者已经可以从中受益。Eyleen,“这项研究代表着在患者疾病基因修复方面迈出了一大步。但是,仍然存在的一个大问题是如何将CRISPR酶递送到患者的靶器官中。囊性纤维化也可能不是最适合用CRISPR进行治疗的疾病,这是因为许多器官都受到这种疾病的影响。

近日,来自宾夕法尼亚大学医学院的研究人员在《Science Advance》杂志上在线发表的研究表明,一项新的CRISPR基因编辑技术可预防一中由数百种不同突变驱动的遗传性肝病的发生,并改善了小鼠的临床症状。研究结果表明,这种有前途的CRISPR工具可以潜在地治疗因鸟氨酸转氨甲酰酶(OTC)缺乏以及其它同基因不同位点的突变导致的罕见代谢尿素循环异常的患者。
“就像大多数对新生儿具有致命影响的遗传性疾病一样,长期有效的早期治疗至关重要。”文章作者,基因治疗计划和基因治疗主任James Wilson博士说。 “在这里,我们进一步改善了CRISPR技术,不仅可以维持细胞中OTC的表达,还可以扩展其治疗能力。我们的目标是最终将这种基因编辑方法向临床阶段转化,以治疗患有OTC障碍和其他遗传疾病的患者分散在整个基因中的突变,而非单个突变。”
OTC在近40,000例婴儿中存在,该疾病来自OTC基因上的300多种不同突变。由于这些突变发生在X染色体上,因此通常在男性中发现,而女性往往是携带者。尿素循环是一系列由六种肝脏酶完成的代谢过程,有助于排出体内的氨。当这些酶中的其中之一缺失或不足时,氨会在血液中积聚并流向大脑,这可能会导致脑损伤甚至死亡。为了治疗该疾病,患者需要服用药物以刺激替代的氮清除途径,在严重的情况下,可以进行肝移植。但是,这些患者的死亡率仍然很高,因此需要更新,更有效的疗法。
为了开发广泛适用的基因组编辑工具,研究小组构建了一个新的双重AAV载体,其中包含一种称为Cas9的蛋白。宾夕法尼亚州开发的这种载体被称为AAV8,对肝细胞具有特异性。第二个AAV包含一个功能齐全的“小基因”,该基因表达密码子优化的人类OTC(供体DNA),由肝脏特异性启动子驱动,以确保其仅在注入血液后在肝细胞中表达。
结果显示,接受靶向载体治疗的小鼠在第3周和第8周肝脏中分别有25%和35%的细胞表达OTC,这比用非靶向载体治疗的小鼠高出四倍和三倍。研究人员还观察到,与未经治疗的高蛋白饮食小鼠相比,接受治疗的小鼠体内氨水平降低了60%,这一临床迹象表明肝细胞正在产生OTC。
作者称:“通过这些成功的动物研究,我们或许已经找到了潜在的'广谱'基因编辑方法,可以治疗OTC缺乏症的患者,而无需考虑其具体突变类型和临床体征。

根据宾夕法尼亚大学艾布拉姆森癌症中心研究人员发布的最新数据,经过Crispr-Cas9基因编辑的CAR-T细胞可以在癌症患者体内持续存在几个月的时间,并且能够稳定增殖并发挥功能。
该研究是美国首个测试人类基因编辑方法的临床试验,在最近发表在《Science》杂志上的文章中,研究者们介绍了他们对三名患者进行基因编辑CAR-T治疗的I期临床试验结果。
“我们从三名患者获得的数据证明了两项重要的事情。首先,我们可以在制造过程中精确地成功进行多次编辑;其次,到目前为止,这些细胞已显示出持续性的攻击和杀死肿瘤的能力,”文章资深作者Carl June教授说道。这一发现是宾夕法尼亚大学作为细胞和基因治疗先驱的又一成果,该机构此前开发了首个FDA批准的针对儿童和成人血液癌症患者的CAR -T细胞疗法Kymriah。
这项研究中的方法与CAR T细胞疗法密切相关。在传统的CAR T细胞疗法中,患者的免疫细胞经过遗传改造用来对抗癌症。而本次试验的方法有所差异。像CAR T一样,这项研究的研究人员首先收集患者血液中的T细胞。然而,研究者们并没有给这些T细胞转入任何靶向癌细胞抗原的CAR受体分子(例如CD19),而是首先使用CRISPR / Cas9编辑去除了三个关键基因。其中两个基因表达T细胞的天然受体,即TCRa与TCRb基因,第三个基因则表达PD-1,后者被认为是调控T细胞活性的关键“检查点”分子。
“对三名患者的这项新分析已经证实,所制造的细胞包含所有三种编辑,从而首次证实了CRISPR / Cas9技术能够同时靶向人类多个基因的能力。”
一旦敲除了这三个基因,就可以使用慢病毒插入癌症特异性的合成T细胞受体来完成第四次基因修饰,完成修饰的T细胞能够靶向一种称为NY-ESO-1的抗原。
相比原始的CAR-T细胞在体内不到一周的生存期,这项新分析显示,编辑后的细胞可在体内持续存在长达9个月的时间。
在回输患者体内几个月后,研究人员抽取了更多血液,并分离了CRISPR编辑的细胞进行研究。结果表明,这些细胞仍然具有杀死肿瘤的能力。
doi:10.1038/s41586-019-1849-0.
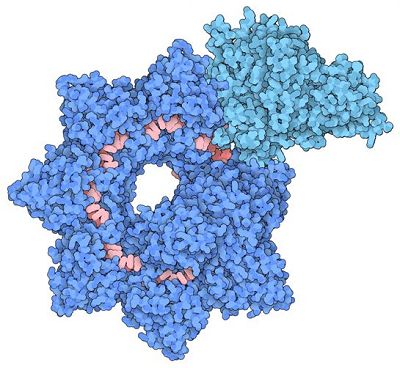
在一项新的研究中,来自美国哥伦比亚大学的研究人员捕捉到一种由对现有的基于CRISPR的工具进行改进而产生的新型基因编辑工具的首批结构图片。他们在霍乱弧菌中发现一种独特的“跳跃基因”并且这种跳跃基因可以在基因组中插入较大的基因负荷(genetic payload,即DNA序列)而不引入DNA断裂,基于此,他们开发出这种称为INTEGRATE的新型基因编辑工具。相关研究结果近期发表在Nature期刊上,论文标题为“Structural basis of DNA targeting by a transposon-encoded CRISPR–Cas system”。论文通讯作者为哥伦比亚大学瓦格洛斯内外科学院生物化学与分子生物物理学助理教授Samuel Sternberg博士和哥伦比亚哥伦比亚大学生物化学与分子生物物理学助理教授Israel Fernandez博士。
在这项新的研究中,这些研究人员利用低温电镜技术冻存正在发挥作用时的这种基因编辑复合物,从而揭示它的工作原理的高分辨率细节。
Sternberg说,“我们在我们之前的研究中展示了如何利用INTEGRATE在细菌细胞中进行靶DNA插入。这些新的图片以令人难以置信的分子细节揭示这种基因编辑复合物的生物学机制,这有助于我们进一步改进这种基因编辑系统。”
开始时与CRISPR一样,但是结局不同
这种结构模型揭示这种基因编辑复合物由两个主要部分组成,这两个主要部分排列成螺旋丝状结构。在这两个主要部分中,较大的部分称为Cascade,缠绕并携带向导RNA(gRNA),用于扫描细胞中匹配的DNA序列。一旦Cascade定位并结合了靶序列,它将使DNA链穿过位于这种基因编辑复合物末端的TniQ“转座”蛋白,并招募其他有助于修饰靶DNA序列的酶。
INTEGRATE的这种扫描机制似乎与其他经过充分研究的CRISPR系统的工作方式相似,其中的一些CRISPR系统也含有带有gRNA的Cascade复合物。但是,与其他使用Cascade靶向DNA进行切割的CRISPR系统不同的是,INTEGRATE中Cascade的功能是靶向DNA以便基因负载的高精度插入。
在之前的研究中,Sternberg及其同事们通过使用遗传学和生物化学提出这种CRISPR分子机器如何在功能上与转座复合物---负责基因“跳跃”的分子---存在关联,这项新的研究证实他们提出的这种观点是正确的。
为何重要?
如今,世界各地的许多科学家们都在使用CRISPR-Cas9来快速低成本地对细胞基因组进行精确修饰。但是,CRISPR的大多数用途涉及切割靶DNA的两条链,然后必须通过宿主细胞自身的分子机器修复DNA断裂。控制这种修复过程仍然是这个领域中的主要挑战,并且不想要的基因编辑常常被无意间引入了基因组中。此外,现有工具在精确地插入较大的基因负荷方面通常表现不佳。提高基因编辑的准确性是人们的当务之急,这对于确保使用这种技术开发的疗法的安全性至关重要。
这种由Sternberg实验室开发的新型INTEGRATE系统可以准确地插入较大的DNA序列,而无需依靠细胞的分子机器来修复断裂的DNA链。因此,相比于目前广泛使用的原始CRISPR-Cas系统,INTEGRATE被证明是一种更准确、更有效的基因修饰方法。这种新工具还可以帮助科学家们在DNA修复活性有限的细胞类型(比如神经元)中进行基因编辑。在神经元中,使用CRISPR进行基因编辑的尝试相对而言不太成功。
下一步是什么
除了为未来的蛋白质工程提供信息之外,这些新结构突出了一个可能的校对检查点。现有的CRISPR技术经常出现所谓的“脱靶效应”,即不加区分地对非靶序列进行修饰。这些新结构揭示了Cascade和TniQ如何协同工作,从而确保仅将DNA片段插入到正确的 “在靶(on-target)”序列中。这些研究人员计划在开发用于疾病的新治疗方法的工具时进一步探究这个检查点。

研究人员发现,该基因C11orf46是大脑发育过程中的重要调控因子。具体来说,它可以打开和关闭方向感应蛋白,帮助引导长纤维从负责发送电信息的新形成的神经元中生长出来,帮助它们形成束状结构,从而束缚大脑的两个半球。这一结构的形成如果无法正常进行,会导致诸如智力残疾,自闭症或其他大脑发育障碍的状况。
约翰·霍普金斯大学医学院精神病学和行为科学副教授,文章作者Atsushi Kamiya博士说:“尽管这项工作还处于早期研究阶段,但是这些发现表明我们可能能够开发出未来的表观基因组编辑疗法,这些疗法可以帮助重塑大脑中的神经连接,并可能防止发生大脑发育障碍。”
该研究在线发表在近日的《Nature Communications》杂志上。
WAGR综合症也称为11p13染色体缺失综合症,当偶然删除位于11p13号染色体上包含C11orf46的区域中的部分或全部基因时,会导致WAGR综合症。研究人员使用shRNA,使小鼠大脑中产生的C11orf46蛋白表达量降低。在具有较低C11orf46的小鼠中,使Semaphorin 6a(一种方向敏感蛋白)的基因表达水平升高。通过使用改良的CRISPR基因组编辑系统,研究人员能够编辑Semaphorin基因调节区域的一部分。对表观基因组的编辑使C11orf46结合并抑制了这些小鼠大脑中的基因,然后将神经元纤维束恢复为正常大脑中发现的束状结构。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


