Nature:揭示肾上腺素激活心脏电压门控钙通道机制,有助开发治疗心脏病的新方法
来源:本站原创 2020-01-27 12:00
2020年1月27日讯/生物谷BIOON/---我们都感受到了肾上腺素冲击的影响。在身体准备对抗或逃离无论是真实的还是想象的威胁时,心跳加速,呼吸加快,肌肉绷紧。肾上腺素在引发战斗或逃避反应(fight-or-flight response)中的作用是生物学中研究最深入的现象之一。然而,这种激素如何刺激心脏功能的确切分子机制仍不清楚。如今,在一项新的研究中,
2020年1月27日讯/生物谷BIOON/---我们都感受到了肾上腺素冲击的影响。在身体准备对抗或逃离无论是真实的还是想象的威胁时,心跳加速,呼吸加快,肌肉绷紧。
肾上腺素在引发战斗或逃避反应(fight-or-flight response)中的作用是生物学中研究最深入的现象之一。然而,这种激素如何刺激心脏功能的确切分子机制仍不清楚。
如今,在一项新的研究中,来自美国哈佛医学院和哥伦比亚大学的研究人员解决了长期以来一直存在的一个谜团,即肾上腺素如何调节一类关键的负责启动心脏细胞收缩的膜蛋白---电压门控钙通道。相关研究结果于2020年1月22日在线发表在Nature期刊上,论文标题为“Mechanism of adrenergic CaV1.2 stimulation revealed by proximity proteomics”。论文通讯作者为哥伦比亚大学瓦格洛斯内外科学院医学教授Steven Marx博士和哈佛医学院系统药理学实验室蛋白质组学主任Marian Kalocsay博士。
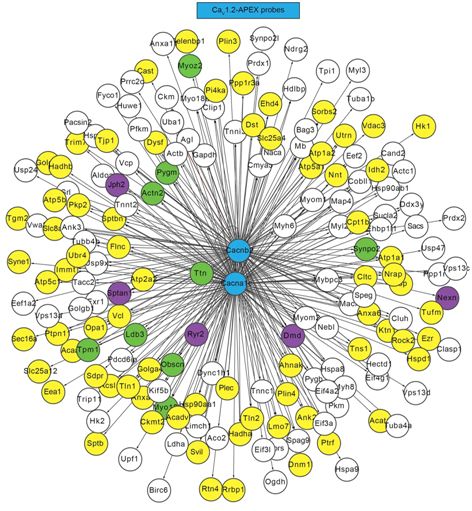
这些研究人员通过使用一种称为邻近蛋白质组学(proximity proteomics)的技术,发现在正常条件下,一种名为Rad的蛋白质会抑制钙通道的活性。当心脏细胞暴露于一种模拟肾上腺素的药物时,Rad从钙通道释放出来,从而导致这种钙通道活性的增加和更强的心脏跳动。这些发现提供了肾上腺素如何刺激心脏的机制描述并为心血管药物发现提供新靶标。
这些作者说,特别地,这些结果可能为开发与β受体阻滞剂同样有效但可能比β受体阻滞剂更安全的药物开辟了新途径。β受体阻滞剂是一类广泛使用的处方药物,可阻断肾上腺素的作用,以解决诸如高血压之类的心血管问题。
Kalocsay说,“在正常情况下,心脏中的钙通道可以有效地起作用,但是它们存在起着手刹作用的Rad蛋白。当我们需要全力时,肾上腺素会释放这种手刹,以便这些钙通道打开得更快,从而给我们提供对抗或逃离危险所需的动力。”
这些作者指出这些发现为其他领域(特别是神经科学)的研究人员提供了有趣的新见解,这是因为电压门控钙通道在神经元兴奋中起着重要作用。
缺失的环节
作为心脏功能的主要驱动力,电压门控钙通道嵌入在心肌细胞的细胞膜中。这些通道打开和关闭以控制钙离子流入心肌细胞。当它们打开时,钙离子的流入会引发心脏收缩。
肾上腺素通过激活一种称为PKA的蛋白来刺激电压门控钙通道,进而激活这种钙通道。几十年来,人们一直认为PKA通过改变这种钙通道上称为PKA磷酸化位点的特定区域来做到这一点,但是越来越多的证据表明这一假设是错误的。
在这项新的研究中,这些研究人员对小鼠进行基因改造,使得它们的心肌细胞缺乏PKA磷酸化位点。他们发现这些经过基因改造的心肌细胞当受到肾上腺素样药物刺激时仍会继续做出反应,这表明存在未知因子。
这些研究人员采用了近距离蛋白质组学,即一种允许他们鉴定电压门控钙通道附近(距离大约20nm)的几乎每种蛋白的技术。在暴露于肾上腺素样药物之前和之后,他们分析了小鼠心肌细胞和完整的功能性小鼠心脏中的蛋白。
这一分析显示,仅蛋白Rad在肾上腺素暴露后始终表现较大的水平变化,它在电压门控钙通道附近降低了大约30%至50%。
为了进一步开展研究,这些研究人员让正常情形下不表达Rad和电压门控钙通道的人肾细胞表达它们,从而在心脏细胞外面来重建这种信号转导系统。当同时表达Rad和钙通道的人肾细胞暴露于肾上腺素样药物时,这种钙通道的活性急剧增加。缺乏Rad的人肾细胞几乎没有反应。他们说,到目前为止,由于缺少作为重要成分的Rad,所以不可能以这种方式重现钙通道调节。
进一步的实验证实了Rad的功能是抑制电压门控钙通道的活性。当给予肾上腺素样信号时,PKA会修饰Rad蛋白的特定区域,Rad蛋白随后从钙通道脱离下来以增加钙通道的活性。
简单,优雅
鉴于电压门控钙通道在多种器官功能中起着至关重要的作用,这一发现开辟了新的研究途径。
此外,这项新的研究中使用的技术,包括定量质谱和串联质谱标记技术,允许人们能够以前所未有的精度探测蛋白生物学和相互作用,包括完整的功能性器官中的蛋白行为。
这些研究人员说,这些发现有助于开发为新的治疗方法。比如,破坏Rad和钙通道之间的相互作用可能通过增加钙流入细胞来增强心脏功能。相反,阻断PKA对Rad的修饰可能代表着另一种比β受体阻滞剂更精确的减少钙离子流入心脏的策略。
Marx说,“令人兴奋的是最终解决了心脏钙通道在战斗或逃跑反应中如何受到刺激。40多年来,这个谜团一直难以解开。最终,这种内在机制经证实是简单而优雅的。有了这些信息,我们可以潜在地开发靶向这种途径来治疗心脏病的新药物。”(生物谷 Bioon.com)
参考资料:
1.Guoxia Liu et al. Mechanism of adrenergic CaV1.2 stimulation revealed by proximity proteomics. Nature, 2020, doi:10.1038/s41586-020-1947-z.
2.Study reveals missing link in mechanisms underlying fight-or-flight response
https://medicalxpress.com/news/2020-01-reveals-link-mechanisms-underlying-fight-or-flight.html
肾上腺素在引发战斗或逃避反应(fight-or-flight response)中的作用是生物学中研究最深入的现象之一。然而,这种激素如何刺激心脏功能的确切分子机制仍不清楚。
如今,在一项新的研究中,来自美国哈佛医学院和哥伦比亚大学的研究人员解决了长期以来一直存在的一个谜团,即肾上腺素如何调节一类关键的负责启动心脏细胞收缩的膜蛋白---电压门控钙通道。相关研究结果于2020年1月22日在线发表在Nature期刊上,论文标题为“Mechanism of adrenergic CaV1.2 stimulation revealed by proximity proteomics”。论文通讯作者为哥伦比亚大学瓦格洛斯内外科学院医学教授Steven Marx博士和哈佛医学院系统药理学实验室蛋白质组学主任Marian Kalocsay博士。

图片来自Nature, 2020, doi:10.1038/s41586-020-1947-z。
这些研究人员通过使用一种称为邻近蛋白质组学(proximity proteomics)的技术,发现在正常条件下,一种名为Rad的蛋白质会抑制钙通道的活性。当心脏细胞暴露于一种模拟肾上腺素的药物时,Rad从钙通道释放出来,从而导致这种钙通道活性的增加和更强的心脏跳动。这些发现提供了肾上腺素如何刺激心脏的机制描述并为心血管药物发现提供新靶标。
这些作者说,特别地,这些结果可能为开发与β受体阻滞剂同样有效但可能比β受体阻滞剂更安全的药物开辟了新途径。β受体阻滞剂是一类广泛使用的处方药物,可阻断肾上腺素的作用,以解决诸如高血压之类的心血管问题。
Kalocsay说,“在正常情况下,心脏中的钙通道可以有效地起作用,但是它们存在起着手刹作用的Rad蛋白。当我们需要全力时,肾上腺素会释放这种手刹,以便这些钙通道打开得更快,从而给我们提供对抗或逃离危险所需的动力。”
这些作者指出这些发现为其他领域(特别是神经科学)的研究人员提供了有趣的新见解,这是因为电压门控钙通道在神经元兴奋中起着重要作用。
缺失的环节
作为心脏功能的主要驱动力,电压门控钙通道嵌入在心肌细胞的细胞膜中。这些通道打开和关闭以控制钙离子流入心肌细胞。当它们打开时,钙离子的流入会引发心脏收缩。
肾上腺素通过激活一种称为PKA的蛋白来刺激电压门控钙通道,进而激活这种钙通道。几十年来,人们一直认为PKA通过改变这种钙通道上称为PKA磷酸化位点的特定区域来做到这一点,但是越来越多的证据表明这一假设是错误的。
在这项新的研究中,这些研究人员对小鼠进行基因改造,使得它们的心肌细胞缺乏PKA磷酸化位点。他们发现这些经过基因改造的心肌细胞当受到肾上腺素样药物刺激时仍会继续做出反应,这表明存在未知因子。
这些研究人员采用了近距离蛋白质组学,即一种允许他们鉴定电压门控钙通道附近(距离大约20nm)的几乎每种蛋白的技术。在暴露于肾上腺素样药物之前和之后,他们分析了小鼠心肌细胞和完整的功能性小鼠心脏中的蛋白。
这一分析显示,仅蛋白Rad在肾上腺素暴露后始终表现较大的水平变化,它在电压门控钙通道附近降低了大约30%至50%。
为了进一步开展研究,这些研究人员让正常情形下不表达Rad和电压门控钙通道的人肾细胞表达它们,从而在心脏细胞外面来重建这种信号转导系统。当同时表达Rad和钙通道的人肾细胞暴露于肾上腺素样药物时,这种钙通道的活性急剧增加。缺乏Rad的人肾细胞几乎没有反应。他们说,到目前为止,由于缺少作为重要成分的Rad,所以不可能以这种方式重现钙通道调节。
进一步的实验证实了Rad的功能是抑制电压门控钙通道的活性。当给予肾上腺素样信号时,PKA会修饰Rad蛋白的特定区域,Rad蛋白随后从钙通道脱离下来以增加钙通道的活性。
简单,优雅
鉴于电压门控钙通道在多种器官功能中起着至关重要的作用,这一发现开辟了新的研究途径。
此外,这项新的研究中使用的技术,包括定量质谱和串联质谱标记技术,允许人们能够以前所未有的精度探测蛋白生物学和相互作用,包括完整的功能性器官中的蛋白行为。
这些研究人员说,这些发现有助于开发为新的治疗方法。比如,破坏Rad和钙通道之间的相互作用可能通过增加钙流入细胞来增强心脏功能。相反,阻断PKA对Rad的修饰可能代表着另一种比β受体阻滞剂更精确的减少钙离子流入心脏的策略。
Marx说,“令人兴奋的是最终解决了心脏钙通道在战斗或逃跑反应中如何受到刺激。40多年来,这个谜团一直难以解开。最终,这种内在机制经证实是简单而优雅的。有了这些信息,我们可以潜在地开发靶向这种途径来治疗心脏病的新药物。”(生物谷 Bioon.com)
参考资料:
1.Guoxia Liu et al. Mechanism of adrenergic CaV1.2 stimulation revealed by proximity proteomics. Nature, 2020, doi:10.1038/s41586-020-1947-z.
2.Study reveals missing link in mechanisms underlying fight-or-flight response
https://medicalxpress.com/news/2020-01-reveals-link-mechanisms-underlying-fight-or-flight.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


