多发性硬化症口服新药:渤健Tecfidera升级产品Vumerity胃肠道耐受性大幅改善!
来源:本站原创 2019-11-26 09:44
2019年11月26日讯 /生物谷BIOON/ --渤健(Biogen)近日公布Vumerity(diroximel fumarate,BIIB098)III期EVOLVE-MS-2研究的详细数据。Vumerity是一款于10月底获美国FDA批准治疗复发型多发性硬化症(RMS)的口服新药,数据显示,与Tecfidera(dimethyl fumarate,DMF,富马酸二甲酯)相比,Vumerit

2019年11月26日讯 /生物谷BIOON/ --渤健(Biogen)近日公布Vumerity(diroximel fumarate,BIIB098)III期EVOLVE-MS-2研究的详细数据。Vumerity是一款于10月底获美国FDA批准治疗复发型多发性硬化症(RMS)的口服新药,数据显示,与Tecfidera(dimethyl fumarate,DMF,富马酸二甲酯)相比,Vumerity在患者评估的胃肠道(GI)耐受性方面显示出改善。
EVOLVE-MS-2是一项多中心、双盲、阳性药物对照、为期5周的III期研究,在506例复发缓解型多发性硬化症(RRMS)患者中开展,旨在评估Vumerity相对于Tecfidera的耐受性,包括持续时间和严重程度。研究主要终点评估了在个体胃肠道症状及影响量表(IGISIS)评分表上症状强度评分≥2的GI症状的患者报告天数。次要终点评估整个研究群体中患者报告的IGISIS强度评分≥1或≥3 GI症状的天数(相对于暴露),仅B部分患者中IGISIS强度评分≥2 GI症状天数,整个研究群体中总体胃肠道症状和影响量表(GGISIS)强度评分≥1、≥2或≥3 GI症状天数,按研究周的最差(即最高)IGISIS个别症状评分。完成5周治疗期的患者有资格参加EVOLVE-MS-1,这是针对Vumerity的一项为期96周的开放标签安全性研究。
值得一提的是,EVOLVE-MS-2是第一项直接比较2种RMS治疗药物GI耐受性的研究。结果显示,与Tecfidera相比,Vumerity与五种主要GI症状的持续时间、严重程度和每日影响显著缩短相关。主要终点的结果显示,与Tecfidera相比,Vumerity治疗的患者自我报告的IGISIS强度评分≥2的天数减少了46%(调整后的比值比[95%CI]:0.54[0.39-0.75],p=0.0003)。IGISIS是一种新的探索性量表,用于患者自我评估主要胃肠道症状的强度和持续时间,包括恶心、呕吐、上下腹痛和腹泻。在该研究中,Tecfidera观察到的结果与该药已知的安全性一致。
此外,结果还表明,与Tecfidera相比,Vumerity治疗的患者:(1)因GI不良事件(AE)导致的停药率低(0.8% vs 4.8%);(2)IGISIS强度评分≥1和≥3的天数较少(相对减少29%,相对减少44%);(3)在总体胃肠道症状和影响量表(GGISIS)中,自我报告的强度评分≥1(减少30%)的天数较少,该量表评估了胃肠道症状的总体强度、对日常活动的影响以及它们的烦扰程度。GGISIS强度评分≥2和≥3的天数也较少。(4)在五周治疗期间,最差IGISIS强度评分逐渐下降。
上述采用患者评估症状强度量表的结果,得到了较低的研究调查员报告的GI AE发生率的支持(Vumerity 34.8%,Tecfidera 49.0%)。总的AE发生率,Vumerity治疗组为78.3%,Tecfidera治疗组为83.7%。大多数AE的严重程度为轻度或中度。因AE导致研究停止的患者比例,Vumerity治疗组为1.6%,Tecfidera治疗组为5.6%。
渤健研发执行副总裁兼首席医疗官Alfred Sandrock表示:“我们知道每个病人在多发性硬化症中的旅程可能有很大的不同,因此渤健的目标是通过我们广泛的多发性硬化症组合来实现个人治疗目标。Tecfidera是一种对患者有临床意义的治疗方法,我们相信Vumerity现在建立在我们的专营权之上,是复发性MS的另一个令人信服的选择。”
Vumerity于今年10月底获得美国FDA批准,该药是一种新型口服富马酸药物,具有独特的化学结构,用于复发型多发性硬化症(RMS)的治疗,包括临床孤立综合征、复发缓解型疾病和活动性继发进展型疾病。Vumerity由Alkermes研制,渤健拥有Vumerity商业化的独家全球授权,该药已经在美国上市。根据渤健与Alkermes达成的许可及合作协议条款,此次FDA批准,将触发渤健向Alkermes支付一笔1.5亿美元的里程碑金。
Vumerity属于免疫抑制剂,每日口服2次,属于控释剂型的富马酸单甲酯(MMF)前药,可在体内快速转化为MMF,MMF具有免疫调节和神经保护作用。多发性硬化症(MS)的神经元变性与氧化应激有关,MMF具有抗氧化性能,可能有助于保护髓鞘、绝缘神经纤维。具体而言,MMF激活Nrf2通路,参与细胞对氧化应激的反应,可能保护神经元细胞免受损伤。MMF的免疫调节作用可能与抑制核因子-κB(NF-kB)介导的通路有关,而核因子-κB在免疫系统中起着关键作用。
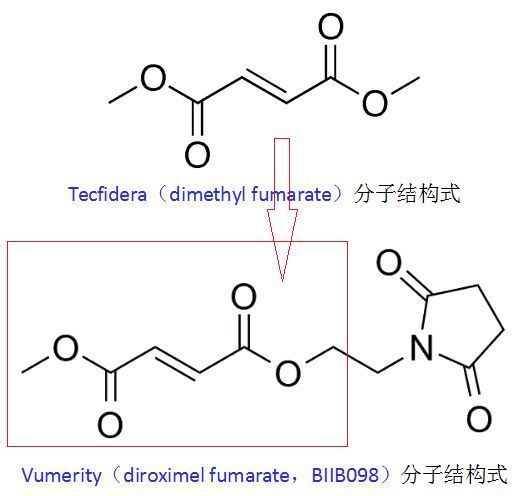
Vumerity是治疗RMS的一种新的口服治疗方案,该药是渤健已上市药物Tecfidera(dimethyl fumarate,DMF,富马酸二甲酯)的升级版,具有改善的胃肠道耐受性。在临床研究中已被证实具有良好的疗效、安全性和耐受性。Vumerity因与Tecfidera的化学结构差异而具有差异化的胃肠道(GI)耐受性。Tecfidera在体内可转化为MMF发挥作用,该药推荐起始剂量为每次120mg、每日2次、持续7日,之后维持剂量为每日240mg、每日2次、随餐或空腹服用均可。

FDA对Vumerity的批准,基于505(b)(2)监管途径提交的新药申请(NDA)。该NDA中包含了将Vumerity和Tecfidera进行比较以建立生物等效性的药物动力学桥接研究数据,并部分基于FDA对Tecfidera的安全和疗效结果。该药NDA中也纳入了关键性III期临床研究EVOLVE-MS-1的中期暴露和安全性发现。这是一项单臂、开放标签、2年安全性研究,正在评估Vumerity在复发缓解型多发性硬化症(RRMS)患者中的长期安全性。该研究在NDA提交时的中期结果包括:因不良事件导致Vumerity治疗中断的总体发生率低(6.3%),且因胃肠道(GI)不良事件导致Vumerity治疗中断的患者比例不到1%。该研究的其他探索性疗效终点显示,临床和放射学指标与基线相比发生了变化。
Vumerity临床开发项目的关键组成部分包括EVOLVE-MS-1研究、比较Vumerity与Tecfidera的药物动力学桥接研究、EVOLVE-MS-2研究。
Tecfidera是渤健的一款重磅MS药物,该药是全球处方量最大的口服MS药物,也是唯一一个拥有超过10年临床经验的靶向性、高疗效MS药物。在2017年,Tecfidera销售额(42.14亿美元)首次超越梯瓦/武田的肽类药物Copaxone(醋酸格拉替雷),成为全球最畅销的MS药物。根据百健今年1月底发布的2018年业绩报告,Tecfidera在2018年的销售额为42.74亿美元。
在MS领域,渤健是绝对的霸主,除了Tecfidera之外,该公司另2款药物Avonex(干扰素β-1a)和Tysabri(natalizumab)在2018年的全球销售额也分别达到了19.15亿美元和18.64亿美元。(生物谷Bioon.com)
原文出处:Biogen Presents Data Demonstrating Improved Gastrointestinal Tolerability With VUMERITY™ (diroximel fumarate) Compared to TECFIDERA® (dimethyl fumarate)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


