全文编译!我国科学家发表Science论文解析非洲猪瘟病毒的高分辨率三维结构并揭示它的组装机制
来源:本站原创 2019-11-18 10:54
2019年11月18日讯/生物谷BIOON/---非洲猪瘟(African swine fever, ASF)于1921年在肯尼亚首次被发现,是一种高度传染性的猪病毒性疾病,依据强毒性的病毒分离株测得的死亡率接近100%。在过去的十年中,ASF已传播到高加索、俄罗斯联邦和东欧的许多国家,这构成了进一步传播的严重风险。在2019年1月至2019年9月期间,26个国家向世界动物卫生组织(World O
2019年11月18日讯/生物谷BIOON/---非洲猪瘟(African swine fever, ASF)于1921年在肯尼亚首次被发现,是一种高度传染性的猪病毒性疾病,依据强毒性的病毒分离株测得的死亡率接近100%。在过去的十年中,ASF已传播到高加索、俄罗斯联邦和东欧的许多国家,这构成了进一步传播的严重风险。在2019年1月至2019年9月期间,26个国家向世界动物卫生组织(World Organization for Animal Health, OIE)通报了新的或正在发生的疫情:欧洲13个国家,亚洲10个国家,非洲3个国家。在没有疫苗或治疗方法的情况下,扑杀猪是控制疫情爆发的最有效方法,在2018~2019年间有超过3000万头猪被扑杀。据估计,ASF大流行给全球养猪业造成了20亿美元的经济损失。作为导致ASF的病毒,非洲猪瘟病毒(African swine fever virus, ASFV)在环境中稳定,可在猪之间快速有效地传播。
ASFV是非洲猪瘟病毒科(Asfarviridae)的唯一成员,也是唯一已知的DNA虫媒病毒(一种用于描述由节肢动物传播的任何病毒的术语)。尽管与其他的核质大DNA病毒(NCLDV)具有相同的结构、基因组特性和复制特性,但ASFV的不同之处在于它具有多层结构和整体二十面体形态。细胞内ASFV包含50多种蛋白,具有一个包含基因组的类核(第一层),这个类核(nucleoid)被一个厚的称为核壳(core shell)的蛋白层(第二层)包围,这个蛋白层被一个内脂质膜(第三层)和二十面体蛋白衣壳(第四层)依次包裹着。当这种病毒穿过质膜出芽变成细胞外ASFV时,它获得了外囊膜(第五层)。关于这种感染性病毒颗粒(virion)的组成和结构以及负责诱导猪中保护性免疫反应的病毒蛋白的鉴定方面存在的知识上的巨大空白阻碍了疫苗的开发。
ASFV靶向巨噬细胞,即主要存在于血液和骨髓中的单核细胞。在一项新的研究中,来自中国科学院生物物理研究所、中国科学院大学、中国农业科学院、上海科技大学、清华大学和南开大学的研究人员从30~40天大的无特定病原体(specific pathogen-free, SPF)猪中分离出猪骨髓细胞(PBM细胞),然后在原代PBM细胞中进行ASFV(从中国一个爆发ASF流行病的农场的猪脾样本中分离出的毒株HLJ-2018)增殖,从细胞上清液中纯化出细胞外ASFV病毒颗粒,然后用甲醛灭活这些病毒颗粒。他们利用低温电镜(cryo-EM)研究了这些纯化出的病毒颗粒。细胞外ASFV病毒颗粒的平均直径为260~300 nm,比以前的观察结果(大约200 nm)大得多,这可能是由于病毒颗粒不完整或在低温电镜观察之前对样品进行了脱水处理。相关研究结果近期发表在Science期刊上,论文标题为“Architecture of African swine fever virus and implications for viral assembly”。论文通讯作者为中国农业科学院哈尔滨兽医研究所所长步志高(Zhigao Bu),中国科学院院士饶子和(Zihe Rao)和中国科学院研究员王祥喜(Xiangxi Wang)。
像大多数NCLDV一样,ASFV病毒颗粒的大小(直径250~500 nm)和潜在的柔性将它的结构解析分辨率限制在10 Å(埃米,纳米的十分之一)以下。在这项新的研究中,这些研究人员通过对43811个ASFV病毒颗粒进行均化处理,获得了分辨率为8.8Å的二十面体ASFV重建结构图。该三维重建结构图清楚地显示了ASFV的所有五个层的结构,其中衣壳(第四层)的最大直径为250 nm,第三层是70Å厚的脂质双层膜,它包裹着直径180纳米的核壳(第二层)。这三层呈现整体二十面体形态,大致遵循衣壳确定的轮廓(图1A)。然而,由于二十面体均化处理导致的某些结构特征的丢失,最外层的外囊膜和最内层的类核呈现较弱的密度。
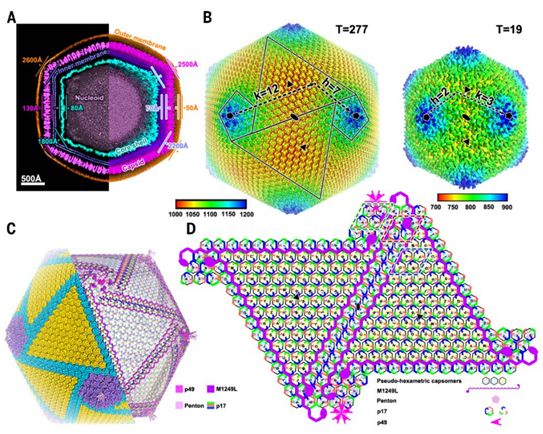
通过使用优化的“基于分块(block-based)的”重构方法,再结合梯度散焦校正(gradient defocus correction)方法,可将衣壳重建的分辨率提高到4.8Å(图1,补充附图S2和S3)。ASFV的衣壳由2760个伪六聚体壳粒(pseudo-hexamericcapsomer)和12个五聚体壳粒(pentamericcapsomer)构成,按T=277二十面体晶格排列(h=7, k=12)(图1B)。在这个晶格中,有12个五重对称壳粒聚集体(pentasymmetron, 包含30个伪六聚体壳粒和一个五聚体壳粒)和20个三重对称壳粒聚集体(trisymmetron,包含120个伪六聚体壳粒)。类似的结构也在其他的NCLDV中观察到。值得注意的是,三重对称壳粒聚集体中的壳粒都以基本相同的方向进行包装,相对于相邻的三重对称壳粒聚集体中的壳粒旋转了大约60°,从而在衣壳上形成30个拉链结构(zipper, 用分割线表示)。此外,单独重建到9Å分辨率的ASFV核壳显示出180个带有一个中央通道(直径30Å)和12个被10根天线包围的海星状五邻体(penton)的6叶螺旋桨状壳粒,结果产生T=19的二十面体晶格(图1B)。
ASFV衣壳的伪六聚体壳粒的低温电镜结构图通过对存在于三重对称壳粒聚集体中的等效拷贝进行局部均化处理而得到进一步改善,从而获得4.1Å的分辨率(图2A和补充附图S3)。衣壳蛋白的骨架和许多侧链可被明确确定,这使得这些研究人员能够构建ASFV主要衣壳蛋白p72的原子模型。每个伪六聚体壳粒由3个p72分子组成,一种五邻体蛋白(一种不是p72的蛋白)的5个拷贝构成一个五聚体壳粒。装饰衣壳内表面的许多其他未解释的密度代表次要的衣壳蛋白(图1C),它们很可能有助于衣壳组装并保持衣壳外壳的稳定性。为了确定这些次要衣壳蛋白的潜在身份,他们通过质谱分析了在PBM细胞中增殖后产生的细胞外ASFV病毒颗粒的蛋白组成,鉴定出63种病毒蛋白和25种宿主细胞蛋白,相比于近期对Vero细胞培养的ASFV毒株BA71的蛋白质组分析结果,多了13种病毒蛋白。这些次要衣壳蛋白应当在这些病毒蛋白中。将蛋白组学分析、ASFV颗粒中的蛋白丰度水平、低温电镜图相似性与预测的靶蛋白结构特征(包括蛋白序列、蛋白二级结构和蛋白拓扑结构)结合起来,导致鉴定出这种五邻体蛋白(H240R)和三种次要衣壳蛋白(p17,p49和M1249L)(图1C)。衣壳外壳(outer capsid shell)的每个二十面体不对称单元包含46个伪六聚体壳粒,其中的6个伪六聚体壳粒位于五重对称壳粒聚集体(a、b、c、d、e和f)中,剩下的40个位于三重对称壳粒聚集体(A,B,C,D, E,F,G,H,I,J,K,L,M,N,O,P,Q,R,S,T,U,V,W,X,Y,Z,A',B', C'D',E',F',G',H',I',J',K',L',M'和N')中。这种五邻体蛋白和这三种次要衣壳蛋白(p17,p49和M1249L)在衣壳外壳正下方形成一个复杂的网络,从而让整个衣壳保持稳定(图1,C和D)。
鉴于细胞内ASFV和细胞外ASFV都具有传染性这一事实,组合使用通过靶向外膜蛋白和衣壳蛋白来阻断这两种类型感染的抗体才能有效抵抗ASFV。p72是关键的保护性抗原之一,针对它的单克隆抗体已显示出能中和强毒性的ASFV分离株。p72在病毒衣壳上形成同源三聚体,每个单体采用双果冻卷(double jelly-roll)结构,从而构成伪六聚体壳粒(也称为p72壳粒)。在许多其他病毒衣壳蛋白(图2B,补充附图S4和S5)中也发现了类似的双果冻卷褶皱结构,包括腺病毒,噬菌体PRD1和牛痘病毒。由八个反平行β链(从B到I)组成的单果冻卷结构(single jelly-roll)存在于更多的病毒衣壳蛋白中,这是起源自共同祖先的标志。与其他的双果冻卷衣壳蛋白一样,D1E1、D2E2、F1G1和H1I1环中的四个插入片段形成暴露区域(ER)。这些ER与N端基底结构域共同决定了不同病毒类型之间的特异性差异。在空间结构上,p72壳粒的冠状结构由ER1及其邻近的ER2形成,并朝向衣壳的外侧,这可能有助于一个构象表位的形成。同一亚基中来自ER3和ER4的β链构成了一个形成p72壳粒头部的四链β折叠(four-stranded β-sheet),这可能代表了另一个构象表位。被ER1、ER2和ER4包围的ER3可能连接这两个构象表位。这四个ER很可能确定了这些中和性表位,可用于指导ASF疫苗设计(图2,B和C)。
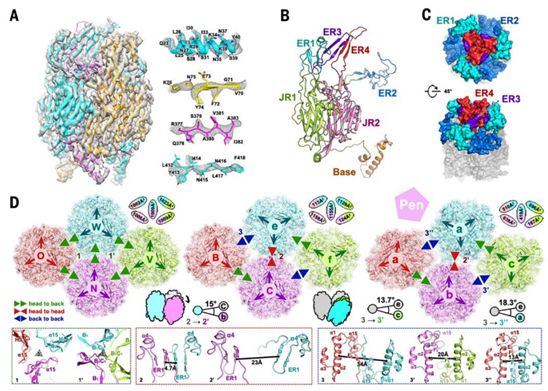
p72壳粒除了包围五邻体来填充五重对称壳粒聚集体外,还堆积在一起形成三重对称壳粒聚集体和拉链结构(图1,C和D)。 p72壳粒采用不同的排列方式以允许三种不同的组装模式:“头对背”,“头对头”和“背对背”(图2D)。在三重对称壳粒聚集体内,所有p72壳粒头对背排列以构建两种类型的p72壳粒三聚体(图2D中标记为1和1',其中类型1在拟等价三重轴(quasi-equivalent threefold axis)上的相互作用较小,而类型1'在在拟等价三重轴上具有较紧密的关联性)(图2D)。在拉链结构和五重对称壳粒聚集体中,p72壳粒具有所有三种接触模式,其中“头对头”关联以两种形式存在(图2D中标记为2和2'),而“背对背”相互作用发生在三种不同的微环境中(在图2D中标记为3、3'和3'')。拉链结构中的“头对头”相互作用紧密贴近由两个相邻的ER1形成的一个四链β-折叠,而五重对称壳粒聚集体中的相应相互作用由于p7壳粒的相对旋转而显著降低,这种相对旋转是五重对称壳粒聚集体中较高的曲率导致的(图2D)。相比之下,与在3’’微环境中形成四螺旋束的五重对称壳粒聚集体中的“背靠背”接触相比,拉链结构中的背对背接触是最弱的(图2D)。总的来说,拉链结构中的“背对背”接触和五重对称壳粒聚集体中的所有三种接触方式似乎不足以促进高阶结构的组装,这表明次要衣壳蛋白是构建触发整个衣壳组装的网络所需要的。
与壳粒之间较少的接触相关的是,五邻体和三种次要衣壳蛋白增强了五重对称壳粒聚集体中的相互作用(图3)。在衣壳外壳五重顶点处的五邻体呈现出一个单果冻卷结构和一个球状帽结构(图3A),这表明这种五邻体蛋白不同于p72,但与p72存在同源关系,这与某些已知的大型dsDNA病毒(比如,PBCV-1病毒、噬菌体Mavirus和噬菌体PRD1等)中的结构观察结果相一致。噬菌体Mavirus五邻体蛋白结构在这些研究人员重建的图谱中进行灵活拟合是非常简单的,这种因为它的果冻卷褶皱结构排列得很整齐(图3A)。利用噬菌体Mavirus五邻体蛋白在所有ASFV开放阅读框(ORF)中进行Protein BLAST搜索,鉴定出一个与它的序列相似性为37.7%的同源蛋白,即H240R,这是一种未被注释的但却是必不可少的病毒颗粒蛋白(图S7)。H240R具有240个氨基酸残基,富含β链,据预测具有单果冻卷褶皱结构和一个长大约70个氨基酸的N端延伸片段(补充附图S8),这进一步支持了这种五邻体在ASFV中的身份。在五邻体的下面,观察到弱的灯笼状密度(大约9Å)将五邻体和内膜连接起来,并将五个相邻的壳粒结合在一起,据猜测这在顶点的组装中起作用(图3,A和C)。先前的研究报道,这种假定的衣壳蛋白p49(B438L)是形成衣壳顶点所必需的,并且紧邻衣壳顶点。此外,作为一种膜内在蛋白,p49不参与病毒颗粒从组装位点到质膜的运输,这表明它可能位于衣壳内壳(inner shell of capsid)上。根据这些观察结果,这些研究人员提出这些灯笼状密度是p49的5个拷贝(图3,A和C)。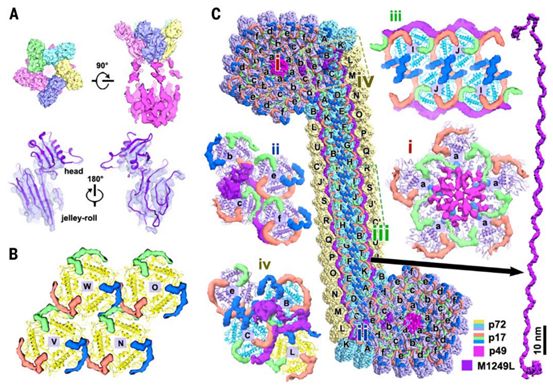
内膜蛋白p17(D117L)是必需的且高度丰富的蛋白,是衣壳组装和二十面体形态发生所必需的。这些研究人员的重构图显示了在p72壳粒下重复出现的密度。由三个连续的α-螺旋组成的蛇形结构与p17胞外结构域的二级结构预测非常吻合(图3B,补充附图S9),并支持蛋白丰度分析结果,这表明这些重复出现的密度为p17。 p17与p72的基底结构域紧密结合,p17的三个拷贝环绕衣壳内壳中的每个p72壳粒,从而将p72 壳粒牢固地锚定在内膜上(图3B)。有趣的是,在1型微环境下,来自三个相邻的p72壳粒的三个p17s紧密交错,介导了三个壳粒之间的相互作用(图2D和3B)。这些相互作用以及在1’型微环境下三个衣壳中的相互作用共同指导了构建成大部分衣壳的三重对称壳粒聚集体中p72壳粒的有序堆积。
然而,五重对称壳粒聚集体和拉链结构内的微环境更为复杂。在这里,骨架蛋白M1249L将34个壳粒保持在一起,不仅固定了一个五重对称壳粒聚集体,而且还连接了两个相邻的五重对称壳粒聚集体(图1D和3C)。据预测,这个至关重要的1249个氨基酸长的M1249L充满了螺旋结构(补充附图S10),并呈现出带有两个末端叶的纤维状构型(每个末端叶约150个氨基酸残基)。这种纤维状构型长大约100 nm,并具有30个扩展的螺旋(大约30个氨基酸残基/螺旋)(图1D和3C)。 M1249L从一个五重对称壳粒聚集体中的壳粒b和c(接触壳粒a)开始,沿着拉链结构的外边缘(壳粒c-e,d-f,B-A…..N-E、M-D和L-C)延伸,并以壳粒B和C结束,与来自邻近的五重对称壳粒聚集体的壳粒e相互作用(图3C)。这些通常以“背对背”模式(类型3'和3)显示出最弱的相互作用(大约150Å2)的壳粒对(b和c,B和C)如今被M1249L的两个末端叶保持在一起(图2D和3C)。此外,M1249L与p17/p72壳粒广泛相互作用,从而形成这种刚性拉链结构,在其中,壳粒以“头对头”模式(类型2)紧密接触,以产生17个成对的壳粒(d:B, e:C, f:D, A:E, K:F, T:G, B’:H, I’:I, J:J)和30个拉链结构构成衣壳框架。出乎意料的是,拉链结构中的p17与三重对称壳粒聚集体中的p17呈现出截然不同的构象(图3,B和C)。由两组p17对(红色和蓝色)在拟等价两重轴上形成的双套索结构,p17s(红色和绿色)和M1249L在边缘的紧密缠结在很大程度上促进了壳粒沿着M1249L的纤维状构型结合,从而确保了拉链结构的正确组装(图3C)。
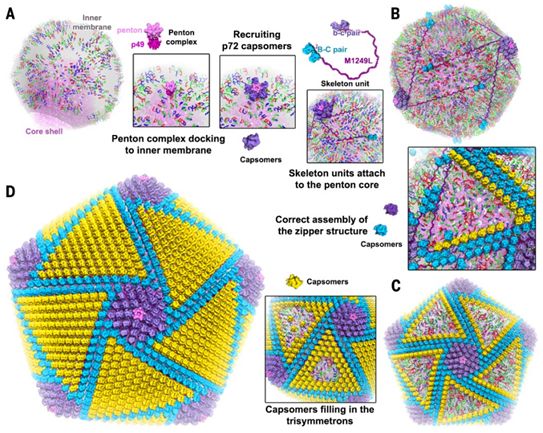
ASFV组装始于病毒内膜前体的出现,该内膜前体可能来自内质网,然后通过衣壳层的逐步组装而形成二十面体中间体和二十面体颗粒。在病毒组装的早期阶段,内膜是柔性的,具有多种形态,甚至是开放的结构,在它们的表面上漂浮着各种可移动的内膜蛋白,比如p17。衣壳似乎是在内膜蛋白和次要衣壳蛋白的指导下组装的,但是在感染的细胞中未观察到预组装的壳粒聚集体(symmetron)。结合以前的实验观察和这项研究中的结构分析,这些结果让这些研究人员能够提出详细的假设,以进一步理解ASFV衣壳组装。首先,p49与膜结合的能力介导了五邻体复合物停靠在内膜上,在那里,它招募壳粒(a)形成五邻体核心(图4),从而启动组装。这与巨型病毒mivirvirus衣壳的体内组装相一致,后者从五重顶点开始,逐步完成衣壳组装。其次,具有两个壳粒对(b-c和B-C)的骨架单元M1249L附着在五邻体核心上,与此同时,这些骨架单元、五邻体核心和p17可以在内膜上移动,从而增加了它们形成更高阶组装的机会(图4)。在p17的引导下,壳粒、骨架蛋白M1249L和p17有助于拉链结构的形成,这些拉链结构连接相邻的五邻体核心并逐渐构建多面体框架(图4)。伴随多面体框架的形成,壳粒填充重对称壳粒聚集体以完成衣壳组装(图4)。在这种模型中,骨架蛋白M1249L充当构建衣壳框架的骨架,并确定着衣壳的尺寸。与此相一致的是,在病毒PRD-1、PBCV-1和Bam35中也观察到了具有类似功能的纤维状蛋白,这表明了存在类似的组装途径。
本文报道的近原子分辨率的ASFV结构使这些研究人员能够迈出第一步,以了解是什么驱动衣壳组装,以及它保持稳定性的基础。此外,这些结构细节,特别是p72原子结构,可以指导基于抗原表位的免疫原的合理设计,这将影响针对ASFV感染的疫苗干预新策略的开发。(生物谷 Bioon.com)
参考资料:
Nan Wang et al. Architecture of African swine fever virus and implications for viral assembly. Science, 2019, doi:10.1126/science.aaz1439.
ASFV是非洲猪瘟病毒科(Asfarviridae)的唯一成员,也是唯一已知的DNA虫媒病毒(一种用于描述由节肢动物传播的任何病毒的术语)。尽管与其他的核质大DNA病毒(NCLDV)具有相同的结构、基因组特性和复制特性,但ASFV的不同之处在于它具有多层结构和整体二十面体形态。细胞内ASFV包含50多种蛋白,具有一个包含基因组的类核(第一层),这个类核(nucleoid)被一个厚的称为核壳(core shell)的蛋白层(第二层)包围,这个蛋白层被一个内脂质膜(第三层)和二十面体蛋白衣壳(第四层)依次包裹着。当这种病毒穿过质膜出芽变成细胞外ASFV时,它获得了外囊膜(第五层)。关于这种感染性病毒颗粒(virion)的组成和结构以及负责诱导猪中保护性免疫反应的病毒蛋白的鉴定方面存在的知识上的巨大空白阻碍了疫苗的开发。
ASFV靶向巨噬细胞,即主要存在于血液和骨髓中的单核细胞。在一项新的研究中,来自中国科学院生物物理研究所、中国科学院大学、中国农业科学院、上海科技大学、清华大学和南开大学的研究人员从30~40天大的无特定病原体(specific pathogen-free, SPF)猪中分离出猪骨髓细胞(PBM细胞),然后在原代PBM细胞中进行ASFV(从中国一个爆发ASF流行病的农场的猪脾样本中分离出的毒株HLJ-2018)增殖,从细胞上清液中纯化出细胞外ASFV病毒颗粒,然后用甲醛灭活这些病毒颗粒。他们利用低温电镜(cryo-EM)研究了这些纯化出的病毒颗粒。细胞外ASFV病毒颗粒的平均直径为260~300 nm,比以前的观察结果(大约200 nm)大得多,这可能是由于病毒颗粒不完整或在低温电镜观察之前对样品进行了脱水处理。相关研究结果近期发表在Science期刊上,论文标题为“Architecture of African swine fever virus and implications for viral assembly”。论文通讯作者为中国农业科学院哈尔滨兽医研究所所长步志高(Zhigao Bu),中国科学院院士饶子和(Zihe Rao)和中国科学院研究员王祥喜(Xiangxi Wang)。
像大多数NCLDV一样,ASFV病毒颗粒的大小(直径250~500 nm)和潜在的柔性将它的结构解析分辨率限制在10 Å(埃米,纳米的十分之一)以下。在这项新的研究中,这些研究人员通过对43811个ASFV病毒颗粒进行均化处理,获得了分辨率为8.8Å的二十面体ASFV重建结构图。该三维重建结构图清楚地显示了ASFV的所有五个层的结构,其中衣壳(第四层)的最大直径为250 nm,第三层是70Å厚的脂质双层膜,它包裹着直径180纳米的核壳(第二层)。这三层呈现整体二十面体形态,大致遵循衣壳确定的轮廓(图1A)。然而,由于二十面体均化处理导致的某些结构特征的丢失,最外层的外囊膜和最内层的类核呈现较弱的密度。

图1.ASFV病毒颗粒的结构。图片来自Science, 2019, doi:10.1126/science.aaz1439。
通过使用优化的“基于分块(block-based)的”重构方法,再结合梯度散焦校正(gradient defocus correction)方法,可将衣壳重建的分辨率提高到4.8Å(图1,补充附图S2和S3)。ASFV的衣壳由2760个伪六聚体壳粒(pseudo-hexamericcapsomer)和12个五聚体壳粒(pentamericcapsomer)构成,按T=277二十面体晶格排列(h=7, k=12)(图1B)。在这个晶格中,有12个五重对称壳粒聚集体(pentasymmetron, 包含30个伪六聚体壳粒和一个五聚体壳粒)和20个三重对称壳粒聚集体(trisymmetron,包含120个伪六聚体壳粒)。类似的结构也在其他的NCLDV中观察到。值得注意的是,三重对称壳粒聚集体中的壳粒都以基本相同的方向进行包装,相对于相邻的三重对称壳粒聚集体中的壳粒旋转了大约60°,从而在衣壳上形成30个拉链结构(zipper, 用分割线表示)。此外,单独重建到9Å分辨率的ASFV核壳显示出180个带有一个中央通道(直径30Å)和12个被10根天线包围的海星状五邻体(penton)的6叶螺旋桨状壳粒,结果产生T=19的二十面体晶格(图1B)。
ASFV衣壳的伪六聚体壳粒的低温电镜结构图通过对存在于三重对称壳粒聚集体中的等效拷贝进行局部均化处理而得到进一步改善,从而获得4.1Å的分辨率(图2A和补充附图S3)。衣壳蛋白的骨架和许多侧链可被明确确定,这使得这些研究人员能够构建ASFV主要衣壳蛋白p72的原子模型。每个伪六聚体壳粒由3个p72分子组成,一种五邻体蛋白(一种不是p72的蛋白)的5个拷贝构成一个五聚体壳粒。装饰衣壳内表面的许多其他未解释的密度代表次要的衣壳蛋白(图1C),它们很可能有助于衣壳组装并保持衣壳外壳的稳定性。为了确定这些次要衣壳蛋白的潜在身份,他们通过质谱分析了在PBM细胞中增殖后产生的细胞外ASFV病毒颗粒的蛋白组成,鉴定出63种病毒蛋白和25种宿主细胞蛋白,相比于近期对Vero细胞培养的ASFV毒株BA71的蛋白质组分析结果,多了13种病毒蛋白。这些次要衣壳蛋白应当在这些病毒蛋白中。将蛋白组学分析、ASFV颗粒中的蛋白丰度水平、低温电镜图相似性与预测的靶蛋白结构特征(包括蛋白序列、蛋白二级结构和蛋白拓扑结构)结合起来,导致鉴定出这种五邻体蛋白(H240R)和三种次要衣壳蛋白(p17,p49和M1249L)(图1C)。衣壳外壳(outer capsid shell)的每个二十面体不对称单元包含46个伪六聚体壳粒,其中的6个伪六聚体壳粒位于五重对称壳粒聚集体(a、b、c、d、e和f)中,剩下的40个位于三重对称壳粒聚集体(A,B,C,D, E,F,G,H,I,J,K,L,M,N,O,P,Q,R,S,T,U,V,W,X,Y,Z,A',B', C'D',E',F',G',H',I',J',K',L',M'和N')中。这种五邻体蛋白和这三种次要衣壳蛋白(p17,p49和M1249L)在衣壳外壳正下方形成一个复杂的网络,从而让整个衣壳保持稳定(图1,C和D)。
鉴于细胞内ASFV和细胞外ASFV都具有传染性这一事实,组合使用通过靶向外膜蛋白和衣壳蛋白来阻断这两种类型感染的抗体才能有效抵抗ASFV。p72是关键的保护性抗原之一,针对它的单克隆抗体已显示出能中和强毒性的ASFV分离株。p72在病毒衣壳上形成同源三聚体,每个单体采用双果冻卷(double jelly-roll)结构,从而构成伪六聚体壳粒(也称为p72壳粒)。在许多其他病毒衣壳蛋白(图2B,补充附图S4和S5)中也发现了类似的双果冻卷褶皱结构,包括腺病毒,噬菌体PRD1和牛痘病毒。由八个反平行β链(从B到I)组成的单果冻卷结构(single jelly-roll)存在于更多的病毒衣壳蛋白中,这是起源自共同祖先的标志。与其他的双果冻卷衣壳蛋白一样,D1E1、D2E2、F1G1和H1I1环中的四个插入片段形成暴露区域(ER)。这些ER与N端基底结构域共同决定了不同病毒类型之间的特异性差异。在空间结构上,p72壳粒的冠状结构由ER1及其邻近的ER2形成,并朝向衣壳的外侧,这可能有助于一个构象表位的形成。同一亚基中来自ER3和ER4的β链构成了一个形成p72壳粒头部的四链β折叠(four-stranded β-sheet),这可能代表了另一个构象表位。被ER1、ER2和ER4包围的ER3可能连接这两个构象表位。这四个ER很可能确定了这些中和性表位,可用于指导ASF疫苗设计(图2,B和C)。

图2.p72的结构和组装。图片来自Science, 2019, doi:10.1126/science.aaz1439。
p72壳粒除了包围五邻体来填充五重对称壳粒聚集体外,还堆积在一起形成三重对称壳粒聚集体和拉链结构(图1,C和D)。 p72壳粒采用不同的排列方式以允许三种不同的组装模式:“头对背”,“头对头”和“背对背”(图2D)。在三重对称壳粒聚集体内,所有p72壳粒头对背排列以构建两种类型的p72壳粒三聚体(图2D中标记为1和1',其中类型1在拟等价三重轴(quasi-equivalent threefold axis)上的相互作用较小,而类型1'在在拟等价三重轴上具有较紧密的关联性)(图2D)。在拉链结构和五重对称壳粒聚集体中,p72壳粒具有所有三种接触模式,其中“头对头”关联以两种形式存在(图2D中标记为2和2'),而“背对背”相互作用发生在三种不同的微环境中(在图2D中标记为3、3'和3'')。拉链结构中的“头对头”相互作用紧密贴近由两个相邻的ER1形成的一个四链β-折叠,而五重对称壳粒聚集体中的相应相互作用由于p7壳粒的相对旋转而显著降低,这种相对旋转是五重对称壳粒聚集体中较高的曲率导致的(图2D)。相比之下,与在3’’微环境中形成四螺旋束的五重对称壳粒聚集体中的“背靠背”接触相比,拉链结构中的背对背接触是最弱的(图2D)。总的来说,拉链结构中的“背对背”接触和五重对称壳粒聚集体中的所有三种接触方式似乎不足以促进高阶结构的组装,这表明次要衣壳蛋白是构建触发整个衣壳组装的网络所需要的。
与壳粒之间较少的接触相关的是,五邻体和三种次要衣壳蛋白增强了五重对称壳粒聚集体中的相互作用(图3)。在衣壳外壳五重顶点处的五邻体呈现出一个单果冻卷结构和一个球状帽结构(图3A),这表明这种五邻体蛋白不同于p72,但与p72存在同源关系,这与某些已知的大型dsDNA病毒(比如,PBCV-1病毒、噬菌体Mavirus和噬菌体PRD1等)中的结构观察结果相一致。噬菌体Mavirus五邻体蛋白结构在这些研究人员重建的图谱中进行灵活拟合是非常简单的,这种因为它的果冻卷褶皱结构排列得很整齐(图3A)。利用噬菌体Mavirus五邻体蛋白在所有ASFV开放阅读框(ORF)中进行Protein BLAST搜索,鉴定出一个与它的序列相似性为37.7%的同源蛋白,即H240R,这是一种未被注释的但却是必不可少的病毒颗粒蛋白(图S7)。H240R具有240个氨基酸残基,富含β链,据预测具有单果冻卷褶皱结构和一个长大约70个氨基酸的N端延伸片段(补充附图S8),这进一步支持了这种五邻体在ASFV中的身份。在五邻体的下面,观察到弱的灯笼状密度(大约9Å)将五邻体和内膜连接起来,并将五个相邻的壳粒结合在一起,据猜测这在顶点的组装中起作用(图3,A和C)。先前的研究报道,这种假定的衣壳蛋白p49(B438L)是形成衣壳顶点所必需的,并且紧邻衣壳顶点。此外,作为一种膜内在蛋白,p49不参与病毒颗粒从组装位点到质膜的运输,这表明它可能位于衣壳内壳(inner shell of capsid)上。根据这些观察结果,这些研究人员提出这些灯笼状密度是p49的5个拷贝(图3,A和C)。

图3.来自次要衣壳蛋白的广泛分子间网络是衣壳稳定性的基础。图片来自Science, 2019, doi:10.1126/science.aaz1439。
内膜蛋白p17(D117L)是必需的且高度丰富的蛋白,是衣壳组装和二十面体形态发生所必需的。这些研究人员的重构图显示了在p72壳粒下重复出现的密度。由三个连续的α-螺旋组成的蛇形结构与p17胞外结构域的二级结构预测非常吻合(图3B,补充附图S9),并支持蛋白丰度分析结果,这表明这些重复出现的密度为p17。 p17与p72的基底结构域紧密结合,p17的三个拷贝环绕衣壳内壳中的每个p72壳粒,从而将p72 壳粒牢固地锚定在内膜上(图3B)。有趣的是,在1型微环境下,来自三个相邻的p72壳粒的三个p17s紧密交错,介导了三个壳粒之间的相互作用(图2D和3B)。这些相互作用以及在1’型微环境下三个衣壳中的相互作用共同指导了构建成大部分衣壳的三重对称壳粒聚集体中p72壳粒的有序堆积。
然而,五重对称壳粒聚集体和拉链结构内的微环境更为复杂。在这里,骨架蛋白M1249L将34个壳粒保持在一起,不仅固定了一个五重对称壳粒聚集体,而且还连接了两个相邻的五重对称壳粒聚集体(图1D和3C)。据预测,这个至关重要的1249个氨基酸长的M1249L充满了螺旋结构(补充附图S10),并呈现出带有两个末端叶的纤维状构型(每个末端叶约150个氨基酸残基)。这种纤维状构型长大约100 nm,并具有30个扩展的螺旋(大约30个氨基酸残基/螺旋)(图1D和3C)。 M1249L从一个五重对称壳粒聚集体中的壳粒b和c(接触壳粒a)开始,沿着拉链结构的外边缘(壳粒c-e,d-f,B-A…..N-E、M-D和L-C)延伸,并以壳粒B和C结束,与来自邻近的五重对称壳粒聚集体的壳粒e相互作用(图3C)。这些通常以“背对背”模式(类型3'和3)显示出最弱的相互作用(大约150Å2)的壳粒对(b和c,B和C)如今被M1249L的两个末端叶保持在一起(图2D和3C)。此外,M1249L与p17/p72壳粒广泛相互作用,从而形成这种刚性拉链结构,在其中,壳粒以“头对头”模式(类型2)紧密接触,以产生17个成对的壳粒(d:B, e:C, f:D, A:E, K:F, T:G, B’:H, I’:I, J:J)和30个拉链结构构成衣壳框架。出乎意料的是,拉链结构中的p17与三重对称壳粒聚集体中的p17呈现出截然不同的构象(图3,B和C)。由两组p17对(红色和蓝色)在拟等价两重轴上形成的双套索结构,p17s(红色和绿色)和M1249L在边缘的紧密缠结在很大程度上促进了壳粒沿着M1249L的纤维状构型结合,从而确保了拉链结构的正确组装(图3C)。
ASFV组装始于病毒内膜前体的出现,该内膜前体可能来自内质网,然后通过衣壳层的逐步组装而形成二十面体中间体和二十面体颗粒。在病毒组装的早期阶段,内膜是柔性的,具有多种形态,甚至是开放的结构,在它们的表面上漂浮着各种可移动的内膜蛋白,比如p17。衣壳似乎是在内膜蛋白和次要衣壳蛋白的指导下组装的,但是在感染的细胞中未观察到预组装的壳粒聚集体(symmetron)。结合以前的实验观察和这项研究中的结构分析,这些结果让这些研究人员能够提出详细的假设,以进一步理解ASFV衣壳组装。首先,p49与膜结合的能力介导了五邻体复合物停靠在内膜上,在那里,它招募壳粒(a)形成五邻体核心(图4),从而启动组装。这与巨型病毒mivirvirus衣壳的体内组装相一致,后者从五重顶点开始,逐步完成衣壳组装。其次,具有两个壳粒对(b-c和B-C)的骨架单元M1249L附着在五邻体核心上,与此同时,这些骨架单元、五邻体核心和p17可以在内膜上移动,从而增加了它们形成更高阶组装的机会(图4)。在p17的引导下,壳粒、骨架蛋白M1249L和p17有助于拉链结构的形成,这些拉链结构连接相邻的五邻体核心并逐渐构建多面体框架(图4)。伴随多面体框架的形成,壳粒填充重对称壳粒聚集体以完成衣壳组装(图4)。在这种模型中,骨架蛋白M1249L充当构建衣壳框架的骨架,并确定着衣壳的尺寸。与此相一致的是,在病毒PRD-1、PBCV-1和Bam35中也观察到了具有类似功能的纤维状蛋白,这表明了存在类似的组装途径。

图4.本文提出的ASFV衣壳组装过程。图片来自Science, 2019, doi:10.1126/science.aaz1439。
本文报道的近原子分辨率的ASFV结构使这些研究人员能够迈出第一步,以了解是什么驱动衣壳组装,以及它保持稳定性的基础。此外,这些结构细节,特别是p72原子结构,可以指导基于抗原表位的免疫原的合理设计,这将影响针对ASFV感染的疫苗干预新策略的开发。(生物谷 Bioon.com)
参考资料:
Nan Wang et al. Architecture of African swine fever virus and implications for viral assembly. Science, 2019, doi:10.1126/science.aaz1439.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


