基因组稳定性顶端激酶调控长链脂肪酸合成
来源:牛津大学出版社 2019-11-02 10:11
基因组稳定性的维持是一切生命活动的基础,然而,多种外源和内源因素作用下产生的广泛DNA损伤和复制压力构成了基因组不稳定的主要来源。真核生物的生存严格依赖ATR(ataxia telangiectasia–mutated and Rad3-related)激酶的活性,ATR激酶负责启动细胞对基因组不稳定的响应和修复,全局性地调控基因组的稳定,也是细胞内重要的肿瘤抑制因子。脂肪酸合成酶(f
基因组稳定性的维持是一切生命活动的基础,然而,多种外源和内源因素作用下产生的广泛DNA损伤和复制压力构成了基因组不稳定的主要来源。真核生物的生存严格依赖ATR(ataxia telangiectasia–mutated and Rad3-related)激酶的活性,ATR激酶负责启动细胞对基因组不稳定的响应和修复,全局性地调控基因组的稳定,也是细胞内重要的肿瘤抑制因子。
脂肪酸合成酶(fatty acid synthase, FAS)负责催化乙酰CoA和丙二酸单酰CoA合成长链脂肪酸。脂肪酸合成过程中,底物和中间产物分子在FAS各个功能结构域中传递直到完成脂肪酸的整个合成过程。有研究表明,编码FAS的基因可能发挥着癌基因的功能,其表达水平在部分肿瘤细胞中发生上调,利用FAS抑制剂抑制脂肪酸的合成,肿瘤细胞的增殖和扩散也能够明显地受到抑制(Khan et al., 2014; Liu et al., 2010)。
中国科学技术大学蔡刚教授课题组和王雪娟教授课题组在内源性纯化裂殖酵母ATR-ATRIP(Rad3-Rad26)复合体的过程中,很意外地发现Rad3-Rad26可以与FAS一起从体内稳定地共纯化,这个结果暗示着ATR激酶在体内可能通过直接结合FAS调控脂肪酸代谢。阐明ATR与FAS之间的功能性相互作用及其生物学意义,不仅能显着提升对DNA损伤应答通路和脂肪酸合成通路之间联系的认识,也有望为肿瘤治疗提供新的方向。
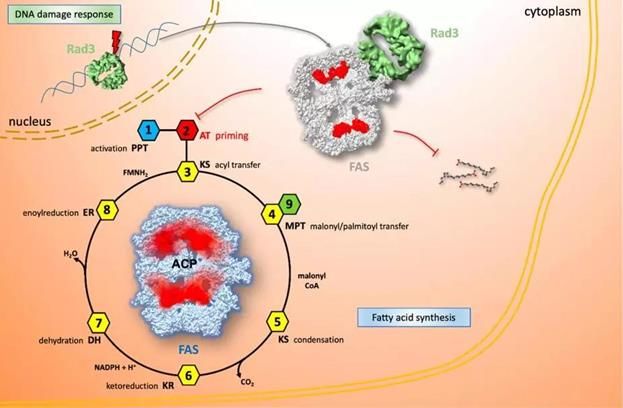
针对上述科学问题,蔡刚教授和王雪娟教授两个课题组合作在Journal of Molecular Cell Biology(JMCB)发表了题为“Modulation of Fatty Acid Synthase by ATR checkpoint kinase Rad3”的研究成果,揭示裂殖酵母ATR-ATRIP复合体(Rad3-Rad26)稳定地与FAS结合,通过调控FAS的结构柔性,将脂肪酸合成停滞在启动阶段(见上图中步骤2)。
在发现Rad3-Rad26在体内结合FAS的基础上,进一步的工作揭示Rad3-Rad26与FAS的相互作用在体内、外分别受到DNA损伤和饱和脂肪酸的调控。当细胞受到DNA损伤时,Rad3-Rad26与FAS的体内相互作用明显增强;在体外,Rad3-Rad26与FAS的直接结合能力较弱,加入饱和脂肪酸能显着促进其二者的相互作用。随后利用冷冻电镜技术,作者分别解析了单独状态以及Rad3-Rad26共纯化状态下FAS的三维结构。单独的FAS具有高度的结构柔性,底物运输核心ACP(acyl carrier protein)结构域处于连续的构象变化,在各个催化结构域间来回穿梭,具备高速合成脂肪酸的能力;而共纯化FAS的ACP结构域则被铆钉在AT (acetyl transferase)和SD1(structural domain 1)结构域之间,脂肪酸合成被停滞在起始阶段,FAS的合成活性也显着降低。
癌细胞在转移过程中,细胞内营养物质及能量的流通速率往往高于正常细胞。如糖代谢异常活跃、脂肪酸过度累积;而这些代谢的变化能满足癌细胞的粘附、转移和生存的需要。本研究首次发现了ATR激酶与FAS具有直接的相互作用并且能够抑制脂肪酸合成,揭示了ATR激酶除了调控基因组稳定性外,其肿瘤抑制因子的作用还可能通过直接抑制脂肪酸合成来发挥。此外,本文还发现了DNA损伤响应与脂肪酸合成代谢之间存在直接的联系,提供了认识ATR激酶和FAS这两种重要抗癌靶点的全新视角。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


