肿瘤免疫疗法的研究进展一览
来源:本站原创 2019-10-28 01:29
2019年10月28日 讯 /生物谷BIOON/ --本期为大家带来的是肿瘤免疫疗法领域的最新研究进展,希望读者朋友们能够喜欢。 1. JCI:为何癌症靶向免疫药物有时会失效?DOI: 10.1172/JCI128644近日,来自俄亥俄州立大学综合癌症中心的研究人员做出了一项突破性研究成果,该发现有助于科学家理解为什么某些肿瘤微环境中缺乏免疫细胞浸润,并且其对PD-1靶向疗法不够敏感。&
2019年10月28日 讯 /生物谷BIOON/ --本期为大家带来的是肿瘤免疫疗法领域的最新研究进展,希望读者朋友们能够喜欢。
DOI: 10.1172/JCI128644
近日,来自俄亥俄州立大学综合癌症中心的研究人员做出了一项突破性研究成果,该发现有助于科学家理解为什么某些肿瘤微环境中缺乏免疫细胞浸润,并且其对PD-1靶向疗法不够敏感。
T细胞是一种免疫细胞,可帮助人体识别异常细胞和体内疾病。而PD-1是T细胞上的一种检查点蛋白,通常充当“关闭开关”,有助于防止T细胞攻击机体其它正常细胞。 PD-1抑制剂是单克隆抗体药物的一部分,在临床中用于抑制PD-1蛋白质活性并增强T细胞对癌细胞的免疫应答。
先前报道的数据表明,某些癌症患者对PD-1治疗无反应的主要原因是细胞毒性T细胞(CD8 T细胞)无法侵入肿瘤微环境,这种类型的肿瘤组织也被称为“冷肿瘤(Cold Tumor) 。”
在这项新研究中, Yang Yiping博士及其同事报告了显示CD8 T细胞浸润肿瘤微环境的能力受到限制的细胞机制。他们显示Hedgedog信号会关闭肿瘤相关巨噬细胞的趋化因子分泌,而后者对CD8 T细胞浸润至关重要。通过阻断(抑制)Hedgedog通路,研究人员能够逆转这一过程并促进CD8 T细胞向肿瘤微环境的浸润。
“我们的数据表明,在肝癌和肺癌的临床前模型中,与PD-1阻断剂联合使用的Hedgedog抑制剂在杀死癌细胞方面比单独使用一种药物更有效,”研究者之一James说道。 “这是一个重要发现,该发现有可能显著提高PD-1治疗的疗效并指导新癌症免疫治疗策略的开发。”
相关结果发表在最近一期的《Journal of Clinical Investigation.》杂志上。
该研究是在肝癌和肺癌的临床前模型中进行的。 Yang和他的同事James的目标是将这一重要发现从实验室阶段向临床转化,以使癌症患者受益。研究人员计划使用PD-1和Hedgedog抑制剂的联合策略进行I期临床试验,用于治疗肺癌和肝癌患者。
2. Nature:新研究揭示肿瘤免疫疗法效果提升的关键
DOI: 10.1038/s41586-019-1671-8

癌症免疫疗法药物通过出发人体的免疫系统攻击肿瘤,彻底改变了某些癌症的治疗方法,其中包括淋巴瘤,肺癌和黑色素瘤。然而,尽管有些患者对药物反应良好,但其他患者则完全没有反应。对此,肿瘤免疫学家希望改变目前这种状况。
圣路易斯华盛顿大学医学院研究人员的一项新研究表明,癌症免疫疗法或许具有更强的应答效果。这些新发现可能会有助于开发更好的癌症疫苗和更有效的免疫疗法药物。
该研究于10月23日发表在《Nature》杂志上。
资深作者Robert D. Schreiber博士说:“免疫疗法为癌症治疗带来了巨大希望,但我们尚未找到使它变得更加广泛有效的方法。对于许多患者,特别是对于乳腺癌或前列腺癌等常见癌症患者来说,它仍然不起作用。因此我们想了解为什么它们在这些情况下无效,以及是否可以开发出更好的疗法。我们的研究表明,在结合检查点抑制剂疗法与肿瘤疫苗时,免疫疗法可能会更加有效。”
许多针对癌症的免疫疗法旨在促使被称为“杀伤性T细胞”的CD8 T细胞攻击癌细胞。但是这项新研究表明,通过招募CD4 T细胞可以提高免疫疗法的有效性。此类辅助T细胞参与将癌症识别为威胁并招募杀伤性T细胞发起攻击。没有辅助细胞的情况下,免疫系统通常无法完全抵抗癌症。
Schreiber说:“这项研究首次揭示了辅助性T细胞在癌症免疫疗法中必不可少。仅激活杀伤性T细胞是不够的。为了使所有患者产生更好的应答,我们认为应当合理使用癌症疫苗和免疫疗法药物,以达到同时激活杀伤性T细胞和辅助性T细胞的目的。”
当前的癌症疫苗和免疫检查点疗法能够很好地激活杀伤性T细胞,而很多研究揭示了MHC-I分子在其中的调节作用。这项新研究则深入分析了另一组激活辅助性T细胞的基因-MHC II。这项研究提供了优化的免疫疗法,通过使辅助性T细胞和杀伤性T细胞共同发挥作用,达到消除癌症并保留健康的组织的目的。
Schreiber的合作者,病理学和免疫学副教授Maxim N. Artyomov博士,开发了一种计算机程序,该程序可以预测患者肿瘤上的哪些突变蛋白或抗原会特异性激活辅助T细胞。这类预测软件已被广泛用于分析激活杀伤性T细胞的抗原表位,但还没有对CD4 T细胞进行系统的分析。
第一作者,Elise Alspach表示:“对于杀伤性T细胞来讲,我们通过观察患者的肿瘤,了解存在哪些突变,并弄清哪些突变最有可能触发杀伤性T细胞应答。但是对辅助性T细胞来说,目前的技术还远不能做到这一点。”
Schreiber补充说:“这有点像在大海捞针。不过,我们相信我们开发出的技术是在癌症免疫疗法中利用辅助性T细胞的重要一步。”
Schreiber,Alspach及其同事对具有人类癌症模型的小鼠进行了研究,结果表明,将辅助T细胞与杀伤性T细胞一起激活时,免疫检查点疗法更为有效。他们进一步表明,当同时存在激活辅助和杀伤性T细胞的靶标时,疫苗也更有效。
Alspach说:“仅仅因为存在杀伤性T细胞并不意味着它就在积极地发挥杀死肿瘤细胞的作用。我们发现,辅助性T细胞不仅可以用于招募杀伤性T细胞,而且辅助性细胞的存在是促进杀伤性T细胞成熟并活化的关键。”
Schreiber说:“给予检查点抑制剂以及肿瘤特异性疫苗(特别是激活杀伤和辅助T细胞的疫苗)的想法才刚刚出现。但是根据我们的研究,这种组合可能比单独使用任何一种成分更有效。如今,当我们使用检查点抑制剂治疗特定类型的肿瘤时,也许有20%的患者反应良好。我们希望 疫苗加上检查点抑制剂后,反应良好的患者人数将上升60%或70%。我们尚未在患者中尝试过,但存在很大的希望。”
3. Sci Immunol:惰性受体或会抑制癌症免疫疗法的治疗有效性
DOI: 10.1126/sciimmunol.aau8943.

免疫疗法的目的是让宿主机体免疫系统再次独立对抗癌症,目前诸如检查点抑制剂等药物已经在临床中大量使用,然而其仅对大约三分之一的患者有效;近日,一项刊登在国际杂志Science Immunology上的研究报告中,来自慕尼黑工业大学等机构的科学家们通过对人类组织样本进行分析后揭示了为何检查点抑制剂等药物仅对部分癌症患者有效,即癌细胞中的一种不活跃受体会抑制药物重新激活宿主的免疫系统。
过度活跃的免疫系统几乎和不活跃的免疫系统一样危险,其会引发炎症从而攻击自身组织;为了有效解决这一问题,免疫系统就演变出了一种能进行自我检查的分子,当其开启表达时就好像免疫系统制动器一样,然而癌细胞会利用这一机制,通过开启检查点分子的表达,成功躲避宿主免疫系统的攻击,由此所产生的免疫功能减弱就不足以能有效抵御癌细胞了。
因此,如今研究人员开发出了一种基于检查点抑制剂的新型癌症疗法,这些抑制剂能释放对癌细胞功能的“制动”作用,从而恢复免疫系统抵御癌症的能力,研究人员已经能成功利用检查点抑制剂来有效治疗皮肤癌和其它多种恶性肿瘤了。
RIG-I受体是关键因素
研究者Simon Heidegger教授表示,很不幸的是,检查点抑制剂并不能有效治疗所有癌症患者,基于本文研究,我们揭示了其中的原因;RIG-I是一种特殊的受体蛋白,其在机体抵御病毒感染上扮演着非常关键的角色,这项研究中,研究人员发现,RIG-I在癌症控制上也具有重要的作用,通过对多种皮肤癌、胰腺癌和肠癌小鼠模型进行研究后研究者发现,携带RIG-I被激活的癌细胞的小鼠对检查点抑制剂的反应往往要比RIG-I失活的小鼠要好;很幸运的是,目前研究者开发出了能激活RIG-I的药物,而且其目前已经进入到了人类临床前试验中,研究者能在小鼠模型中成功使用这种药物,而且接受该药物治疗的小鼠的反应要比检查点抑制剂治疗反应更好。
利用人类皮肤癌样本证实了研究发现
随后研究人员对来自皮肤癌患者机体中大约450份组织样本进行研究分析后,确定了患者癌细胞中RIG-I的活性对其生存率的影响,当RIG-I激活的情况下,患者尽管患有癌症,其存活率仍然会明显延长,在20名受试个体中,患者对检查点抑制剂疗法的反应均表现较好;下一步研究人员还将对患者进行更大规模的临床试验来证实本文研究结果。
最后研究者Heidegger表示,我们希望能利用RIG-I作为一种特殊标志物来预测患者对癌症疗法的反应,这或许就能有效避免患者接受不必要的治疗;此外,我们还计划在其它小鼠模型中检测激活RIG-I信号通路的药物是否能有效发挥作用,并调查额外使用检查点抑制剂的治疗效应。
DOI:10.1084/jem.20190801

日前,一项刊登在国际杂志The Journal of Experimental Medicine上的研究报告中,来自耶鲁大学的科学家们通过研究开发出了一种新型疗法,其能刺激免疫细胞有效杀灭小鼠机体中的肿瘤,这种疗法能够单独使用,也能通当前抗癌疗法相结合来使用,且能产生持续性的治疗效应。
文章中,研究者分析了是否所开发的抵御病毒的合成性RNA分子能诱发机体抵御肿瘤的免疫反应,这种名为SLR14(Stem Loop RNA 14)的特殊分子能够有效激活关键基因的表达,从而检测细胞中的病毒和其它威胁。研究者Akiko Iwasaki说道,我们的想法是在肿瘤内部模拟病毒感染过程来诱发宿主免疫系统认定这是一起感染事件并有效清除感染(从而杀灭癌细胞)。
为了检测这一理论,研究人员尝试了几种不同的方法,他们将SLR14直接注射到小鼠的肿瘤组织中,随后他们观察到了免疫系统T细胞对癌症的摧毁过程,当将该疗法应用到肿瘤的一个位点时,其就能刺激T细胞在不同位点产生反应,这就揭示了一种广泛的治疗效应。在另一项实验中,研究者模拟了癌症的转移过程,他们将肿瘤细胞通过左心室注射到心脏中进而扩散到全身,随后的结果表明,实体瘤中SLR疗法能够有效阻断转移性癌症的生长。
进一步研究后研究者发现,SLR14能与当前的癌症免疫疗法药物相媲美,其能有效增强机体的抗肿瘤反应,作为单一疗法因子其也能够产生明显的效应;当与当前免疫疗法相结合时其还能够产生一种协同效应。研究者表示,该疗法所诱导的免疫系统“记忆”或能保护动物机体免于癌症的复发,由于免疫系统存在长效记忆,因此我们就需要利用免疫系统来寻找即将发生癌变的肿瘤组织并对其有效清理,当注射SLR后就能够促进机体产生长效免疫力。后期研究人员还希望进行更为深入的研究,在人类临床试验中来检测这种新型疗法单独使用及联合其它疗法的作用效果。
DOI:10.1038/s41590-019-0500-4
癌细胞往往是躲避宿主机体检测的“大师”;近日,一项刊登在国际杂志Nature Immunology上的研究报告中,来自耶鲁大学的科学家们通过研究开发了一种新系统,其能够帮助寻找隐藏的癌细胞,促进机体免疫系统定位并清除免疫疗法后遗漏的癌细胞。
这种新系统能减少或消除小鼠机体中的黑色素瘤、三阴性乳腺癌肿瘤和胰腺肿瘤,甚至还包括一些距离原发性肿瘤位点较远的肿瘤组织。研究者Sidi Chen教授表示,这是一种全新的免疫疗法;免疫疗法给癌症治疗带来了革命性的进展,但当前很多疗法并不能针对所有患者发挥作用,同时也只能治疗部分癌症类型;现有的治疗手段有时并不能识别癌细胞的所有分子伪装,这就使得疗法治疗效果会变差。
为了解决这些问题,这项研究中,研究人员开发了一种新系统,其能将病毒基因疗法和CRISPR基因编辑技术相结合,代替了寻找并编辑DNA并插入新基因,这种名为MAEGI(内源性基因的多重激活作为免疫疗法,Multiplexed Activation of Endogenous Genes as Immunotherapy)的新系统能对成千上万个癌症相关基因进行大规模搜索,同时像GPS一样定位并放大信号。
MAEGI能对肿瘤细胞进行标记并进行免疫摧毁,其能将冷肿瘤(缺乏免疫细胞)转化为热肿瘤(携带免疫细胞),研究者Chen表示,这相当于给肿瘤细胞穿上了橙色的防弹衣,促进机体免疫系统警察迅速找到并消灭这些癌细胞。一旦癌细胞被识别,宿主机体免疫系统就能快速对其进行摧毁消灭。
最后研究者表示,本文中所开发的新系统能够有效抵御多种癌症类型,包括对免疫疗法耐受的癌症等;后期研究人员还会继续深入研究来优化该系统从而能够更为简单对生产并为进行癌症患者的临床试验做好准备。
DOI: 10.1016/j.celrep.2019.08.095
近日,一项刊登在国际杂志Cell Reports上的研究报告中,来自罗彻斯特大学医学中心的科学家们通过研究发现,将放疗与化疗相结合不仅能够治愈小鼠的胰腺癌,还能重编程其机体免疫系统产生一种特殊的“免疫记忆”,就好像接种疫苗能够抵御流感一样。
研究者表示,这种新型组合疗法还能破坏扩散到肝脏(癌症转移的常见位点)中的胰腺癌细胞;胰腺癌是一种恶性、生存率较差的癌症类型,在超过80%的患者中,当其被诊断为胰腺癌时疾病常常已经处于晚期戒断,外科手术并不是最好的选择,而且化疗除了稳定患者的病情通常并没有什么效果。
众所周知,胰腺癌很难治疗,因为胰腺肿瘤被有毒的蛋白质和其它组织所包围,其能保护胰腺癌细胞免受宿主机体免疫系统的攻击;这项研究中,研究人员开发出了一种“一箭双雕”的创新性组合疗法,其不仅能激活宿主机体T细胞来攻击癌细胞外,还能降免疫抑制细胞转化为战斗细胞。
研究者在实验室模型中使用的组合性疗法包括立体定向放射治疗(stereotactic body radiotherapy,SBRT)和白介素-12(IL-12),SBRT能在短时间内提供高剂量的辐射,同时还能刺激机体免疫系统杀死癌细胞;IL-12则具有抗癌活性,其能激活宿主机体的免疫系统功能。然而,IL-12通常会带来严重的副作用,为了解决这一问题,目前研究人员正在胰腺癌小鼠模型中设计并检测一种定时释放的技术,这种技术能在两周内缓慢释放药物作用至患处;后期研究人员还将深入研究阐明这种新型组合性疗法的效果和副作用。
DOI: 10.1016/S1470-2045(19)30514-5

Pegilodecakin是目前正在进行临床试验的一类药物,已显示出积极的安全性结果,可能为非小细胞肺癌(NSCLC)和肾癌患者提供一个潜在的新治疗途径。一项由德克萨斯大学MD安德森癌症中心领导的研究表明,该药物与两种主要的抗PD-1单克隆抗体pembrolizumab和nivolumab联合使用,对这些患者产生了可测量的反应。这项多中心Ib期研究的结果于近日发表在《柳叶刀肿瘤学》(Lancet Oncology)上。
"抗PD-1单克隆抗体与Pegilodecakin联合具有可控的毒性和有希望的抗肿瘤活性。"副教授Aung Naing博士说道。"我们的研究表明,与单纯使用抗PD-1单克隆抗体治疗的患者相比,这种组合在先前接受过治疗的NSCLC和肾癌患者中显示出良好的反应。"
该研究旨在评估pegilodecakin联合pembrolizumab或nivolumab的安全性、耐受性和最大耐受剂量,同时研究生物标志物,以确定可能对治疗有反应的患者。
这项研究从2015年2月到2017年9月进行,追踪了111名肾癌、非小细胞肺癌和晚期恶性实体瘤黑色素瘤患者。最常见的副作用是贫血、疲劳、血小板计数低和甘油三酯水平高。
研究结果表明43%的NSCLC患者、40%的肾癌患者和10%的黑色素瘤患者出现了客观反应。患者接受了pegilodecakin联合pembrolizumab或nivolumab治疗,直至病情进展、毒性需要停药、患者撤回同意或研究结束。如果研究者确定患者将继续受益,患者在疾病进展后继续接受联合治疗或单独使用pegilodecakin。
Pegilodecakin是由重组白介素-10 (IL-10)偶联聚乙二醇(PEG)形成。IL-10是一种调节多种免疫细胞活性的蛋白质,高浓度的IL-10可以激活针对癌细胞的免疫反应。PEG与IL-10的结合增加了其体积,防止或延迟其分解,延长其在体内循环的时间。
这种药物通过刺激CD8+ T细胞的生存、增殖和"杀伤"潜能发挥作用,CD8+ T细胞因其识别和摧毁癌细胞的能力而闻名。目前普遍认为增加肿瘤内CD8+ T细胞的数量可以改善患者的预后和生存。pegilodecakin的免疫刺激作用补充了抗PD-1单克隆抗体阻断T细胞免疫抑制作用的作用。
Naing说:"pegilodecakin结合抗PD-1单克隆抗体的活性为治疗晚期实体肿瘤引入了一类新的药物。未来的随机试验有望确定pegilodecakin作为一种单一药物以及在一系列癌症治疗中的联合用药的耐受性和临床益处。"
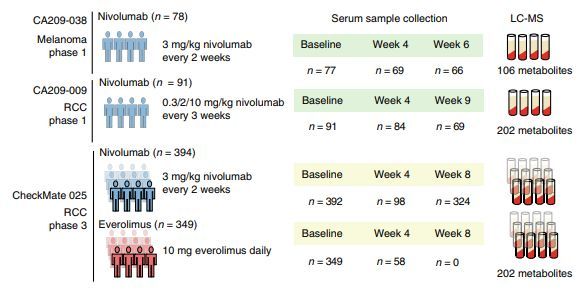
Dana-Farber癌症研究所与麻省理工学院(MIT)布罗德研究所(Broad Institute of MIT)和哈佛大学(Harvard)合作的科学家们报告称,使用检查点抑制剂药物nivolumab治疗后,一些癌症患者的代谢失衡与免疫治疗药物的耐药性和较短的生存期有关。
研究人员表示,这种化学变化反映了癌细胞或免疫系统在接受PD-1抗体药物nivolumab治疗后的"适应性抵抗机制",这种变化与晚期黑色素瘤和肾癌患者的存活率降低有关。氨基酸色氨酸转化成一种叫做犬尿氨酸的代谢物的变化越大,对生存的影响就越大。
"主要的信息是,在免疫检查点阻断后,癌症免疫治疗中的代谢适应可能是相关的,"Toni K. Choueiri医学博士说。代谢过程是机体内维持生命所必需的化学反应,如将食物转化为能量以运行细胞过程。
像nivolumab这样的检查点阻滞剂是一种药物,它可以释放对免疫反应的分子制动器,癌症通常使用这种制动器来逃避免疫T细胞的攻击。一个这样的分子制动器被称为PD-1。在一些病人和一些癌症类型中,这些药物已经被证明在释放T细胞攻击肿瘤方面非常有效,但是总的来说,这些药物只能帮助一小部分病人。Dana-Farber泌尿生殖肿瘤Lank中心主任Choueiri说:"肿瘤学中最重要的问题之一是,谁对现代PD-1抑制剂有反应,谁没有反应。"
科学家们研究了癌症组织样本,以寻找可能与检查点抑制剂或多或少的影响相关的因素:其中包括在肿瘤DNA中发现的癌症相关突变的数量,以及与对检查点阻滞剂的反应相关的其他基因"特征"。科学家们在当前研究中发现的代谢变化可以在血液中进行测量--这是基于组织的测试的一个显着优势。
"这是一个有吸引力的选择,可以用来识别与检查点阻滞剂治疗相关的代谢变化的生物标记,"Dana-Farber和哈佛医学院(Harvard Medical School)的医学助理教授Giannakis说。"我们知道新陈代谢对免疫很重要,而犬尿氨酸(一种在大多数接受nivolumab治疗的患者体内发现升高的化学物质)已知具有免疫抑制作用。"
在这项研究中,研究人员分析了三个独立的免疫治疗试验的血液样本,并测量了治疗开始前和治疗过程中几个点的代谢物(参与代谢反应的化学物质)的变化。在黑色素瘤患者中,78%的患者在治疗的第四周色氨酸到犬尿氨酸的转化增加,26.5%的患者在治疗的第四周增加超过50%。在肾癌患者中,nivolumab治疗也与犬尿氨酸的升高有关。
分析显示,黑色素瘤和肾癌患者中,nivolumab中色氨酸到犬尿氨酸的转化水平越高,存活率越低:特别是,血液测试显示犬尿氨酸和色氨酸比增加超过50%的黑色素瘤患者的平均生存期为15.7个月,而那些这一比率较低的患者的平均存活时间超过39个月,对肾癌患而言这一数据分别为16.7和31.3个月。
目前研究人员还不清除究竟PD-1检查点阻滞剂是如何使色氨酸转化为犬尿氨酸的。然而,一种被称为IDO的酶在从色氨酸合成犬尿氨酸的过程中起着重要作用,这种酶在许多癌症中都存在。Dana-Farber的研究人员指出,一项随机临床试验显示,仅使用IDO抑制剂治疗晚期黑色素瘤患者并没有产生阳性结果。然而,该研究并没有观察这些患者的犬尿氨酸水平。研究人员表示,他们的结果表明,将检查点阻碍物与IDO抑制剂联合使用可能"对检查点抑制触发的犬尿氨酸通路激活的特定组患者有益"。
doi.org/10.1038/s41416-019-0561-z
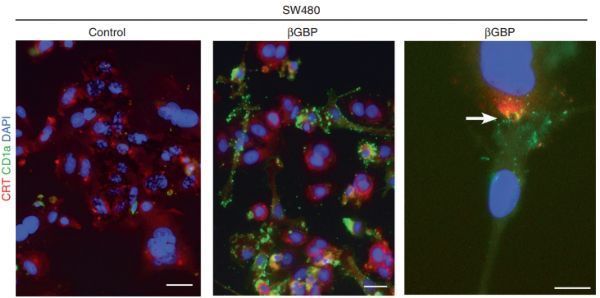
近日发表在《英国癌症杂志》(British Journal of Cancer)上的一项研究发现,一种自然产生的分子和免疫系统的一个组成部分可以成功地瞄准并杀死癌细胞,也可以鼓励免疫系统对抗癌症复发。
由来自伦敦国王学院的Livio Mallucci教授里领导的几个研究团队发现β-半乳糖苷结合蛋白质(βGBP)--一种免疫细胞产生的天然的分子--可以非特异性的靶向癌细胞癌细胞,使癌细胞死亡,这是通过一个压力反应途径使免疫系统可以识别癌细胞来实现的,这样可以诱发抗癌免疫反应,防止复发。
在过去的十年中,抗癌治疗取得了重大的进展,但由于只有一小部分患者对治疗有反应,因此需要进一步的发展。至关重要的是,有必要诱导免疫系统,以确保对癌症复发的长期保护。
目前实现这一目标的方法包括使用化疗药物和其他可能有害且结果不确定的制剂杀死细胞。
"相比之下,βGBP是选择性的抗肿瘤药物,不损害正常细胞。βGBP对最恶性、对目前疗法无反应的结直肠癌细胞和各种其他癌细胞都有效。伦敦国王学院癌症与药物科学学院的首席作者Livio Mallucci教授说:"这项研究为一种策略提供了实验证据,在这种策略中,以癌细胞为靶标并结合免疫刺激相,可以促进对侵袭性癌症的即时和长期反应。"
"βGBP的临床转化可以打开一个新的安全的治疗方法,可以结合直接杀死癌细胞和刺激免疫系统防止复发,这是癌症管理的重要一步。"
DOI: 10.1056/NEJMoa1910836
根据皇家马斯登NHS基金会的一项研究,两种免疫治疗药物的组合--ipilimumab和nivolumab--已经在五年内或更长的时间里阻止或逆转了晚期黑色素瘤的进展。
就在10年前,只有1 / 20的晚期黑素瘤患者能存活5年,而许多患者只能存活6到9个月。Checkmate 067 trial的结果于近日在西班牙巴塞罗那举行的2019年ESMO年会上公布,并同时发表在《新英格兰医学杂志》(The New England Journal of Medicine)上,这是检查点抑制剂联合治疗的最长的3期随访临床实验。
皇家马斯登NHS基金会的肿瘤顾问、英国癌症研究所(ICR)的教授James Larkin介绍了研究结果,他说:"在过去,转移性黑色素瘤被认为是不可治愈的。肿瘤学家认为黑素瘤与其他癌症不同,一旦扩散就无法治疗。这是我们第一次可以说,晚期黑色素瘤长期幸存者的几率现在超过50%,这是一个巨大的里程碑。"
该试验将945名晚期黑色素瘤患者随机分为三组:314名患者接受了nivolumab和ipilimumab的"双重打击";316名患者接受了nivolumab+安慰剂治疗;315名患者接受ipilimumab +安慰剂治疗。每个nivolumab单独与ipilimumab进行比较,直到疾病进展或任何副作用变得不可接受为止。
nivolumab联合ipilimumab的5年总生存率为52%,其中74%的患者5年后无治疗。nivolumab的总生存率为44%,ipilimumab的总生存率为26%。
Larkin教授表示:"把这两种药物放在一起,你实际上是在给免疫系统踩下两个刹车,而不是一个。这样,免疫系统就能够识别它之前没有识别出的肿瘤,并做出反应,摧毁它们。"
重要的是,对于那些因为疲劳、皮疹和腹泻等副作用而停止治疗的患者,结果与那些长期服用联合用药的患者一样好。关于免疫疗法的一个关键点是,即使治疗时间很短,免疫系统也可以被重新教育。这与其他治疗如化疗形成对比,化疗需要一个完整的疗程才能达到同样的效果。
67岁的Pamela Smith在发现自己的黑色素瘤扩散后不久,于2014年1月参加了Checkmate 067临床试验。
Pamela说:"当时无法动手术,所以这次试验是我唯一的选择。我每两周接受一次治疗,持续了大约四个月,结果我得了严重的腹泻,不得不停止治疗。令人惊讶的是,第一次扫描和此后的每次扫描都表明,在相对较短的时间内,它成功了。我的肿瘤缩小到原来的一半不到,而且五年来没有变化。从那以后我再也没有接受过任何治疗,我感觉棒极了。"(生物谷Bioon.com)
DOI: 10.1172/JCI128644

近日,来自俄亥俄州立大学综合癌症中心的研究人员做出了一项突破性研究成果,该发现有助于科学家理解为什么某些肿瘤微环境中缺乏免疫细胞浸润,并且其对PD-1靶向疗法不够敏感。
T细胞是一种免疫细胞,可帮助人体识别异常细胞和体内疾病。而PD-1是T细胞上的一种检查点蛋白,通常充当“关闭开关”,有助于防止T细胞攻击机体其它正常细胞。 PD-1抑制剂是单克隆抗体药物的一部分,在临床中用于抑制PD-1蛋白质活性并增强T细胞对癌细胞的免疫应答。
先前报道的数据表明,某些癌症患者对PD-1治疗无反应的主要原因是细胞毒性T细胞(CD8 T细胞)无法侵入肿瘤微环境,这种类型的肿瘤组织也被称为“冷肿瘤(Cold Tumor) 。”
在这项新研究中, Yang Yiping博士及其同事报告了显示CD8 T细胞浸润肿瘤微环境的能力受到限制的细胞机制。他们显示Hedgedog信号会关闭肿瘤相关巨噬细胞的趋化因子分泌,而后者对CD8 T细胞浸润至关重要。通过阻断(抑制)Hedgedog通路,研究人员能够逆转这一过程并促进CD8 T细胞向肿瘤微环境的浸润。
“我们的数据表明,在肝癌和肺癌的临床前模型中,与PD-1阻断剂联合使用的Hedgedog抑制剂在杀死癌细胞方面比单独使用一种药物更有效,”研究者之一James说道。 “这是一个重要发现,该发现有可能显著提高PD-1治疗的疗效并指导新癌症免疫治疗策略的开发。”
相关结果发表在最近一期的《Journal of Clinical Investigation.》杂志上。
该研究是在肝癌和肺癌的临床前模型中进行的。 Yang和他的同事James的目标是将这一重要发现从实验室阶段向临床转化,以使癌症患者受益。研究人员计划使用PD-1和Hedgedog抑制剂的联合策略进行I期临床试验,用于治疗肺癌和肝癌患者。
2. Nature:新研究揭示肿瘤免疫疗法效果提升的关键
DOI: 10.1038/s41586-019-1671-8

癌症免疫疗法药物通过出发人体的免疫系统攻击肿瘤,彻底改变了某些癌症的治疗方法,其中包括淋巴瘤,肺癌和黑色素瘤。然而,尽管有些患者对药物反应良好,但其他患者则完全没有反应。对此,肿瘤免疫学家希望改变目前这种状况。
圣路易斯华盛顿大学医学院研究人员的一项新研究表明,癌症免疫疗法或许具有更强的应答效果。这些新发现可能会有助于开发更好的癌症疫苗和更有效的免疫疗法药物。
该研究于10月23日发表在《Nature》杂志上。
资深作者Robert D. Schreiber博士说:“免疫疗法为癌症治疗带来了巨大希望,但我们尚未找到使它变得更加广泛有效的方法。对于许多患者,特别是对于乳腺癌或前列腺癌等常见癌症患者来说,它仍然不起作用。因此我们想了解为什么它们在这些情况下无效,以及是否可以开发出更好的疗法。我们的研究表明,在结合检查点抑制剂疗法与肿瘤疫苗时,免疫疗法可能会更加有效。”
许多针对癌症的免疫疗法旨在促使被称为“杀伤性T细胞”的CD8 T细胞攻击癌细胞。但是这项新研究表明,通过招募CD4 T细胞可以提高免疫疗法的有效性。此类辅助T细胞参与将癌症识别为威胁并招募杀伤性T细胞发起攻击。没有辅助细胞的情况下,免疫系统通常无法完全抵抗癌症。
Schreiber说:“这项研究首次揭示了辅助性T细胞在癌症免疫疗法中必不可少。仅激活杀伤性T细胞是不够的。为了使所有患者产生更好的应答,我们认为应当合理使用癌症疫苗和免疫疗法药物,以达到同时激活杀伤性T细胞和辅助性T细胞的目的。”
当前的癌症疫苗和免疫检查点疗法能够很好地激活杀伤性T细胞,而很多研究揭示了MHC-I分子在其中的调节作用。这项新研究则深入分析了另一组激活辅助性T细胞的基因-MHC II。这项研究提供了优化的免疫疗法,通过使辅助性T细胞和杀伤性T细胞共同发挥作用,达到消除癌症并保留健康的组织的目的。
Schreiber的合作者,病理学和免疫学副教授Maxim N. Artyomov博士,开发了一种计算机程序,该程序可以预测患者肿瘤上的哪些突变蛋白或抗原会特异性激活辅助T细胞。这类预测软件已被广泛用于分析激活杀伤性T细胞的抗原表位,但还没有对CD4 T细胞进行系统的分析。
第一作者,Elise Alspach表示:“对于杀伤性T细胞来讲,我们通过观察患者的肿瘤,了解存在哪些突变,并弄清哪些突变最有可能触发杀伤性T细胞应答。但是对辅助性T细胞来说,目前的技术还远不能做到这一点。”
Schreiber补充说:“这有点像在大海捞针。不过,我们相信我们开发出的技术是在癌症免疫疗法中利用辅助性T细胞的重要一步。”
Schreiber,Alspach及其同事对具有人类癌症模型的小鼠进行了研究,结果表明,将辅助T细胞与杀伤性T细胞一起激活时,免疫检查点疗法更为有效。他们进一步表明,当同时存在激活辅助和杀伤性T细胞的靶标时,疫苗也更有效。
Alspach说:“仅仅因为存在杀伤性T细胞并不意味着它就在积极地发挥杀死肿瘤细胞的作用。我们发现,辅助性T细胞不仅可以用于招募杀伤性T细胞,而且辅助性细胞的存在是促进杀伤性T细胞成熟并活化的关键。”
Schreiber说:“给予检查点抑制剂以及肿瘤特异性疫苗(特别是激活杀伤和辅助T细胞的疫苗)的想法才刚刚出现。但是根据我们的研究,这种组合可能比单独使用任何一种成分更有效。如今,当我们使用检查点抑制剂治疗特定类型的肿瘤时,也许有20%的患者反应良好。我们希望 疫苗加上检查点抑制剂后,反应良好的患者人数将上升60%或70%。我们尚未在患者中尝试过,但存在很大的希望。”
3. Sci Immunol:惰性受体或会抑制癌症免疫疗法的治疗有效性
DOI: 10.1126/sciimmunol.aau8943.

免疫疗法的目的是让宿主机体免疫系统再次独立对抗癌症,目前诸如检查点抑制剂等药物已经在临床中大量使用,然而其仅对大约三分之一的患者有效;近日,一项刊登在国际杂志Science Immunology上的研究报告中,来自慕尼黑工业大学等机构的科学家们通过对人类组织样本进行分析后揭示了为何检查点抑制剂等药物仅对部分癌症患者有效,即癌细胞中的一种不活跃受体会抑制药物重新激活宿主的免疫系统。
过度活跃的免疫系统几乎和不活跃的免疫系统一样危险,其会引发炎症从而攻击自身组织;为了有效解决这一问题,免疫系统就演变出了一种能进行自我检查的分子,当其开启表达时就好像免疫系统制动器一样,然而癌细胞会利用这一机制,通过开启检查点分子的表达,成功躲避宿主免疫系统的攻击,由此所产生的免疫功能减弱就不足以能有效抵御癌细胞了。
因此,如今研究人员开发出了一种基于检查点抑制剂的新型癌症疗法,这些抑制剂能释放对癌细胞功能的“制动”作用,从而恢复免疫系统抵御癌症的能力,研究人员已经能成功利用检查点抑制剂来有效治疗皮肤癌和其它多种恶性肿瘤了。
RIG-I受体是关键因素
研究者Simon Heidegger教授表示,很不幸的是,检查点抑制剂并不能有效治疗所有癌症患者,基于本文研究,我们揭示了其中的原因;RIG-I是一种特殊的受体蛋白,其在机体抵御病毒感染上扮演着非常关键的角色,这项研究中,研究人员发现,RIG-I在癌症控制上也具有重要的作用,通过对多种皮肤癌、胰腺癌和肠癌小鼠模型进行研究后研究者发现,携带RIG-I被激活的癌细胞的小鼠对检查点抑制剂的反应往往要比RIG-I失活的小鼠要好;很幸运的是,目前研究者开发出了能激活RIG-I的药物,而且其目前已经进入到了人类临床前试验中,研究者能在小鼠模型中成功使用这种药物,而且接受该药物治疗的小鼠的反应要比检查点抑制剂治疗反应更好。
利用人类皮肤癌样本证实了研究发现
随后研究人员对来自皮肤癌患者机体中大约450份组织样本进行研究分析后,确定了患者癌细胞中RIG-I的活性对其生存率的影响,当RIG-I激活的情况下,患者尽管患有癌症,其存活率仍然会明显延长,在20名受试个体中,患者对检查点抑制剂疗法的反应均表现较好;下一步研究人员还将对患者进行更大规模的临床试验来证实本文研究结果。
最后研究者Heidegger表示,我们希望能利用RIG-I作为一种特殊标志物来预测患者对癌症疗法的反应,这或许就能有效避免患者接受不必要的治疗;此外,我们还计划在其它小鼠模型中检测激活RIG-I信号通路的药物是否能有效发挥作用,并调查额外使用检查点抑制剂的治疗效应。
DOI:10.1084/jem.20190801

日前,一项刊登在国际杂志The Journal of Experimental Medicine上的研究报告中,来自耶鲁大学的科学家们通过研究开发出了一种新型疗法,其能刺激免疫细胞有效杀灭小鼠机体中的肿瘤,这种疗法能够单独使用,也能通当前抗癌疗法相结合来使用,且能产生持续性的治疗效应。
文章中,研究者分析了是否所开发的抵御病毒的合成性RNA分子能诱发机体抵御肿瘤的免疫反应,这种名为SLR14(Stem Loop RNA 14)的特殊分子能够有效激活关键基因的表达,从而检测细胞中的病毒和其它威胁。研究者Akiko Iwasaki说道,我们的想法是在肿瘤内部模拟病毒感染过程来诱发宿主免疫系统认定这是一起感染事件并有效清除感染(从而杀灭癌细胞)。
为了检测这一理论,研究人员尝试了几种不同的方法,他们将SLR14直接注射到小鼠的肿瘤组织中,随后他们观察到了免疫系统T细胞对癌症的摧毁过程,当将该疗法应用到肿瘤的一个位点时,其就能刺激T细胞在不同位点产生反应,这就揭示了一种广泛的治疗效应。在另一项实验中,研究者模拟了癌症的转移过程,他们将肿瘤细胞通过左心室注射到心脏中进而扩散到全身,随后的结果表明,实体瘤中SLR疗法能够有效阻断转移性癌症的生长。
进一步研究后研究者发现,SLR14能与当前的癌症免疫疗法药物相媲美,其能有效增强机体的抗肿瘤反应,作为单一疗法因子其也能够产生明显的效应;当与当前免疫疗法相结合时其还能够产生一种协同效应。研究者表示,该疗法所诱导的免疫系统“记忆”或能保护动物机体免于癌症的复发,由于免疫系统存在长效记忆,因此我们就需要利用免疫系统来寻找即将发生癌变的肿瘤组织并对其有效清理,当注射SLR后就能够促进机体产生长效免疫力。后期研究人员还希望进行更为深入的研究,在人类临床试验中来检测这种新型疗法单独使用及联合其它疗法的作用效果。
DOI:10.1038/s41590-019-0500-4

癌细胞往往是躲避宿主机体检测的“大师”;近日,一项刊登在国际杂志Nature Immunology上的研究报告中,来自耶鲁大学的科学家们通过研究开发了一种新系统,其能够帮助寻找隐藏的癌细胞,促进机体免疫系统定位并清除免疫疗法后遗漏的癌细胞。
这种新系统能减少或消除小鼠机体中的黑色素瘤、三阴性乳腺癌肿瘤和胰腺肿瘤,甚至还包括一些距离原发性肿瘤位点较远的肿瘤组织。研究者Sidi Chen教授表示,这是一种全新的免疫疗法;免疫疗法给癌症治疗带来了革命性的进展,但当前很多疗法并不能针对所有患者发挥作用,同时也只能治疗部分癌症类型;现有的治疗手段有时并不能识别癌细胞的所有分子伪装,这就使得疗法治疗效果会变差。
为了解决这些问题,这项研究中,研究人员开发了一种新系统,其能将病毒基因疗法和CRISPR基因编辑技术相结合,代替了寻找并编辑DNA并插入新基因,这种名为MAEGI(内源性基因的多重激活作为免疫疗法,Multiplexed Activation of Endogenous Genes as Immunotherapy)的新系统能对成千上万个癌症相关基因进行大规模搜索,同时像GPS一样定位并放大信号。
MAEGI能对肿瘤细胞进行标记并进行免疫摧毁,其能将冷肿瘤(缺乏免疫细胞)转化为热肿瘤(携带免疫细胞),研究者Chen表示,这相当于给肿瘤细胞穿上了橙色的防弹衣,促进机体免疫系统警察迅速找到并消灭这些癌细胞。一旦癌细胞被识别,宿主机体免疫系统就能快速对其进行摧毁消灭。
最后研究者表示,本文中所开发的新系统能够有效抵御多种癌症类型,包括对免疫疗法耐受的癌症等;后期研究人员还会继续深入研究来优化该系统从而能够更为简单对生产并为进行癌症患者的临床试验做好准备。
DOI: 10.1016/j.celrep.2019.08.095

近日,一项刊登在国际杂志Cell Reports上的研究报告中,来自罗彻斯特大学医学中心的科学家们通过研究发现,将放疗与化疗相结合不仅能够治愈小鼠的胰腺癌,还能重编程其机体免疫系统产生一种特殊的“免疫记忆”,就好像接种疫苗能够抵御流感一样。
研究者表示,这种新型组合疗法还能破坏扩散到肝脏(癌症转移的常见位点)中的胰腺癌细胞;胰腺癌是一种恶性、生存率较差的癌症类型,在超过80%的患者中,当其被诊断为胰腺癌时疾病常常已经处于晚期戒断,外科手术并不是最好的选择,而且化疗除了稳定患者的病情通常并没有什么效果。
众所周知,胰腺癌很难治疗,因为胰腺肿瘤被有毒的蛋白质和其它组织所包围,其能保护胰腺癌细胞免受宿主机体免疫系统的攻击;这项研究中,研究人员开发出了一种“一箭双雕”的创新性组合疗法,其不仅能激活宿主机体T细胞来攻击癌细胞外,还能降免疫抑制细胞转化为战斗细胞。
研究者在实验室模型中使用的组合性疗法包括立体定向放射治疗(stereotactic body radiotherapy,SBRT)和白介素-12(IL-12),SBRT能在短时间内提供高剂量的辐射,同时还能刺激机体免疫系统杀死癌细胞;IL-12则具有抗癌活性,其能激活宿主机体的免疫系统功能。然而,IL-12通常会带来严重的副作用,为了解决这一问题,目前研究人员正在胰腺癌小鼠模型中设计并检测一种定时释放的技术,这种技术能在两周内缓慢释放药物作用至患处;后期研究人员还将深入研究阐明这种新型组合性疗法的效果和副作用。
DOI: 10.1016/S1470-2045(19)30514-5

Pegilodecakin是目前正在进行临床试验的一类药物,已显示出积极的安全性结果,可能为非小细胞肺癌(NSCLC)和肾癌患者提供一个潜在的新治疗途径。一项由德克萨斯大学MD安德森癌症中心领导的研究表明,该药物与两种主要的抗PD-1单克隆抗体pembrolizumab和nivolumab联合使用,对这些患者产生了可测量的反应。这项多中心Ib期研究的结果于近日发表在《柳叶刀肿瘤学》(Lancet Oncology)上。
"抗PD-1单克隆抗体与Pegilodecakin联合具有可控的毒性和有希望的抗肿瘤活性。"副教授Aung Naing博士说道。"我们的研究表明,与单纯使用抗PD-1单克隆抗体治疗的患者相比,这种组合在先前接受过治疗的NSCLC和肾癌患者中显示出良好的反应。"
该研究旨在评估pegilodecakin联合pembrolizumab或nivolumab的安全性、耐受性和最大耐受剂量,同时研究生物标志物,以确定可能对治疗有反应的患者。
这项研究从2015年2月到2017年9月进行,追踪了111名肾癌、非小细胞肺癌和晚期恶性实体瘤黑色素瘤患者。最常见的副作用是贫血、疲劳、血小板计数低和甘油三酯水平高。
研究结果表明43%的NSCLC患者、40%的肾癌患者和10%的黑色素瘤患者出现了客观反应。患者接受了pegilodecakin联合pembrolizumab或nivolumab治疗,直至病情进展、毒性需要停药、患者撤回同意或研究结束。如果研究者确定患者将继续受益,患者在疾病进展后继续接受联合治疗或单独使用pegilodecakin。
Pegilodecakin是由重组白介素-10 (IL-10)偶联聚乙二醇(PEG)形成。IL-10是一种调节多种免疫细胞活性的蛋白质,高浓度的IL-10可以激活针对癌细胞的免疫反应。PEG与IL-10的结合增加了其体积,防止或延迟其分解,延长其在体内循环的时间。
这种药物通过刺激CD8+ T细胞的生存、增殖和"杀伤"潜能发挥作用,CD8+ T细胞因其识别和摧毁癌细胞的能力而闻名。目前普遍认为增加肿瘤内CD8+ T细胞的数量可以改善患者的预后和生存。pegilodecakin的免疫刺激作用补充了抗PD-1单克隆抗体阻断T细胞免疫抑制作用的作用。
Naing说:"pegilodecakin结合抗PD-1单克隆抗体的活性为治疗晚期实体肿瘤引入了一类新的药物。未来的随机试验有望确定pegilodecakin作为一种单一药物以及在一系列癌症治疗中的联合用药的耐受性和临床益处。"

Dana-Farber癌症研究所与麻省理工学院(MIT)布罗德研究所(Broad Institute of MIT)和哈佛大学(Harvard)合作的科学家们报告称,使用检查点抑制剂药物nivolumab治疗后,一些癌症患者的代谢失衡与免疫治疗药物的耐药性和较短的生存期有关。
研究人员表示,这种化学变化反映了癌细胞或免疫系统在接受PD-1抗体药物nivolumab治疗后的"适应性抵抗机制",这种变化与晚期黑色素瘤和肾癌患者的存活率降低有关。氨基酸色氨酸转化成一种叫做犬尿氨酸的代谢物的变化越大,对生存的影响就越大。
"主要的信息是,在免疫检查点阻断后,癌症免疫治疗中的代谢适应可能是相关的,"Toni K. Choueiri医学博士说。代谢过程是机体内维持生命所必需的化学反应,如将食物转化为能量以运行细胞过程。
像nivolumab这样的检查点阻滞剂是一种药物,它可以释放对免疫反应的分子制动器,癌症通常使用这种制动器来逃避免疫T细胞的攻击。一个这样的分子制动器被称为PD-1。在一些病人和一些癌症类型中,这些药物已经被证明在释放T细胞攻击肿瘤方面非常有效,但是总的来说,这些药物只能帮助一小部分病人。Dana-Farber泌尿生殖肿瘤Lank中心主任Choueiri说:"肿瘤学中最重要的问题之一是,谁对现代PD-1抑制剂有反应,谁没有反应。"
科学家们研究了癌症组织样本,以寻找可能与检查点抑制剂或多或少的影响相关的因素:其中包括在肿瘤DNA中发现的癌症相关突变的数量,以及与对检查点阻滞剂的反应相关的其他基因"特征"。科学家们在当前研究中发现的代谢变化可以在血液中进行测量--这是基于组织的测试的一个显着优势。
"这是一个有吸引力的选择,可以用来识别与检查点阻滞剂治疗相关的代谢变化的生物标记,"Dana-Farber和哈佛医学院(Harvard Medical School)的医学助理教授Giannakis说。"我们知道新陈代谢对免疫很重要,而犬尿氨酸(一种在大多数接受nivolumab治疗的患者体内发现升高的化学物质)已知具有免疫抑制作用。"
在这项研究中,研究人员分析了三个独立的免疫治疗试验的血液样本,并测量了治疗开始前和治疗过程中几个点的代谢物(参与代谢反应的化学物质)的变化。在黑色素瘤患者中,78%的患者在治疗的第四周色氨酸到犬尿氨酸的转化增加,26.5%的患者在治疗的第四周增加超过50%。在肾癌患者中,nivolumab治疗也与犬尿氨酸的升高有关。
分析显示,黑色素瘤和肾癌患者中,nivolumab中色氨酸到犬尿氨酸的转化水平越高,存活率越低:特别是,血液测试显示犬尿氨酸和色氨酸比增加超过50%的黑色素瘤患者的平均生存期为15.7个月,而那些这一比率较低的患者的平均存活时间超过39个月,对肾癌患而言这一数据分别为16.7和31.3个月。
目前研究人员还不清除究竟PD-1检查点阻滞剂是如何使色氨酸转化为犬尿氨酸的。然而,一种被称为IDO的酶在从色氨酸合成犬尿氨酸的过程中起着重要作用,这种酶在许多癌症中都存在。Dana-Farber的研究人员指出,一项随机临床试验显示,仅使用IDO抑制剂治疗晚期黑色素瘤患者并没有产生阳性结果。然而,该研究并没有观察这些患者的犬尿氨酸水平。研究人员表示,他们的结果表明,将检查点阻碍物与IDO抑制剂联合使用可能"对检查点抑制触发的犬尿氨酸通路激活的特定组患者有益"。
doi.org/10.1038/s41416-019-0561-z

近日发表在《英国癌症杂志》(British Journal of Cancer)上的一项研究发现,一种自然产生的分子和免疫系统的一个组成部分可以成功地瞄准并杀死癌细胞,也可以鼓励免疫系统对抗癌症复发。
由来自伦敦国王学院的Livio Mallucci教授里领导的几个研究团队发现β-半乳糖苷结合蛋白质(βGBP)--一种免疫细胞产生的天然的分子--可以非特异性的靶向癌细胞癌细胞,使癌细胞死亡,这是通过一个压力反应途径使免疫系统可以识别癌细胞来实现的,这样可以诱发抗癌免疫反应,防止复发。
在过去的十年中,抗癌治疗取得了重大的进展,但由于只有一小部分患者对治疗有反应,因此需要进一步的发展。至关重要的是,有必要诱导免疫系统,以确保对癌症复发的长期保护。
目前实现这一目标的方法包括使用化疗药物和其他可能有害且结果不确定的制剂杀死细胞。
"相比之下,βGBP是选择性的抗肿瘤药物,不损害正常细胞。βGBP对最恶性、对目前疗法无反应的结直肠癌细胞和各种其他癌细胞都有效。伦敦国王学院癌症与药物科学学院的首席作者Livio Mallucci教授说:"这项研究为一种策略提供了实验证据,在这种策略中,以癌细胞为靶标并结合免疫刺激相,可以促进对侵袭性癌症的即时和长期反应。"
"βGBP的临床转化可以打开一个新的安全的治疗方法,可以结合直接杀死癌细胞和刺激免疫系统防止复发,这是癌症管理的重要一步。"
DOI: 10.1056/NEJMoa1910836

根据皇家马斯登NHS基金会的一项研究,两种免疫治疗药物的组合--ipilimumab和nivolumab--已经在五年内或更长的时间里阻止或逆转了晚期黑色素瘤的进展。
就在10年前,只有1 / 20的晚期黑素瘤患者能存活5年,而许多患者只能存活6到9个月。Checkmate 067 trial的结果于近日在西班牙巴塞罗那举行的2019年ESMO年会上公布,并同时发表在《新英格兰医学杂志》(The New England Journal of Medicine)上,这是检查点抑制剂联合治疗的最长的3期随访临床实验。
皇家马斯登NHS基金会的肿瘤顾问、英国癌症研究所(ICR)的教授James Larkin介绍了研究结果,他说:"在过去,转移性黑色素瘤被认为是不可治愈的。肿瘤学家认为黑素瘤与其他癌症不同,一旦扩散就无法治疗。这是我们第一次可以说,晚期黑色素瘤长期幸存者的几率现在超过50%,这是一个巨大的里程碑。"
该试验将945名晚期黑色素瘤患者随机分为三组:314名患者接受了nivolumab和ipilimumab的"双重打击";316名患者接受了nivolumab+安慰剂治疗;315名患者接受ipilimumab +安慰剂治疗。每个nivolumab单独与ipilimumab进行比较,直到疾病进展或任何副作用变得不可接受为止。
nivolumab联合ipilimumab的5年总生存率为52%,其中74%的患者5年后无治疗。nivolumab的总生存率为44%,ipilimumab的总生存率为26%。
Larkin教授表示:"把这两种药物放在一起,你实际上是在给免疫系统踩下两个刹车,而不是一个。这样,免疫系统就能够识别它之前没有识别出的肿瘤,并做出反应,摧毁它们。"
重要的是,对于那些因为疲劳、皮疹和腹泻等副作用而停止治疗的患者,结果与那些长期服用联合用药的患者一样好。关于免疫疗法的一个关键点是,即使治疗时间很短,免疫系统也可以被重新教育。这与其他治疗如化疗形成对比,化疗需要一个完整的疗程才能达到同样的效果。
67岁的Pamela Smith在发现自己的黑色素瘤扩散后不久,于2014年1月参加了Checkmate 067临床试验。
Pamela说:"当时无法动手术,所以这次试验是我唯一的选择。我每两周接受一次治疗,持续了大约四个月,结果我得了严重的腹泻,不得不停止治疗。令人惊讶的是,第一次扫描和此后的每次扫描都表明,在相对较短的时间内,它成功了。我的肿瘤缩小到原来的一半不到,而且五年来没有变化。从那以后我再也没有接受过任何治疗,我感觉棒极了。"(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


