结构生物学领域研究进展
来源:本站原创 2019-10-28 01:06
2019年10月28日 讯 /生物谷BIOON/ --本期为大家带来的是结构生物学领域的最新研究进展盘点,希望读者朋友们能够喜欢。 1. eLife:单突变严重影响细菌转运蛋白的结构与功能DOI: 10.7554/eLife.48909 最近,在《eLife》杂志上发表的一项新研究发现,通过对某个细菌蛋白进行单个氨基酸突变,会改变其结构和功能,进而揭示了复杂基因进化的影响。这项
2019年10月28日 讯 /生物谷BIOON/ --本期为大家带来的是结构生物学领域的最新研究进展盘点,希望读者朋友们能够喜欢。
DOI: 10.7554/eLife.48909
最近,在《eLife》杂志上发表的一项新研究发现,通过对某个细菌蛋白进行单个氨基酸突变,会改变其结构和功能,进而揭示了复杂基因进化的影响。这项以大肠杆菌为对象的研究可以帮助人们更好地理解转运蛋白的进化及其在耐药性中的作用。
纽约大学化学系副教授,该研究的资深作者Nate Traaseth说:“我们发现微小的突变对于转运蛋白的结构和功能十分重要。”
细胞膜是保护细胞内部不受外界环境的影响的关键。转运蛋白位于细胞膜中,它能够调控物质进出细胞的过程。这些转运蛋白通过在细胞膜一侧装载货物,然后通过改变其结构在另一侧释放,从而主动地使物质在细胞膜两侧转运。
此前研究表明,膜转运蛋白通常由多个重复元件组成。在复杂的转运蛋白中,每个结构单元的遗传序列融合在一起,成为编码该蛋白质的基因。研究者们认为,这种重复的模式是由分子量较小的膜蛋白基因演化而来,并通过复制融合在一起。然而,研究者们一直不清楚从单个融合基因产生更复杂的转运蛋白是否具有进化优势?
为了对此进行调查,纽约大学化学系的Traaseth及其同事Maureen Leninger和Ampon(Callie)Sae Her研究了一种在大肠杆菌中发现的简单转运蛋白。某些大肠杆菌菌株可能会导致严重疾病的发生,并且它们对抗生素的抵抗力越来越强。究其原因,是由于细菌膜上的转运蛋白EmrE能够将“有毒”化合物主动排出。
已知EmrE由两个相同的蛋白质亚基组成,实验表明,改变两个蛋白质亚基之一中的单个氨基酸(构成蛋白质的结构单元),使其彼此产生微小差异,能够显著改变转运蛋白的结构和功能。
这种平衡的打破会改变转运蛋白从大肠杆菌中去除有毒化学物质的能力,并降低细菌对药物的抗药性。总之,该研究可能对药物开发和抗药性研究产生影响。
Traaseth说:“尽管这些发现的临床应用距离我们只有几步之遥,但了解药物转运蛋白的进化使我们对细菌如何通过突变产生耐药性有了新的认识。”
DOI: 10.1038/s41586-019-1633-1
结核病是一种感染率极高的肺部传染性疾病,通常通过气溶胶传播。根据世界卫生组织(WHO)的估计,全世界每年有170万人死于这种类型的感染。此外,世界人口的四分之一携带至少一种结核病病原菌,虽然长期处于无症状的“休眠”状态,但最终可能会爆发。
结核分枝杆菌是结核病的主要致病菌,它通过VII型分泌系统(由驻留在细胞膜中的蛋白质组成的复合体)分泌大量效应蛋白。效应蛋白专门用于抵抗宿主免疫防御,以确保细菌在宿主中存活。然而,目前科学家们对这些分泌系统的运作机制仍然知之甚少。
近日,和西班牙癌症研究中心CNIO的科学家现在已经成功地解析了这些纳米机器的分子结构。相关结果发表在最近的《Nature》杂志上。文章作者是来自分子感染生物学研究所的Sebastian Geibel博士。
在过去五年中, Geibel博士的团队一直致力于制备可用于冷冻电子显微镜观测的蛋白样品。之后,通过与马德里的Oscar Llorca研究小组合作,使用复杂的数据处理策略计算了蛋白质复合物的三维图,并最终创建该复合体的分子结构模型。从中研究人员能够发现传输孔形成的关键因素,并找到将化学能转化为动能从而驱动效应蛋白传输的机制。
研究人员的发现导致对VII型分泌系统的功能有了更深的了解。目前分枝杆菌对抗生素的耐药性不断提高,而且没有针对肺结核的有效疫苗。研究人员的这一发现为开发针对VII型分泌系统的新型抗生素提供了重要的基础。
DOI: 10.1016/j.cell.2019.09.017

近日,研究人员首次在分子水平上观察到与许多健康问题相关的蛋白质是如何工作的。
这一发现未来可能有助于开发针对炎症,冠状动脉疾病,癌症,多发性硬化症等相关疾病的治疗方法。相关结果发表在最近的《Cell》杂志上。
在该研究中,俄勒冈健康科学大学研究助理Alanna McCarthy和OHSU研究人员Steven Mansoor博士使用冷冻电子显微镜技术,获得P2X7蛋白质受体的3D结构,并进一步观察其内部工作原理。
据悉,这一名叫P2X7的蛋白质是一种细胞膜蛋白受体,可以使带电荷的钠和钙颗粒进入胞内并传导信号。P2X7受体是配体门控离子通道P2X家族的一种亚型,与炎症,动脉斑块堆积,癌症转移,神经系统疾病等有关。P2X7之所以与众不同,是因为P2X7一旦被激活,其通道就会无限期地保持开放状态,从而不断地使带电粒子进入细胞并触发炎症的信号传导途径,最终导致细胞死亡。这样的信号传导行为可能导致与受体相关的一系列疾病的发生。
与先前的诸多研究不同,该团队的冷冻电镜成像方法使他们能够完全解析蛋白质受体的结构。之后,作者发现这一受体能够被棕榈酰基修饰,而当他们人为改变这一被修饰的氨基酸时,该受体不再无限期保持打开状态,从而关闭了其触发信号的能力。此外,作者还意外地发现鸟嘌呤核苷酸能够与P2X7结合。
Mansoor和他的团队将进一步探索棕榈酰基和鸟苷核苷酸在P2X7细胞内信号传导中的作用,它们对人类健康的潜在影响以及如何将其靶向治疗与受体相关的健康状况。
DOI: 10.1016/j.molcel.2019.06.007

最近,研究人员得到了原子分辨率级别的脊椎动物视觉的蛋白质复合物的三维结构,这一发现对我们对生物信号传导过程的理解以及相关药物的设计具有广泛的意义。
这些发现阐明了来自光子(光粒子)的信号如何在眼睛中放大。更重要的是,这项研究阐释了G蛋白偶联受体(GPCR)如何在人类中发挥作用。
“GPCRs参与了人体几乎所有的生物过程,包括我们对于光线,味道,气味的感知,心率的调节或肌肉收缩的方式-它们是30%以上药物的靶点”。该论文的第一作者,化学生物学教授Richard Cerione实验室的Yang Gao说道。
在该研究中,研究人员使用冷冻电子显微镜获得了视紫红质-转导蛋白复合物的原子分辨结构。这些结构不仅提供了脊椎动物视觉的分子基础,而且揭示了GPCR通常如何激活G蛋白的新型机制。
另外一位共同第一作者Sekar Ramachandran说:“我们从原子级别分辨率的结构中学到的知识可能广泛适用于其他GPCR信号系统。”
通过更多地了解不同的受体如何与不同的G蛋白特异性偶联,研究人员希望获得对设计特异性调节GPCR信号传导的药物的见识。
DOI:10.1038/s41586-019-1537-0

近日,一项刊登在国际杂志Nature上的研究报告中,来自中国哈尔滨工业大学和北京大学的科学家们通过研究成功利用单粒子低温电子显微镜(single-particle cryogenic electron microscopy)对人类T细胞受体复合物进行了研究。
T细胞主要扮演着在机体感染过程中发挥免疫反应的角色,此前研究结果表明,每个T细胞都有着自身的特殊受体,其对于其它细胞所产生的蛋白质非常敏感,如果特定蛋白被检测到的话,T细胞就会被激活并且尝试破坏异常的细胞;研究者表示,T细胞受体包括8个蛋白质,其中6个都是CD3蛋白,另外两个则是TCR蛋白。
在一个既定的T细胞中,TCR蛋白存在于细胞膜外部,这就意味着,其是负责检测外源性蛋白受体的一部分,CD3蛋白则存在于细胞膜上(呈螺旋状),其能充当细胞和TCR蛋白之间的交流系统,这项研究中,研究人员利用特殊类型的电子显微镜研究了TCR和CD3蛋白相互作用和交流的多种方式。
此前研究中研究者发现有两种类型的TCR蛋白(TCRα和TCRβ)和4种类型CD3蛋白(CD3ε、CD3γ, CD3δ和CD3ζ),他们认为每一种类型的蛋白质在检测外源性蛋白上都扮演着非常关键的角色,研究者希望能利用分辨率为3.7埃的单粒子低温电子显微镜对每一种蛋白质所扮演的角色进行深入研究。
研究者指出,我们的成像结果提供了一定的理论依据,揭示了T细胞或能以一种方向选择性的方式来发挥作用,当其识别抗原时其能充当一种力学传感器,其还能在一个方向上与配体进行结合,研究者希望能够深入研究CD3螺旋结构的跨膜束,其能以平行的方式存在,相对于代替脂质溶解蛋白质的膜材料。本文研究结果或能为后期科学家们深入研究机体免疫反应的分子机制提供一个更好的平台,也有望帮助开发诸如自身免疫性疾病等多种人类疾病的新型疗法。
doi:10.1016/j.cell.2019.07.028.
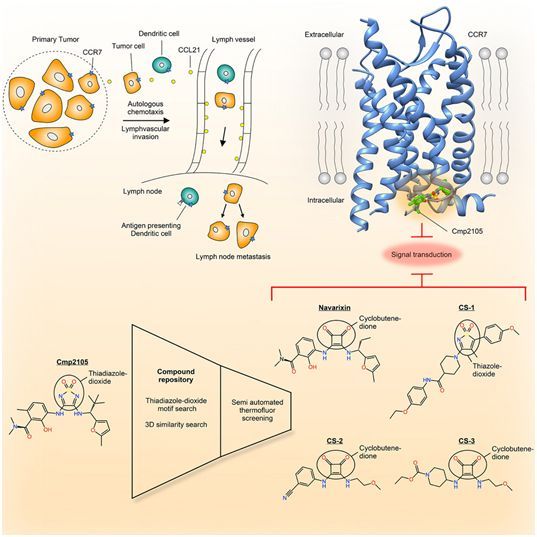
在一项新的研究中,来自瑞士保罗谢勒研究所和制药巨头罗氏公司的研究人员在开发阻止某些癌症转移的药用试剂方面迈出了重要的一步。通过使用瑞士光源(Swiss Light Source),他们解析出一种在癌细胞迁移中起关键作用的受体的结构。这使得鉴定出可以通过身体的淋巴系统阻止某些癌细胞扩散的药用试剂成为可能。相关研究结果近期发表在Cell期刊上,论文标题为“Structural Basis for Allosteric Ligand Recognition in the Human CC Chemokine Receptor 7”。
当癌细胞在体内扩散时,称为转移瘤的继发性肿瘤就可形成。这些继发性肿瘤导致大约90%的癌症患者死亡。传播癌细胞的一个重要途径是通过淋巴系统,淋巴系统像血管系统一样贯穿整个身体并将淋巴结彼此相互连接在一起。当白细胞通过淋巴系统迁移以便协调对抗病原体的防御时,作为一种特定的膜蛋白,趋化因子受体7(CCR7)起着重要作用。它位于细胞膜中,它可以接收外部信号并将这些信号传递到细胞内部。在与罗氏公司的合作中,保罗谢勒研究所的研究人员首次能够解析出CCR7的结构,这就为开发可以阻止某些常见的癌症转移的药物奠定基础。
在所有脊椎动物的细胞中,20种不同的趋化因子受体可与40多种称为趋化因子的信号蛋白相互作用。这些信号蛋白中的每一种仅适合于特定的受体。反过来,如果一种信号蛋白与受体结合,它会触发细胞内的过程,从而导致针对这种信号蛋白携带的信号的特定细胞反应。
CCR7是控制体内细胞迁移的受体之一。一旦细胞外的合适信号蛋白与它结合,细胞中的连锁反应就会使得细胞向这种信号蛋白的最高浓度方向移动。细胞遵循这种趋化因子的轨迹移动,就像追踪某种气味的猎犬。比如,作为身体免疫系统的重要细胞,白细胞源源不断地流向淋巴结。
癌细胞也可以利用CCR7并且为了自身的目的滥用这种细胞受体。合适的信号蛋白将它们引导出肿瘤并进入淋巴系统。此外,它们在体内扩散并最终在其他组织中形成转移瘤。这些转移性肿瘤极大地增加了患者的死亡风险。
为了提高癌症患者的存活率,抑制这种癌细胞转移过程具有重要的医学意义。这就是为什么保罗谢勒研究所研究人员在该研究所的瑞士光源(SLS)上使用X射线晶体衍射技术来解析CCR7受体的结构。
这种结构成为了与罗氏公司合作寻找相应活性试剂的基础。论文共同第一作者Steffen Brünle解释道,“合适的活性试剂分子可以阻止信号蛋白与这种受体结合并在细胞内引起反应。”解析这种受体的结构是一个真正的挑战。论文共同通讯作者、保罗谢勒研究所时间分辨晶体学研究小组联合负责人Jörg Standfuss说,“针对这一点的困难之处在于:首先,以我们能够利用X射线晶体学衍射技术研究它们的方式,培养出相应的晶体。”为了加快研究进程,罗氏公司开发了自己的新型蛋白修饰技术模块,即所谓的结晶伴侣蛋白(crystallization chaperone)。
利用关于这种受体精确结构的信息,他们能够鉴定出5种阻断这种受体的潜在药用分子,比如Navarixin,可阻止信号蛋白携带的信号传递到细胞中。Navarixin是一种多靶标拮抗剂。这5种化合物可作为潜在癌症治疗药物的候选药物。Brünle说,“我们的实验表明,细胞内的这种人工分子与这种受体结合。这阻止了导致细胞迁移的连锁反应的启动。”
doi:10.1126/science.aaw9144.
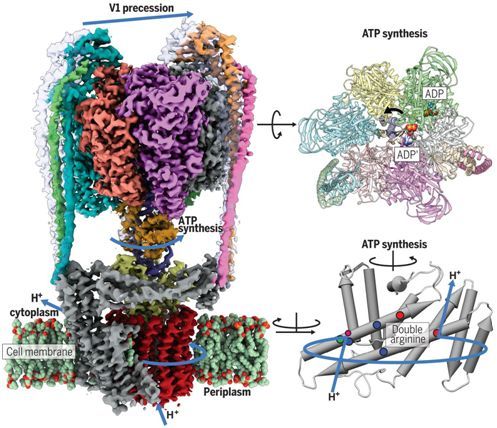
细胞依赖于称为ATP合酶(ATP synthase)或ATP酶(ATPase)的蛋白复合物来满足它们的能量需求。三磷酸腺苷(ATP)分子为维持生命的大部分过程提供能量。在一项新的研究中,奥地利科学技术研究所的结构生物学者Leonid Sazanov和博士后研究员Long Zhou如今解析出V/A-ATP酶家族代表性成员的首个原子结构,填补了这些必不可少的分子机器的进化树上的空白。利用最新的低温电镜(cryo-EM)方法获得的这些结果揭示了这种酶的结构类似于涡轮机或水磨机。相关研究结果发表在2019年8月23日的Science期刊上,论文标题为“Structure and conformational plasticity of the intact Thermus thermophilus V/A-type ATPase”。
旋转动力
ATP合酶/ATP酶是大型膜蛋白复合物,它们具有相同的整体结构和旋转催化机制。这种蛋白质家族包括在线粒体(细胞的能量工厂)、叶绿体(在植物中进行光合作用的细胞器)和细菌中发现的F型ATP酶,叶绿体(在植物中进行光合作用的细胞器)和细菌;在真核生物(具有细胞核的高等生物)中发现的V型ATP酶;在古细菌(古老的微生物)和一些细菌中发现的A型ATP酶。
不同类型的ATP酶
F型ATP酶和A型ATP酶通常起着产生ATP的作用,这种ATP产生由跨膜的质子流动驱动。V型ATP酶通常起着相反的作用,使用ATP泵送质子。V型ATP酶和A型ATP酶在结构上相类似,与F型ATP酶不同,具有两个或三个外周茎部结构和位于结构域V1和V0之间的额外连接蛋白亚基。V型ATP酶很可能是从A型ATP酶进化而来的,由于这些相似性,A型ATP酶也被称为V/A-ATP酶。一些细菌,包括嗜热栖热菌(Thermus thermophilus)获得了A型ATP酶。Zhou纯化出嗜热栖热菌的V/A-ATP酶:ThV1Vo,并利用cryo-EM研究了这种酶。与F型ATP酶相反的是,人们之前仅确定了V型ATP酶的V1和Vo结构域的结构。因此,人们并不清楚V1如何与Vo结合在一起,而且也不了解这个完整的催化循环。
可塑性和竞争
Sazanov和Zhou利用cryo-EM解析出完整的ThV1Vo酶的总共5种结构,而不是一种结构。这些结构代表着这种酶的几种构象状态,它们的不同之处在于转子(rotor)在定子(stator)内部的位置。
ThV1Vo的整体构象可塑性表现为当从一种构象状态向另一种构象状态过渡时,V1结构在空间上的剧烈摆动。这是弯曲的中心转子的旋转和定子的刚度之间的机械竞争的结果。V1-Vo偶联在一起是通过轴与连接到c环(c-ring)的V型ATP酶特异性亚基之间的紧密结构匹配和静电匹配实现的。质子路径的可视化揭示了带电荷的蛋白残基的分布与F-ATP酶中的存在着显着差异,具有更严格的“检查点”来防止这种酶的“滑落”。
为何增添额外的复杂性?
不同于具有单个外周茎部结构的F-ATP酶,诸如ThV1Vo之类的A-ATP酶具有两个外周茎部结构,而真核生物V-ATP酶则具有三个。但是,在已非常大的蛋白组装物上增添额外的复杂性以及连接V1和Vo的额外亚基的优势是什么?F1/V1结构域具有三重对称性,因此定子在F1/V1内部每旋转120°就产生(或消耗)一个ATP分子。
Sazanov说:“在V/A -ATP酶中,这一步是一次性旋转120°,与此不同的是,在F-ATP合酶中,它分为几个子步骤。因此,ThV1Vo可能需要更大的可塑性,以便将V1结构域中的这些120°旋转步骤与Vo c12环中更小的每个c亚基步骤相关联在一起。在V-ATP酶中,这种额外的灵活性可能通过这些额外的外周茎部结构和连接亚基加以实现。我们解析出的新结构显示了这一点是如何实现的,这就为整个V-ATP酶家族提供了框架。”
DOI: 10.1073/pnas.1818530116
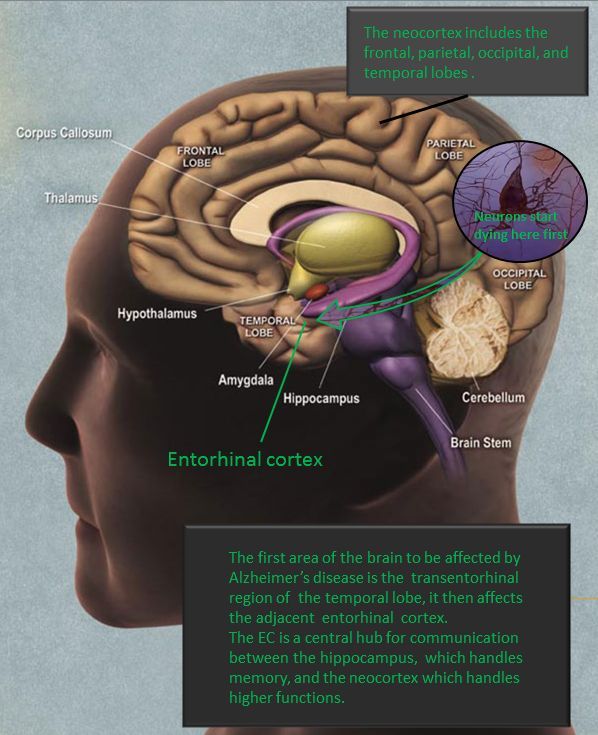
宾汉顿大学(Binghamton University)和科罗拉多丹佛大学(University of Colorado Denver)的研究人员组成的一个研究小组,首次绘制了一种导致阿尔茨海默症加速发展的侵略性蛋白质聚合体的分子结构。
宾汉顿大学生物物理化学助理教授Wei Qiang说:"大约10%的老年痴呆症病例是由家族突变引起的。另外90%的病例是由野生型淀粉样蛋白折叠不当引起的。我们需要了解疾病病理的分子基础。这样我们或许有一天能创造出防止这种疾病退化的药物。"
阿尔茨海默氏症是由一种叫做β-淀粉样蛋白的有毒蛋白质片段形成一种叫做原纤维的链状结构开始发展的,这种结构出现在脑细胞中,并杀死脑细胞。Qiang和科罗拉多丹佛大学的研究人员使用高分辨率的固态核磁共振波谱来研究这些纤维。他们的工作揭示了这些纤维可能在人脑淀粉样沉积的分子结构中具有主要的变异。更重要的是,纤维可以作为进一步纤维沉积的"种子",这是阿尔茨海默病的一个潜在危险因素。
"这项工作描述了一种病理相关的β-淀粉样纤维变异的分子结构模型," Qiang说。"我们证明,这种变异可能导致新的淀粉样蛋白纤维迅速播种,这可能有助于淀粉样蛋白沉积在人脑中的扩散和放大。"
Qiang和他的团队正在研究其他几种类型的纤维变异,特别是结构变异、它们的播种能力和由此产生的细胞毒性水平之间的相关性。
"我们已经取得了令人兴奋的结果,一份描述这些进一步发现的新手稿正在准备中," Qiang说。
DOI: 10.1038/s41586-019-1391-0

几乎所有的生物体,从细菌到人类,细胞膜上都有类似门的蛋白质复合物,可以清除不必要的或危及生命的分子。但这并不总是有利的,因为在细菌或癌细胞的情况下,这些复合物,称为ABC转运体,也负责对抗生素或化疗的耐药性。法兰克福歌德大学(Goethe University Frankfurt)和同样位于法兰克福的马克斯o普朗克生物物理研究所(Max Planck Institute of Biophysics)的研究人员,现在已经成功解密了该蛋白传输机制的所有阶段,相关研究成果于近日发表在《Nature》上,题为"Conformation space of a heterodimeric ABC exporter under turnover conditions"。
在过去的五年里,法兰克福歌德大学生物化学研究所的Robert Tampe领导的研究小组投入了大量的精力来制备敏感的膜蛋白复合物样品,使它们能够在膜环境中通过低温电子显微镜进行检测。低温电子显微镜通过冷冻分子来提供高分辨率的图像。
如果目标不仅是生成复杂分子的清晰图像,如ABC转运体,而且还要观察它们的工作状态,那么就需要不同阶段的快照。Tampe领导的生物化学家团队通过向转运体提供不同浓度的ATP和ADP来故意触发这些过程。没有ATP的能量供应,转运体就无法根据细胞内部和周围环境之间的浓度梯度进行分子移位。
在该研究中,Tampe和他的同事展示了由两个不同的蛋白质亚基组成的ABC出口复合物的八个高分辨率构象。研究人员还首次发现了转运过程的中间阶段。《Nature》杂志的出版商将这一重要发现选为了该期的封面故事。
Tampe教授解释说:"我们的工作可能会带来结构生物学的范式转变,因为几乎可以以原子分辨率显示细胞机器的所有运动。由于这一意外发现,我们现在可以回答关于ABC转运体运输机制的问题,这些问题之前是有争议的辩论主题,与医学高度相关。"此外,研究人员还首次观察到通道是如何向内或向外打开的。2.8埃的分辨率(1埃=千万分之一毫米)是利用低温电子显微镜对ABC转运体结构成像的最高分辨率。
DOI: 10.1126/science.aaw7611
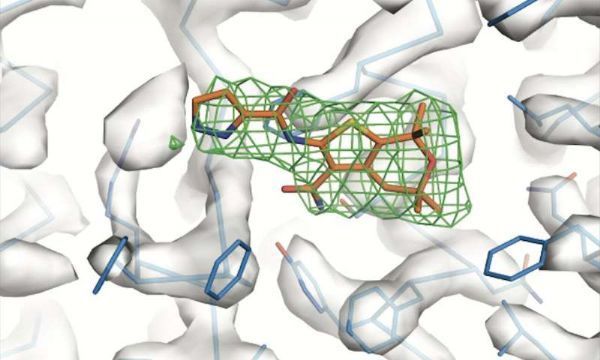
近几十年来,囊性纤维化患者的治疗方案有了显着改善。最新的药物,即所谓的增强剂,针对的是一种叫做囊性纤维化跨膜电导调节剂的蛋白质,这种蛋白质在患者身上发生突变。然而,尽管这些药物可以帮助一些CF患者,但它们远非完美。此外,到目前为止,研究人员还没有弄清楚这些药物是如何起作用的。
洛克菲勒科学家的一项新研究首次描述了在原子分辨率下增强剂和它们所针对的蛋白质之间的相互作用。《Science》杂志最近的一份报告中描述的这项研究表明,两种不同的化合物对同一蛋白质区域起作用--这一发现为开发更有效的药物指明了方向。
寻找热点
囊性纤维化跨膜电导调节因子(CTFR)是一个通道,当打开时,允许氯离子进出细胞。当CFTR发生突变时,离子无法自由流动,导致粘膜内壁的组成发生变化。这些变化在肺部尤其危险,它们会导致厚厚的粘液堆积,常常导致呼吸受损和持续感染。
增强剂用于增加离子通过CFTR的流动,改善囊性纤维化(CF)的一些症状。目前,市场上只有一种这样的药物,叫做ivacaftor;另一个名为GLPG1837的项目正在开发中。
Ivacaftor可以改善大约10%的肺功能。它可以帮助很多很多病人,但它不是一种治疗方法,也不是每个人都对它有反应。所以有很多人对开发新的增强剂感兴趣。
为了实现这一目标,Chen和她的同事们研究了现有的增强剂是如何工作的。他们使用低温电子显微镜--一种在冷冻标本上发射电子以揭示原子水平上蛋白质结构的技术--来研究附着在ivacaftor或GLPG1837上的CFTR的结构。出乎意料的是,研究人员发现这两种药物与蛋白质的同一位点结合。
"这些化合物由两家不同的公司开发,具有非常不同的化学性质。但他们还是设法到达了同一个地点。这告诉我们,这是一个非常敏感、非常重要的蛋白质区域。"
更好的药物,更多的途径
在分析了两个增强剂结合的"热点"后,研究人员注意到一个特殊的特征:这个区域包含在膜内的解开环,表示一个灵活的结构。研究人员意识到,这种灵活性具有实用功能。
Chen说:"我们确定的区域实际上是一个铰链,它可以打开让离子通过通道--所以它的结构需要灵活。我们研究的化合物与那个区域结合,把它锁在一个通道打开的构象中,以改善离子流动。这就是他们的工作方式。"
有了这些知识,研究人员希望制造出直接针对铰链的化合物,并在保持离子通道畅通方面做得更好。在Chen和她的同事致力于新药开发的同时,她鼓励其他研究人员也这样做。她希望这种竞争能够降低增强剂的成本,让更多的病人可以使用这种药物。
"我们把原始数据放到网上,欢迎任何人使用它,"Chen说。"因为如果更多的研究人员使用它,就会有更多的治疗选择,价格会下降,更多的人会得到帮助。"
回顾这项突破性的研究,Chen赞扬了今年三月去世的David C. Gadsby的工作。他是Patrick A. Gerschel家族名誉教授、心脏和膜生理学实验室主任,Gadsby在CFTR上的早期工作为Chen的大部分研究奠定了基础。
"他对CFTR做了一系列漂亮的功能研究,他是灵感和知识的源泉,"她说道。"很遗憾,他没有看到这些成果。我们把这项研究献给他。"(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


