罕见血管炎新药!欧盟批准首创口服选择性补体C5a受体抑制剂Tavneos:治疗ANCA相关血管炎!
来源:本站原创 2022-01-20 00:42
Tavneos通过精确地阻断C5a受体,阻止破坏性炎症细胞对C5a激活做出反应。
血管炎(图片来源:scientificanimations.com)
2022年01月19日讯 /生物谷BIOON/ --ChemoCentryx公司近日宣布,欧盟委员会(EC)已批准Tavneos(avacopan),该药是一种口服选择性补体5a受体(C5aR)抑制剂,联合利妥昔单抗(rituximab)或环磷酰胺方案,用于治疗严重、活动性肉芽肿性多血管炎(GPA)或显微镜下多血管炎(MPA)成人患者。GPA和MPA是抗中性粒细胞胞浆自身抗体(ANCA)相关血管炎(又名ANCA血管炎)的2种主要类型。
2021年9月,Tavneos率先获得日本批准,用于治疗ANCA血管炎。2021年10月,Tavneos在美国获得批准:作为一种辅助药物,联合标准疗法,用于成人患者治疗严重活动性ANCA血管炎(GPA和MPA)。值得一提的是,Tavneos是美国FDA批准的第一个口服补体5a受体(C5aR)抑制剂,同时也是十年来第一个获批治疗ANCA相关血管炎的药物。
ANCA血管炎是一种罕见和严重的系统性自身免疫性疾病,补体系统的过度激活进一步激活中性粒细胞,导致炎症并最终破坏小血管。该病会导致器官损伤和衰竭,肾脏是主要靶器官,如果不进行治疗往往会致命。
ChemoCentryx总裁兼首席执行官Thomas J.Schall博士表示:“欧盟对Tavneos的批准代表着全球第三大监管部门认识到这一期待已久的新疗法对ANCA相关性血管炎这一衰弱且往往致命性疾病的价值。我们祝贺我们的联盟伙伴Vifor Pharma取得这一重大成就。”
avacopan化学结构式(图片来源:medchemexpress.cn)
ANCA相关血管炎是一种破坏性疾病,目前的治疗往往会导致严重甚至致命的副作用,并降低生活治疗。Tavneos的批准上市,将提供一种急需的新治疗选择,为患者带来更加光明的未来。
Tavneos的监管批准基于全球性关键3期ADVOCATE临床试验的数据。该研究达到了第26周疾病缓解和第52周持续缓解的主要终点。
数据显示,根据伯明翰血管炎活动评分(BVAS)评价,与泼尼松(prednisone)治疗组相比,avacopan治疗组在第26周疾病缓解和第52周持续缓解方面具有统计学优势。该试验中,与泼尼松治疗组相比,avacopan治疗组的糖皮质激素毒性显著降低、肾功能得到更大改善、与健康相关的生活质量指标也有较大改善。
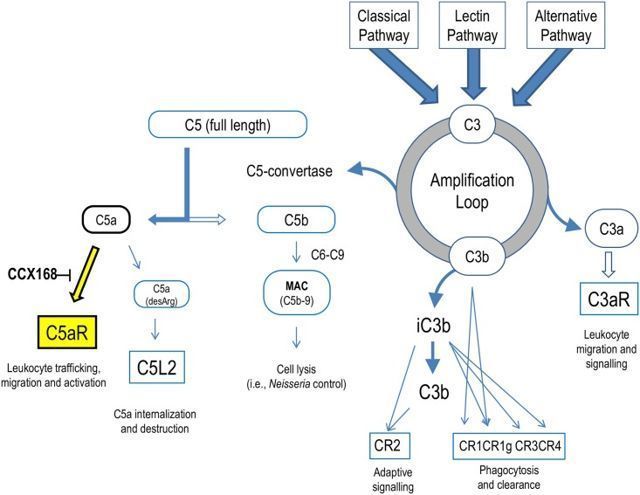
avacopan(CCX168)作用机制
avacopan是一种口服小分子,是补体C5a受体C5aR1的选择性抑制剂。通过精确地阻断破坏性炎症细胞如中性粒细胞表面存在的促炎性补体系统片段C5a的受体(C5aR),avacopan可阻止这些细胞对C5a激活作出损害的能力,而C5a激活是ANCA血管炎的驱动因素。avacopan治疗旨在有效控制炎症性血管炎过程,防止复发,同时降低治疗相关损害的风险。此外,avacopan仅针对C5aR1的选择性抑制作用使C5a I通路通过C5L2受体正常工作。
ChemoCentryx负责avacopan的发现和开发,并拥有该药在美国的商业化权利。Vifor Pharma通过与ChemoCentryx达成的肾脏健康联盟,获得了在美国以外市场商业化avacopan的独家权利。
目前,ChemiCentryx也在开发avacopan用于治疗C3肾小球疾病(C3G)和化脓性汗腺炎(HS)患者。此前,美国FDA已授予avacopan治疗ANCA相关性血管炎、C3G、非典型溶血尿毒综合征(aHUS)的孤儿药资格。在欧盟,EMA已授予avacopan治疗C3G以及2种类型ANCA血管炎(GPA和MPA)的孤儿药资格。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


