研究发现胶质母细胞瘤的潜在新靶点并揭示其作用机制
来源:网络 2024-05-23 11:03
研究利用体内结合体外的CRISPR-Cas9筛选策略发现泛素连接酶RBBP6通过调控可变多聚腺苷酸化促进GSC的增殖、自我更新及肿瘤生长。
西湖大学生命科学学院谢琦、深圳湾实验室李磊及匹兹堡大学Jeremy N. Rich共同通讯在Cell Discovery杂志发表题为“RBBP6 maintains glioblastoma stem cells through CPSF3-dependent alternative polyadenylation”的研究论文。该研究利用体内结合体外的CRISPR-Cas9筛选策略发现泛素连接酶RBBP6通过调控可变多聚腺苷酸化促进GSC的增殖、自我更新及肿瘤生长。

文章截图
泛素化是一种重要的翻译后修饰,参与调控肿瘤的发生、发展、转移及复发,是肿瘤治疗的潜在靶点。因此该研究构建了一个靶向去泛素化酶和泛素连接酶的CRISPR-Cas9文库,为了克服体外单一细胞培养条件与体内的巨大差异,采用体内和体外CRISPR-Cas9筛选相结合的策略,发现泛素连接酶RBBP6是调控GSC的关键分子。进一步验证实验证明RBBP6敲除抑制GSC的增殖及自我更新(图1)。

图1 :CRISPR-Cas9筛选发现RBBP6是维持GSC的重要分子
为阐明RBBP6调控GSC的分子通路,作者通过RNA-seq发现RBBP6调控MYC信号通路及MYC的表达。进一步研究发现RBBP6调控mRNA的可变多聚腺苷酸化,RBBP6敲低使得MYC的竞争性内源性RNA(ceRNA)的3’UTR缩短(不影响MYC的3’UTR长度),释放出游离的miRNA抑制MYC的表达,进而抑制胶质母细胞瘤的生长(图2)。

图2: RBBP6通过控制mRNA的可变多聚腺苷酸化调控MYC的表达
为阐明RBBP6调控可变多聚腺苷酸的分子机制,通过免疫沉淀偶联质谱分析发现RBBP6与可变多聚腺苷酸化修饰调控因子CPSF3互作,介导其K63多聚泛素化修饰并稳定其蛋白水平(图3)。

图3: RBBP6 通过介导CPSF3的K63多聚泛素化促进其稳定性
为探索靶向RBBP6/CPSF3-APA-MYC轴治疗GBM的可能性,作者研究发现敲除RBBP6或者CPSF3都可以显著抑制小鼠GBM模型中的肿瘤生长,延长荷瘤小鼠生存期。由于暂无针对RBBP6抑制剂,作者利用药物缓释泵向小鼠脑内递送CPSF3抑制剂JTE-607,可以显著抑制肿瘤生长(图4)。

图4:靶向RBBP6/CPSF3抑制GBM生长
综上所述,RBBP6介导可变多聚腺苷酸化调控蛋白CPSF3的K63多聚泛素化。敲除RBBP6加速CPSF3的降解,导致关键癌基因MYC的竞争性内源性RNA(ceRNA)的3’UTR缩短,释放出游离的miRNA抑制MYC的表达,进而抑制胶质母细胞瘤的生长。这项研究确定了RBBP6调控可变多聚腺苷酸化影响MYC的表达,靶向RBBP6-CPSF3轴可以抑制胶质母细胞瘤的生长,为胶质母细胞瘤的潜在治疗靶点提供了支持(图5)。
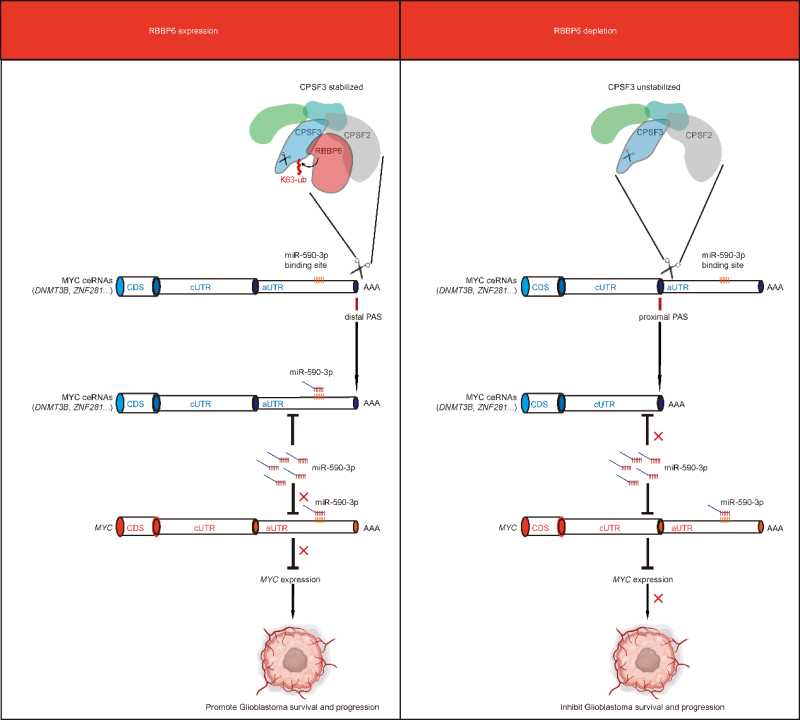
图5:RBBP6调控GSC的作用模型
西湖大学谢琦研究员、深圳湾实验室李磊研究员、匹兹堡大学Jeremy N. Rich为共同通讯作者,西湖大学博士研究生林鹏、深圳湾实验室博士后陈文燕为本文共同第一作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


