癌症患者为何消瘦?武汉大学宋威/杨智勇/袁玉峰团队揭示肿瘤分泌蛋白利用胰高血糖素引起宿主消瘦
来源:生物世界 2025-02-12 10:40
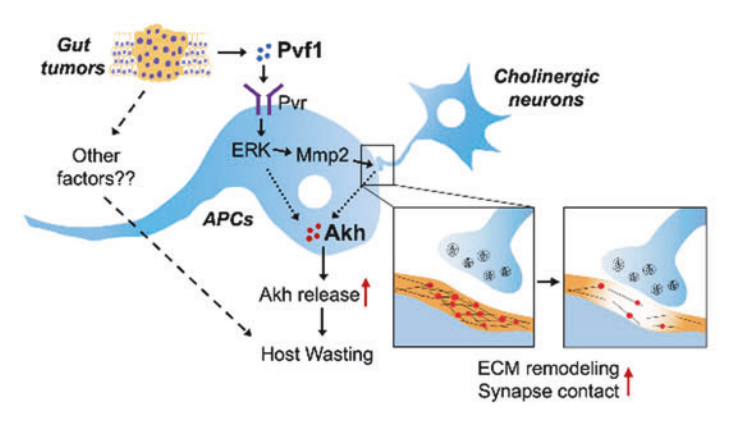
这项研究揭示了肿瘤通过分泌 Pvf1 蛋白,激活 Pvr 受体,进而通过 Mmp2 依赖的 ECM 重塑和神经支配,促进 Akh/胰高血糖素的释放,导致宿主全身性的能量消耗。
武汉大学中南医院宋威、杨智勇、袁玉峰等人,在 Cell Discovery 期刊发表了题为:A tumor-secreted protein utilizes glucagon release to cause host wasting 的研究论文。
该研究揭示了肿瘤通过分泌特定蛋白质来调控宿主代谢,进而导致全身性的消耗症状(例如肌肉功能障碍、脂肪流失、高血糖和卵巢萎缩等)。这项研究不仅揭示了肿瘤如何通过调控宿主的代谢激素来引发全身性的消耗,还为开发针对癌症恶病质的治疗方法提供了新思路——通过抑制胰高血糖素或其受体,或能有效缓解肿瘤患者的消耗症状,改善其生活质量。

研究使用了果蝇作为模型,特别是携带 yki3SA 肠道肿瘤的果蝇。果蝇的脂肪动员激素(adipokinetic hormone,Akh)与人类的胰高血糖素(glucagon)功能相似,都是分解代谢激素,能够动员全身的能量储备。
该研究发现,yki3SA 肠道肿瘤增加了 Akh 的产生,导致宿主出现全身性的消耗症状,包括肌肉功能障碍、脂肪流失、高血糖和卵巢萎缩。研究团队进一步发现,肿瘤分泌的 Pvf1 蛋白通过激活 Akh 产生细胞中的 Pvr 受体,促进 Akh 的释放。
从机制上来说, Pvf1-Pvr 信号轴通过触发 Mmp2 依赖的细胞外基质(ECM)重塑和增强兴奋性胆碱能神经元的神经支配,促进 Akh 的释放。研究还发现,类似的机制在哺乳动物中同样存在,肿瘤通过促进胰高血糖素的释放导致器官消耗。
研究团队在小鼠模型中验证了胰高血糖素在肿瘤诱导的消耗中的作用。胰腺癌患者和肿瘤小鼠模型中都观察到胰高血糖素水平的升高。而通过抑制胰高血糖素或其受体(GCGR),可以有效缓解肿瘤诱导的器官消耗。
该研究发现,胆碱能神经元通过投射到 Akh 产生细胞(APC)来调控 Akh 的释放。在肿瘤存在的情况下,这种神经支配增强,导致 Akh 释放增加,进而引发全身性的能量消耗。类似地,在哺乳动物中,肿瘤通过 VEGFR/PDGFR 信号通路促进胆碱能神经元与 α 细胞的接触,增加胰高血糖素的释放。
总的来说,这项研究揭示了肿瘤通过分泌 Pvf1 蛋白,激活 Pvr 受体,进而通过 Mmp2 依赖的 ECM 重塑和神经支配,促进 Akh/胰高血糖素的释放,导致宿主全身性的能量消耗。这一机制在果蝇和哺乳动物中都是保守的。研究结果为理解肿瘤诱导的恶病质提供了新的分子机制,并提示通过抑制胰高血糖素或其受体可能成为治疗癌症恶病质的潜在策略。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


