间充质干细胞治疗皮肤类疾病1类新药申报获受理
第二款新药获得受理,再次彰显了易文赛在干细胞药物研发领域的实力。未来,易文赛将继续加大研发投入,加快药物研发进程,以期为更多难治性疾病提供有效的治疗方法,为更多患者带来新希望,为推动细胞行业的发展做出
中盛溯源iPSC来源NK细胞药物IND获受理
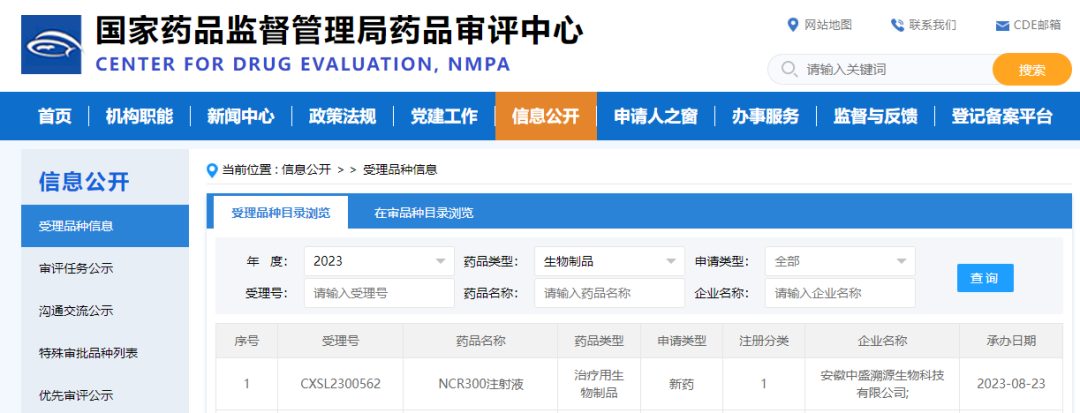
8月23日,CDE官网公示安徽中盛溯源生物科技有限公司(简称“中盛溯源”)“NCR300注射液”IND申请获受理,此次临床申报为新适应症申报。今年4月2
减肥药最新进展:中国生物制药GMA106申请Ib/II期临床试验获受理
GMA106计划在中国通过Ib期试验研究进一步确认更高剂量在超重和肥胖人群中多次给药的安全性和耐受性。II期研究将在不同队列中探索不同剂量和给药频率治疗24周和36周后的初步疗效。
安斯泰来:中国药监局受理 Zolbetuximab 生物制品上市许可申请
8月1日,安斯泰来制药集团宣布,NMPA 药品评审中心(CDE)已受理zolbetuximab 的生物制品上市许可申请(BLA)。
里程碑时刻:FDA受理首个CRISPR基因编辑疗法上市申请
CRISPR Therapeutics的创始人是2020年凭借CRISPR基因编辑获得诺贝尔化学奖的Emmanulle Charpentier。
患者年出血率降低71%,辉瑞血友病基因疗法上市申请获FDA受理
近日,辉瑞公司(NYSE: PFE)宣布,FDA 已受理其用于治疗成年人 B 型血友病的基因疗法 fidanacogene elaparvovec 的生物制品许可证申请(BLA),审查的最终日期是 2
K药+化疗上市申请获FDA受理,有望年底上市
4月13日,默沙东宣布,FDA已接受Keytruda(帕博利珠单抗)联合化疗一线治疗HER2阴性晚期胃癌或胃食管交界处 (GEJ) 腺癌的补充生物制剂许可申请(sBLA),PDUFA日期定为2023年
核药领域再传捷报,远大医药全球创新RDC药物ITM-11国内IND获受理
ITM-11目前已获美国FDA和欧洲药品管理局(EMA)的孤儿药资格,针对GEP-NETs适应症,ITM-11对比依维莫司(Everoliumus)的临床研究在海外已进入III期临床。
中国国家药品监督管理局正式受理新可来®重度嗜酸粒细胞性哮喘适应症注册申请
美泊利珠单抗通过与IL-5结合,阻断IL-5与嗜酸粒细胞表面受体的结合,从而使血液中嗜酸粒细胞的数量降低并维持在正常水平。