盘点:2022年终盘点:2022年Cell期刊精华
来源:生物谷原创 2022-12-27 22:20
2022年即将结束,在过去的一年里,Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2022年即将结束,在过去的一年里,Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:里程碑进展!揭示人类伴侣蛋白TRiC指导微管蛋白折叠机制
doi:10.1016/j.cell.2022.11.014
人类微管蛋白(tubulin)是作为细胞支架和运输系统的微管的组成部分。在一项具有里程碑意义的长达10年的研究中,来自美国能源部SLAC国家加速器实验室和斯坦福大学的研究人员揭示了一种名为TRiC的微小细胞机器如何指导微管蛋白的折叠。相关研究结果发表在2022年12月8日的Cell期刊上,论文标题为“Structural visualization of the tubulin folding pathway directed by human chaperonin TRiC/CCT”。

图片来自Cell, 2022, doi:10.1016/j.cell.2022.11.014。
这些作者用低温电镜以近原子分辨率捕捉到了TRiC引导的蛋白折叠过程中的四个不同步骤,并通过生物化学和生物物理分析证实了他们所看到的情况。
Frydman说,在最基本的层面上,这项研究解决了为什么微管蛋白在没有TRiC的帮助下不能折叠这一长期存在的谜团:“这确实在这个领域引发变革,最终带来了一种理解蛋白在人类细胞中如何折叠的新方法。”
TRiC腔室的独特之处在于,它由八个不同的亚基组成,形成两个堆叠的环。细长的微管蛋白链被一个形状像水母的辅助分子送入TRiC腔室的开口。然后TRiC腔室的盖子关闭,微管蛋白折叠开始。当这种折叠完成后,盖子打开,完成折叠的微管蛋白离开TRiC腔室。
由于没有TRiC,微管蛋白就不能折叠,因此TRiC似乎不仅仅是被动地帮助微管蛋白自发折叠。但这究竟是如何起作用的呢?这项新的研究回答了这个问题,并证明至少对于像微管蛋白这样的蛋白,“自发折叠”的概念并不适用。相反,TRiC直接协调折叠途径,导致正确形状的蛋白。
2.Cell:新研究揭示人类健康大脑衰老和认知障碍期间存在脑脊液免疫失调
doi:10.1016/j.cell.2022.11.019
你的三磅重的大脑之所以感觉不重,是因为它漂浮在一个脑脊液(CSF)库中,脑脊液在你的大脑和脊髓周围流动。大脑和头骨之间的这种液体屏障保护大脑免受头部撞击,并为大脑提供营养。但是,如果不太为人所知的话,脑脊液还有另一个关键的功能:它还为大脑提供免疫保护。然而,这一功能尚未得到充分研究。
在一项新的研究中,来自美国西北大学费恩柏格医学院的研究人员发现脑脊液在认知障碍(比如阿尔茨海默病)中的作用。这一发现为神经变性过程提供了新的线索。相关研究结果于2022年12月13日在线发表在Cell期刊上,论文标题为“Cerebrospinal fluid immune dysregulation during healthy brain aging and cognitive impairment”。论文通讯作者为西北大学费恩柏格医学院神经学助理教授David Gate博士。
这项研究发现,随着年龄的增长,人们的脑脊液免疫系统变得失调。该研究还发现,在患有认知障碍的人(如阿尔茨海默病患者)中,这种脑脊液免疫系统与健康人截然不同。
Gate说,“我们如今可以了解这种大脑免疫系统与健康衰老和神经退化的关系。这种免疫库(即脑脊液库)可能用于治疗大脑炎症,或用作诊断来确定痴呆患者的大脑炎症水平。我们对健康和患病大脑的这一重要免疫库进行了全面分析。”他的团队正在公开分享他们的数据,其结果可以在网上搜索。
doi:10.1016/j.cell.2022.11.005
在一项新的研究中,来自英国韦尔科姆基金会桑格研究所、欧洲分子生物学实验室欧洲生物信息学研究所(EMBL-EBI)和剑桥大学格登研究所等研究机构的研究人员史无前例地绘制了发育中的人类肺部的细胞图谱,确定了生命早期的144种细胞状态,并揭示了发育细胞和肺癌之间的新联系。他们一次一个细胞地研究哪些基因在肺部发育的不同阶段被激活。他们通过结合空间技术,精确地确定了细胞在发育中肺部的位置,从而构建出发育肺细胞图谱(Developmental Lung Cell Atlas),显示了这种呼吸系统是如何形成的。相关研究结果发表在2022年12月8日的Cell期刊上,论文标题为“A human fetal lung cell atlas uncovers proximal-distal gradients of differentiation and key regulators of epithelial fates”。
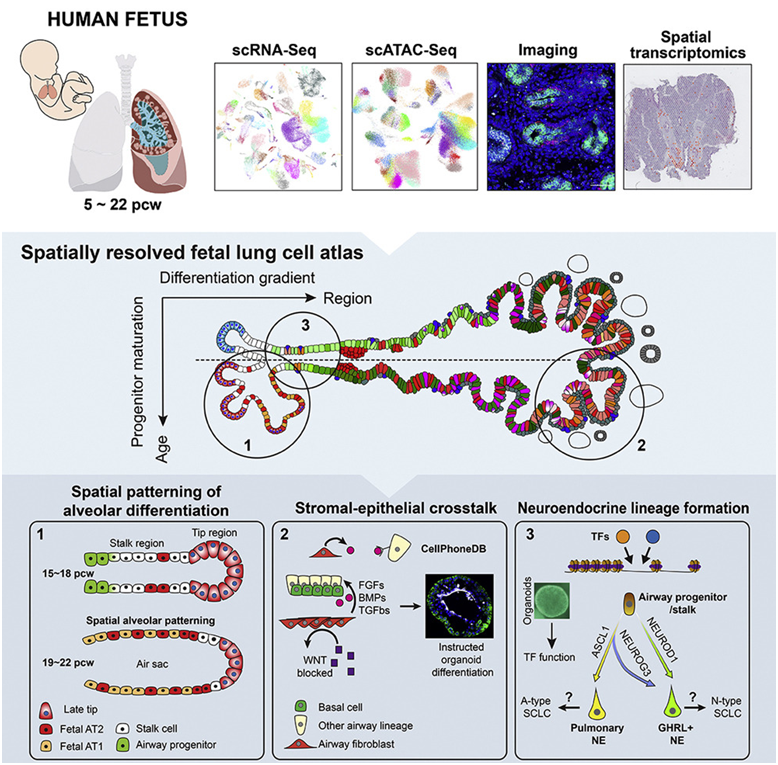
图片来自Cell, 2022, doi:10.1016/j.cell.2022.11.005。
为了构建这种发育肺细胞图谱,这些作者将早期细胞的单细胞测序与空间技术相结合,构建出一种深入的肺部发育数据集。这个公开的资源描述了哪些细胞类型存在于发育中的肺部结构中,以及这些细胞是如何受到调节的。
这些作者确定了144种细胞类型,如中间细胞类型和过渡细胞类型,包括一种可能与在生命后期出现的人类小细胞肺癌有关的细胞亚型。
他们利用这种细胞图谱对肺细胞如何发育进行了预测,特别是哪些基因是驱动这一过程的关键角色。他们随后使用类器官模型来验证新出现的假设,证实该细胞图谱可用于准确预测组织发育所涉及的阶段和细胞。
4. Cell:在数千种病毒中发现CRISPR-Cas系统,有望改善细胞基因组编辑
doi:10.1016/j.cell.2022.10.020
对病毒基因组的系统性扫描揭示了大量潜在的基于CRISPR的基因组编辑工具。CRISPR-Cas系统在细菌和古生菌的微生物世界中很常见,它们经常帮助它们的宿主细胞抵御病毒。但是,在一项新的研究中,来自美国加州大学洛杉矶分校的研究人员发现在公开的可感染这些微生物的病毒(称为噬菌体)的基因组序列中,CRISPR-Cas系统占0.4%。他们认为,这些病毒利用CRISPR-Cas彼此竞争---而且有可能也是为了操纵宿主的基因活性,使之对自己有利。相关研究结果发表在2022年11月23日的Cell期刊上,论文标题为“Diverse virus-encoded CRISPR-Cas systems include streamlined genome editors”。
在这项新的研究中,加州大学伯克利分校的分子生物学家Jennifer Doudna和微生物学家Jillian Banfield及其同事们决定在感染细菌和古生菌的病毒(即噬菌体)中更全面地寻找CRISPR-Cas系统。令他们吃惊的是,他们发现了大约6000种编码CRISPR-Cas系统的噬菌体,包括每一种已知类型的CRISPR-Cas系统的代表。Doudna说,“有证据表明,这些CRISPR-Cas系统是对噬菌体有用的系统。”
这些作者发现了在通常的CRISPR-Cas结构上存在着广泛的变异,一些CRISPR-Cas系统缺少组分,另一些CRISPR-Cas则异常紧凑。在法国国家科学研究中心研究噬菌体生态学和进化的Anne Chevallereau说,“即使噬菌体编码的CRISPR-Cas系统是罕见的,它们也是高度多样化和广泛分布的。大自然充满了惊喜。”
5. Cell:我国科学家揭示吃了受感染食物后呕吐的神经通路
doi:10.1016/j.cell.2022.10.001
吃了被污染的食物后有呕吐的冲动是身体摆脱细菌毒素的自然防御反应。然而,我们的大脑在检测到病菌后如何启动这一生物反应的过程仍然难以捉摸。在一项新的研究中,来自中国北京生命科学研究所、清华大学、广州医科大学、中国科学技术大学、首都医科大学和复旦大学的研究人员首次绘制了小鼠从肠道到大脑的防御反应的详细神经通路。这一发现可能有助于科学家们为接受化疗的癌症患者开发更好的抗恶心药物。相关研究结果发表在2022年11月10日的Cell期刊上,论文标题为“The gut-to-brain axis for toxin-induced defensive responses”。
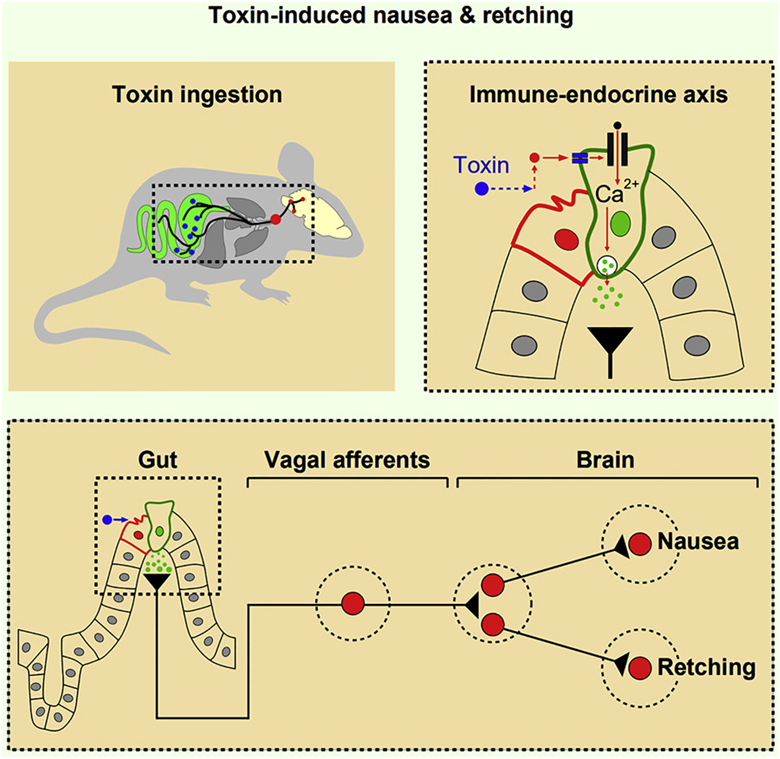
图片来自Cell, 2022, doi:10.1016/j.cell.2022.10.001。
论文共同通讯作者、北京生命科学研究所的Peng Cao博士和他的团队注意到,虽然小鼠不会呕吐,但它们会干呕---这意味着它们也会有呕吐的冲动,但不会吐出来。该团队发现,在接受了葡萄球菌肠毒素A(Staphylococcal enterotoxin A, SEA)后,小鼠出现了不正常的张嘴现象,其中SEA是一种由金黄色葡萄球菌产生的常见细菌毒素,也会在人类身上导致食源性疾病。
接受SEA的小鼠张嘴的角度比在对照组小鼠观察到的要宽,因为对照组小鼠接受的是盐水。此外,在张嘴期间,接受SEA处理的小鼠的隔膜肌肉和腹部肌肉同时收缩,这是在狗呕吐时观察到的模式。在正常呼吸期间,动物的隔膜肌肉和腹部肌肉会交替收缩。
Cao说,“干呕的神经机制与呕吐的神经机制相似。在这个实验中,我们成功地建立了一种研究毒素引起的小鼠干呕的模式,通过这种模式,我们可以在分子和细胞水平上研究大脑对毒素的防御反应。”
6. Cell:存在30年的谜团终于解决!揭示WNK利用相分离让遭受应激的细胞恢复自身体积机制
doi:10.1016/j.cell.2022.09.042
在一项新的研究中,来自美国匹兹堡大学和卡耐基梅隆大学的研究人员在显微镜下拍摄了遭受应激的细胞的迷幻影片,这让他们踏上了解决一个谜团的旅程:细胞如何控制自身体积。他们的研究解释了科学家们如何利用一点偶然发现将30年前首次提出的这个谜团中的点连接起来。相关研究结果于2022年10月31日在线发表在Cell期刊上,论文标题为“WNK kinases sense molecular crowding and rescue cell volume via phase separation”。
论文共同第一作者、卡内基梅隆大学博士后研究员Daniel Shiwarski博士和他的妻子、论文共同第一作者Cary Boyd-Shiwarski博士描述如何将一个偶然的实验变成一个意外的发现时说道,“我们当时正在做与这项研究无关的活体荧光成像实验,当我们在细胞中加入盐溶液时,细胞质内部的物质迅速变成了荧光熔岩灯(lava lamp)。
当细胞突然暴露在外部应激源下,如高浓度的盐或糖,它们的体积会减少。在20世纪90年代初,科学家们提出,细胞通过某种方式监测它的蛋白浓度或者说细胞内的“拥挤程度”来恢复它的体积。但是他们不知道细胞如何感觉到过度拥挤。然后,在21世纪初,人们发现了一类叫做With-No-Lysine激酶(With-No-Lysine kinase, WNK)。多年来,科学家们猜测WNK可逆转细胞萎缩,但它们如何做到这一点也是一个谜。
这项新的研究解决了这两个难题,揭示了WNK激酶如何激活一种“开关”,从而让细胞体积通过一种称为相分离(phase separation)的过程恢复平衡。论文通讯作者、匹兹堡大学医学院肾脏电解质科副教授Arohan R. Subramanya博士说,“细胞内部含有细胞质,通常人们认为细胞质是扩散的,在细胞质中多种分子漂浮在一种完美的混合溶液中。但是在我们对细胞质如何发挥作用的思考中发生了这种显著的改变。它真地就像一种乳剂,含有一堆小的、微小的蛋白团和液滴,然后当诸如过度拥挤之类的应激发生时,它们会聚集成大的液滴,通过可以用显微镜看到。”
这些液体状的液滴就是Shiwarski和Boyd-Shiwarski在那个决定性的日子里看到的“熔岩灯”,当时他们在实验室里向细胞中添加一种盐溶液。他们对WNK1进行了荧光标记,使它们扩散到整个细胞质上,导致整个细胞发光。当加入这种盐溶液时,WNK1聚集在一起,形成巨大的霓虹绿色小球,像熔岩灯中的粘液一样在细胞中渗出。他们将他们所看到的描述为相分离,也就是当WNK1与激活细胞中的盐分转运体SLC12的分子一起凝结成液滴。这一步骤允许细胞同时输入离子和水,使细胞的体积在几秒钟内恢复到原始状态。
7. Cell:疼痛并非坏事!肠道中的疼痛神经元在肠道炎症期间促进肠道杯状细胞释放更多的保护性粘液
doi:10.1016/j.cell.2022.09.024
长期以来,人们一直认为疼痛是进化过程中最可靠的工具之一,它可以检测到伤害的存在,并发出身体出现毛病的信号---这是一种警报系统,告诉我们暂停并注意我们自己的身体。但是,但如果疼痛不仅仅是一个警钟?如果疼痛本身就是一种保护呢?
在一项新的研究中,来自美国哈佛医学院、芝加哥大学和瑞典哥德堡大学的研究人员指出在小鼠中,情况可能就是这样。他们发现小鼠肠道中的疼痛神经元---伤害感受神经元(nociceptor neuron)---在正常情况下调节保护性粘液的存在,并在炎症状态下刺激肠道细胞释放更多粘液。相关研究结果于2022年10月14日在线发表在Cell期刊上,论文标题为“Nociceptor neurons direct goblet cells via a CGRP-RAMP1 axis to drive mucus production and gut barrier protection”。

图片来自Cell, 2022, doi:10.1016/j.cell.2022.09.024。
这项新的研究详细说明了一个复杂的信号级联反应的步骤,显示疼痛神经元与含有粘液的肠道细胞---称为杯状细胞(goblet cell)---进行了直接交谈。论文通讯作者、哈佛医学院布拉瓦特尼克研究所免疫生物学副教授Isaac Chiu说,“事实证明,疼痛可能以更直接的方式保护我们,而不是用传统的方式检测潜在的伤害并向大脑发送信号。我们的研究显示了肠道中介导疼痛的神经元如何与附近的肠道上皮细胞对话。这意味着神经系统在肠道中的主要作用不仅仅是给我们带来不愉快的感觉,它是肠道屏障维护的关键角色,也是炎症期间的一种保护机制。”
8. Cell:重大进展!首次构建出首个泛癌真菌微生物组图谱
doi:10.1016/j.cell.2022.09.005
在一项新的研究中,来自美国加州大学圣地亚哥分校和以色列魏茨曼科学研究所等研究机构的研究人员通过调查35种癌症及其相关真菌,构建出首个泛癌真菌微生物组图谱(pan-cancer mycobiome atlas)。相关研究结果发表在2022年9月29日的Cell期刊上,论文标题为“Pan-cancer analyses reveal cancer-type-specific fungal ecologies and bacteriome interactions”。
这项新的研究在来自四个独立队列的35种癌症的17,401份患者组织、血液和血浆样本中表征癌症真菌微生物组--与癌症有关的真菌。这些作者在许多主要的人类癌症中发现真菌DNA和细胞的丰度很低,群落组成的差异在不同的癌症类型中有所不同。
论文共同通讯作者、魏茨曼科学研究所的Ravid Straussman博士说,“真菌普遍存在于人类肿瘤中,这一发现应促使我们更好地探索它们的潜在影响,并通过‘微生物组视角’重新审视我们对癌症的几乎所有认识。”
将真菌群落与相匹配的细菌组(微生物组的细菌部分)和免疫组(构成免疫系统的基因和蛋白)进行比较的分析显示,它们之间的关联性往往是“宽容的”,而不是竞争的。比如,发现一种真菌物种在50岁以上患者的乳腺癌肿瘤中富集,而另一种真菌物种在肺癌样本中明显大量存在。
这些作者说,特定的真菌与年龄、肿瘤亚型、吸烟状态、对免疫疗法的反应和生存措施之间存在着明显的关联性。这些真菌是简单的相关还是有因果关系,还有待确定。
9. Cell:新研究成功构建出一种由100多种细菌物种组成的合成肠道微生物组,有望开发出微生物组疗法治疗一系列疾病
doi:10.1016/j.cell.2022.08.003
过去十年的关键研究已表明肠道微生物组,即生活在人类消化系统中的成百上千种细菌的集合,影响着神经发育、对癌症免疫疗法的反应以及健康的其他方面。但这些群体是复杂的,如果没有系统的方法来研究其成分,与某些疾病有关的确切细胞和分子仍然是一个谜。
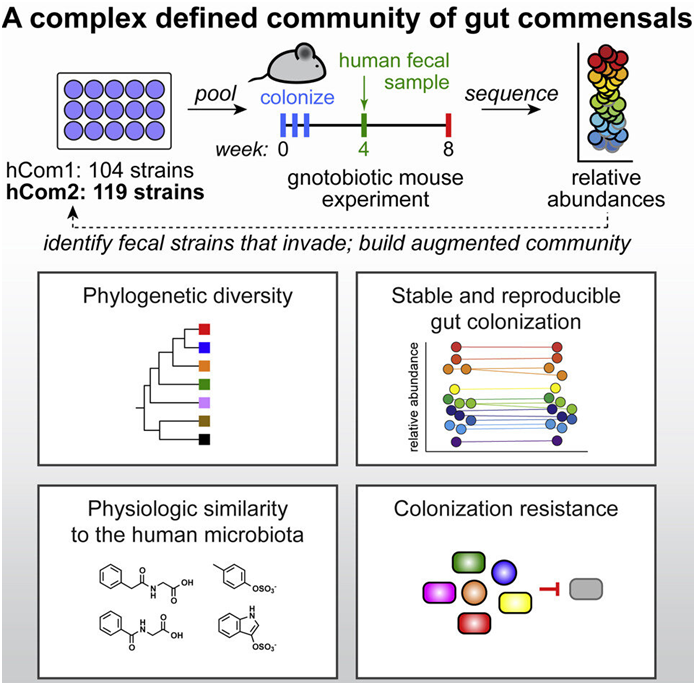
图片来自Cell, 2022, doi:10.1016/j.cell.2022.08.003。
在一项新的研究中,来自美国斯坦福大学的研究人员建立了最复杂和明确定义的合成微生物组(synthetic microbiome),构建出一种由100多种细菌物种组成的细菌群落,并成功将地它们移植到小鼠体内。添加、移除和编辑单个细菌物种的能力将使科学家们更好地了解微生物组与健康之间的联系,并最终开发出一流的微生物组疗法。相关研究结果于2022年9月6日在线发表在Cell期刊上,论文标题为“Design, construction, and in vivo augmentation of a complex gut microbiome”。
论文共同通讯作者、斯坦福大学的Michael Fischbach设想,这种从头开始构建微生物组的方法将在未来使基于微生物组的工程疗法成为可能。作为斯坦福大学微生物组治疗计划(Microbiome Therapies Initiative, MITI)的负责人,他的目标是构建有朝一日可以移植到人体内以治疗或预防多种疾病的工程化细菌群落。
10. Cell:重大进展!发现神经元存在一种新的突触---轴突-纤毛突触
doi:10.1016/j.cell.2022.07.026
在一项新的研究中,来自美国霍华德-休斯医学研究所珍妮莉亚研究园区的研究人员在神经元表面的初级纤毛(primary cilia)中发现了一种新的突触。相关研究结果发表在2022年9月1日的Cell期刊上,论文标题为“A serotonergic axon-cilium synapse drives nuclear signaling to alter chromatin accessibility”。
这些作者利用聚焦离子束扫描电子显微镜(focused ion beam-scanning electron microscopy, FIB-SEM),对纤毛进行了很好的观察。这种高功率显微镜让他们看到在神经元的轴突和突出于胞体(cell body)外的纤毛之间存在着一种称为突触的连接。这些连接的结构特征类似于在已知的突触中发现的结构特征,因此他们将这些连接称为“轴突-纤毛(axon-cilium, 也称为axo-ciliary )”突触。
他们能够逐步展示神经递质血清素(serotonin,也称为5-羟色胺)是如何从轴突释放到纤毛上的受体上。这引发了信号级联反应,打开了染色质结构,并允许细胞核中的基因组发生变化。Sheu说,“功能使静态结构发生变化。一旦我们对结构发现有了信心,我们就会深入研究它的功能特性。”
11. Cell:重大进展!揭示抑制SP140表达有望治疗克罗恩病
doi:10.1016/j.cell.2022.06.048
一种称为斑点蛋白140(Speckled Protein 140, SP140)的染色质读取蛋白中的突变与包括克罗恩病(一类炎症性肠病)在内的某些免疫性疾病的风险增加有关。在一项新的研究中,来自美国麻省总医院(MGH)和哈佛医学院等研究机构的研究人员为这种联系背后的机制提供了新的见解,指出了潜在的治疗靶标。相关研究结果发表在2022年8月18日的Cell期刊上,论文标题为“Epigenetic reader SP140 loss of function drives Crohn’s disease due to uncontrolled macrophage topoisomerases”。
SP140的表达独特地局限于免疫细胞,如巨噬细胞。巨噬细胞包围并杀死微生物,清除死亡细胞,并刺激其他免疫细胞的行动。论文通讯作者、MGH免疫学首席研究员、哈佛医学院医学副教授Kate L. Jeffrey博士和她的同事们进行的蛋白分析显示,SP140抑制拓扑异构酶(TOP),这些酶在复制过程中协助DNA解链。
他们还发现,在人类和小鼠中,SP140的缺失导致了TOP活性的释放,最终导致了巨噬细胞基因表达出现缺陷和巨噬细胞对细菌的杀伤也出现缺陷,从而造成了肠道的异常。抑制TOP可以拯救具有克罗恩病炎症特征的小鼠的这些缺陷。目前,克罗恩病仍然无法通过手术或治疗性干预得到治愈。
12. Cell:我国科学家揭示光线促进哺乳动物早期大脑发育的神经机制
doi:10.1016/j.cell.2022.07.009
感觉输入,包括来自环境的视觉、听觉和躯体感觉输入,在婴儿大脑发育中起着关键作用。视觉(光线)是哺乳动物最重要的感知,已被确定为促进大脑多个区域的突触发生,这是大脑发育的标志之一。然而,调节这一现象的神经机制以及对认知和学习能力的终生影响仍然是未知的。
在一项新的研究中,来自中国科学技术大学、中国科学院、第三军医大学、上海科技大学和合肥海关技术中心的研究人员确定了光促进哺乳动物早期大脑发育的神经机制和终生影响。相关研究结果于2022年8月8日在线发表在Cell期刊上,论文标题为“Melanopsin retinal ganglion cells mediate light-promoted brain development”。论文通讯作者为中国科学技术大学生命科学与医学部的薛天(Xue Tian)教授和鲍进(Bao Jin)研究员。
视觉感知从视网膜开始。哺乳动物的视网膜上有三类主要的感光细胞:视杆细胞、视锥细胞和内在光敏性视网膜神经节细胞(intrinsically photosensitive retinal ganglion cell, ipRGC)。与介导视觉图像编码的经典感光细胞---视杆细胞和视锥细胞---不同,ipRGC通过基因Opn4编码的黑视蛋白(melanopsin)被蓝光特异性激活,主要介导非成像视觉(non-imaging visual, NIV)功能,如生物钟的光诱导作用、瞳孔光线反射和情绪调节。在发育过程中,ipRGC对光线的反应要比视杆细胞和视锥细胞早得多,并在哺乳动物中介导最早的光线感知,这表明ipRGC可能在光促进大脑发育方面发挥了作用。
在这项新的研究中,这些作者首先发现,与对照组幼鼠(Opn4+/+)相比,缺乏ipRGC光敏感性的新生小鼠(Opn4-/-)在多个感觉皮层和海马体中的迷你兴奋性突触后电流(mini-excitatory postsynaptic current, mEPSC)频率和锥体神经元树突棘数量减少,而这些突触发生的缺乏在另一组从出生就在黑暗中饲养的实验性小鼠中观察到。此外,通过在Opn4-/-新生小鼠的ipRGC中重新表达黑视蛋白,大脑皮层和海马体中的突触发生明显增强。这一结果显示,通过ipRGC的光线感知介导了新生小鼠在大脑早期发育中的光促进的大脑突触发生。
通过质谱分析,这些作者进一步确定了神经肽催产素(oxytocin)是ipRGC介导的光促进皮层和海马体中突触发生的信号分子。他们证实了ipRGC投射到视上核(supraoptic nucleus, SON),并显示视网膜神经节细胞与幼鼠中的视上核和室旁核(paraventricular nucleus, PVN)的催产素能神经元(即表达催产素的神经元)相连接。在ipRGC介导的光线感知的作用下,这种投射导致视上核和室旁核中的催产素能神经元激活,增加了脑脊液中催产素的浓度,从而促进了突触发生。
13. Cell:重大突破!首次不使用精子和卵子构建出合成胚胎
doi:10.1016/j.cell.2022.07.028
在一项新的研究中,来自以色列魏茨曼科学研究所和布鲁斯-拉帕波特医学院的研究人员首次在不使用精子、卵子或受精的情况下构建出“合成胚胎(synthetic embryo)”,但使用这种技术培育用于移植的人体器官的前景仍然很遥远。具体而言,他们找到了一种方法,让小鼠干细胞在实验室中自我组装成胚胎状结构。这一突破被誉为向前迈进了一大步,尽管一些专家说,所构建出的合成胚胎可能不能完全被视为胚胎,并警告说要考虑未来的伦理问题。相关研究结果于2022年8月1日在线发表在Cell期刊上,论文标题为“Post-Gastrulation Synthetic Embryos Generated Ex Utero from Mouse Naïve ESCs”。
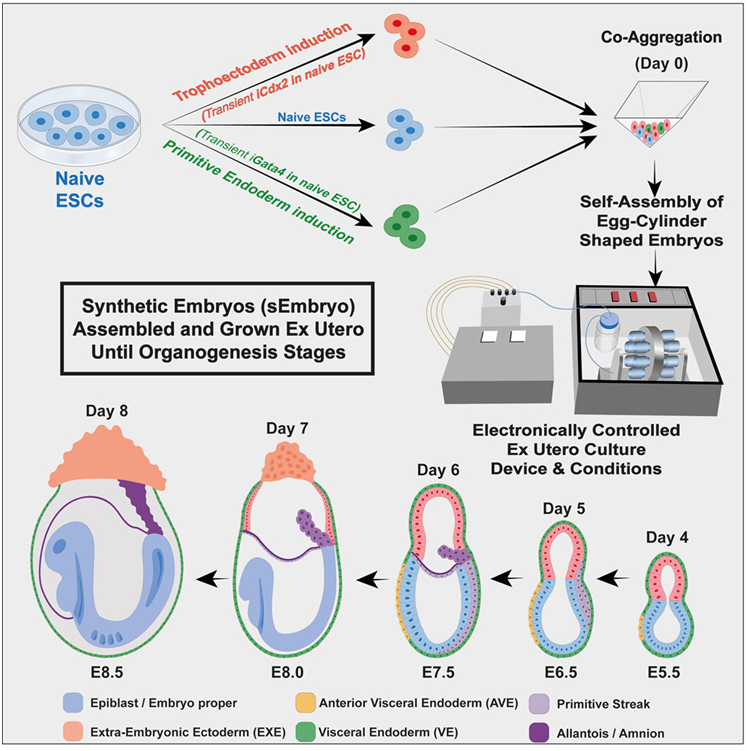
图片来自Cell, 2022, doi:10.1016/j.cell.2022.07.028。
这些作者首先收集来自小鼠皮肤的细胞,然后让它们返回到干细胞状态。所产生的干细胞被放置在他们设计的一种不断移动以模拟母体子宫的特殊孵化器中。然而,这些干细胞中的绝大数未能形成任何东西。不过,在总共10000个干细胞中,有50个细胞(占0.5%)将自我收集成球体,然后形成胚胎状结构,即合成胚胎。他们补充说,8天后---大约是20天小鼠妊娠期的三分之一---出现了大脑和心脏跳动的早期迹象。这些合成胚胎被描述为与正常小鼠胚胎有95%的相似度。
14. Cell:浙大科学家揭示昆虫通过基因水平转移借用微生物的1000多个基因,促进它们存活
doi:10.1016/j.cell.2022.06.014
数亿年前,微生物和植物可能通过基因水平转移(horizontal gene transfer, HGT)将基因传递给昆虫,从而使昆虫获得了进化优势。在一项新的研究中,来自中国浙江大学和美国范德堡大学的研究人员指出,包括蝴蝶和飞蛾在内的218种昆虫的1400多个基因源自细菌、病毒、真菌和植物。这项新研究认为,这些基因可能对昆虫的进化至关重要,使它们在交配行为、营养、生长和适应环境变化方面发展出有益的特性。
相关研究结果发表于2022年7月18日在线发表在Cell期刊上,论文标题为“HGT is widespread in insects and contributes to male courtship in lepidopterans”。论文通讯作者为浙江大学的Jianhua Huang、Xing-Xing Shen和范德堡大学的Antonis Rokas。论文第一作者为浙江大学的Yang Li、Zhiguo Liu和Chao Liu。
15. Cell:重大进展!揭示TMEM175和V-ATP酶携手调节溶酶体酸度以及TMEM175发生突变时为何增加帕金森病风险
doi:10.1016/j.cell.2022.05.021
在一项新的研究中,来自密歇根大学的研究人员指出在大约五分之一的帕金森病病例中,要把溶酶体中的一种小的、功能失常的蛋白作为风险因素。相关研究结果发表在2022年6月23日的Cell期刊上,论文标题为“Parkinson’s disease-risk protein TMEM175 is a proton-activated proton channel in lysosomes”。
溶酶体是细胞的垃圾收集器。这些细胞器负责分解细胞中的“垃圾”---错误折叠的蛋白、磨损的细胞器。细胞在一种称为自噬的过程中收集这些垃圾。自噬密切依赖于溶酶体的功能,当溶酶体发生故障,这一过程被破坏,导致细胞碎片堆积,就会发生各种疾病。其中许多是退行性疾病,如阿尔茨海默病、杜兴氏肌肉营养不良症和泰勒-萨克斯病(Tay-Sachs disease)。
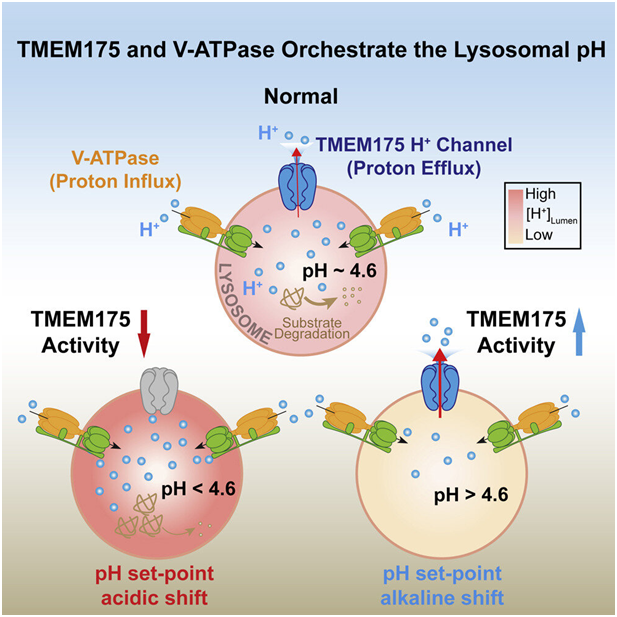
图片来自Cell, 2022, doi:10.1016/j.cell.2022.05.021。
在这项新的研究中,这些作者发现了一种名为TMEM175的突变蛋白如何在大约20%的帕金森病病例中充当风险因素。在帕金森病中,控制运动的大脑区域中的神经细胞开始失效和死亡。据美国国家老龄化研究所的说法,科学家们认为帕金森病是遗传和环境因素共同作用的结果。
这些作者发现,如果发生突变,TMEM175不能正确地调节溶酶体内环境的酸度。如果该环境的酸度不正确,溶酶体内的酶就会停止有效工作,这种细胞器就不能正确发挥其作用。
16. Cell:揭示胸腺上皮细胞通过模拟身体各种组织的身份让未成熟的T细胞学会区分敌我
doi:10.1016/j.cell.2022.05.018
人类的免疫系统是一个几乎完美的防御机制。它保护身体免受致病细菌、病毒和其他病原体的侵害。它能检测到新生的肿瘤并将其消灭。它清理受伤或感染部位的细胞碎片。为了履行这些功能,免疫系统首先必须区分自我和非自我---一种非凡的选择能力,使它能够检测和破坏有害物,同时保护人体自身组织。如果免疫系统不能做出这种区分,它就会错误地对身体发起攻击,造成自身免疫性疾病。科学家们知道这种选择能力的一般原理已经有一段时间了,但免疫细胞究竟是如何学习区分敌我的,却一直不太了解。
如今,在一项新的研究中,来自美国哈佛医学院、日本庆应义塾大学和和歌山医科大学的研究人员确定了一个新的机制,解释了身体最强大的免疫部队---T细胞---是如何区分自我和非自我的。这项新的研究主要主要在小鼠身上进行。相关研究结果于2022年6月16日在线发表在Cell期刊上,论文标题为“Thymic epithelial cells co-opt lineage-defining transcription factors to eliminate autoreactive T cells”。
这项新的研究显示作为产生和训练T细胞(一类免疫细胞)的器官,胸腺通过让新生的免疫细胞接触胸腺上皮细胞制造的蛋白,模拟整个身体的各种组织来教育它们。具体而言,该研究表明,通过呈现不同的身份,这些专门的胸腺上皮细胞为成熟的T细胞预演了它们一旦离开胸腺将会遇到的自我蛋白。
17. Cell:揭示抑制PAAN核酸酶可预防帕金森病中的神经退化
doi:10.1016/j.cell.2022.04.020
在一项新的针对小鼠的研究中,来自约翰霍普金斯大学医学部的研究人员发现一种化合物可以阻止与帕金森病中脑细胞死亡有关的通路中的最后事件。他们说,这一实验结果可能推动一种药物的开发,这种药物可以安全在人体中使同一通路短路,并防止帕金森病、中风和其他神经退行性疾病特有的破坏性影响。相关研究结果发表在2022年5月26日的Cell期刊上,论文标题为“PAAN/MIF nuclease inhibition prevents neurodegeneration in Parkinson’s disease”。
帕金森病的特点是错误折叠的α-突触核蛋白(alpha synuclein)在负责产生一种叫做多巴胺的神经递质的脑细胞中堆积起来。随着更多错误折叠的蛋白聚集在一起,它们通过Dawson和其他约翰霍普金斯大学研究人员确定的所谓“程序化”细胞死亡过程杀死脑细胞。这一过程被称为PARP-1依赖性细胞死亡(parthanatos),可导致运动、情绪调节和思维方面的障碍。
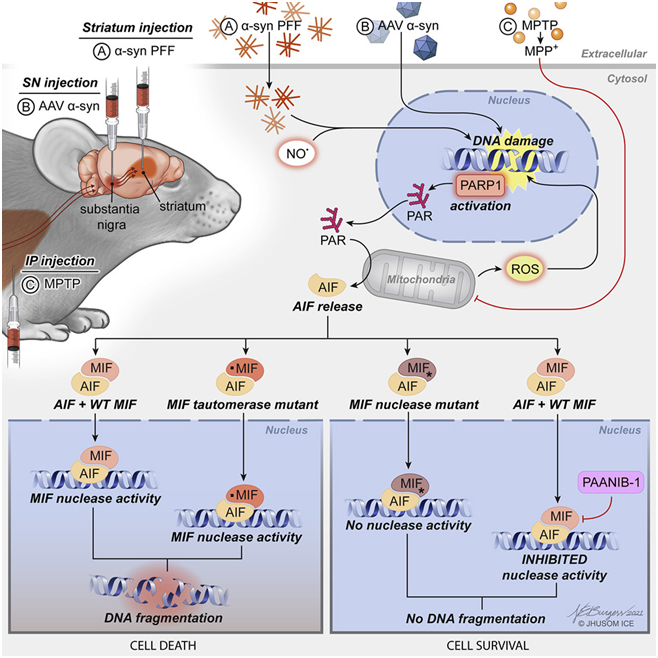
Dawson领导的先前研究已表明一种称为parthanatos相关凋亡诱导因子核酸酶(parthanatos associated apoptosis-inducing factor nuclease, PAAN)的蛋白对受α-突触核蛋白聚集物影响的脑细胞进行最后打击,破坏细胞的DNA。除了帕金森病之外,PAAN蛋白还与中风中的细胞死亡有关。然而,PAAN在大脑中有多种功能,包括在免疫系统中的活性,这些活性需要维持以保持大脑的健康。
利用对PAAN分子结构的了解,这些作者在约翰霍普金斯大学药物文库中筛选了数千种已知的化学物,以寻找那些能特异性阻止PAAN分解DNA分子的化学物。他们通过在这些化学品存在的情况下将一系列的DNA链暴露于PAAN中来完成这一工作。如果加入一种化学物后DNA保持完整,那么他们就认为它有可能阻止PAAN对DNA的破坏。他们在这些测试中发现了一种能阻断PAAN而不影响其他重要PAAN活性的化学物,并将它命名为PAANIB-1(PAAN inhibitor 1,即PAAN抑制剂1)。
18. Cell:更为紧凑的靶向RNA的基因编辑工具Cas7-11S问世,有望基于此开发出新型RNA基因疗法
doi:10.1016/j.cell.2022.05.003
去年,来自麻省理工学院麦戈文脑科研究所的研究人员发现了III-E型CRISPR-Cas效应蛋白Cas7-11并表征了它的特征,它是第一种能够对RNA链进行精确、有指导性的切割而在此过程中不伤害细胞的CRISPR 酶(Nature, 2021, doi:10.1038/s41586-021-03886-5)。如今,在一项新的研究中,他们与东京大学的合作者合作,发现Cas7-11可以缩小到一个更紧凑的版本,使其成为编辑活细胞内RNA的一种更可行的选择。他们描述了这种新的、紧凑的Cas7-11,同时还对原始的Cas7-11进行了详细的结构分析。
相关研究结果于2022年5月27日在线发表在Cell期刊上,论文标题为“Structure and engineering of the type III-E CRISPR-Cas7-11 effector complex”。论文通讯作者为麦戈文脑科研究所研究员Omar Abudayyeh、麦戈文脑科研究所研究员Jonathan Gootenberg和东京大学研究员Hiroshi Nishimasu。论文第一作者为麦戈文脑科研究所前博士后Nathan Zhou和东京大学的Kazuki Kato。
Abudayyeh说,“当我们观察这种结构时,很明显有一些不需要的部分,我们实际上可以去除这些部分。这使得这种酶足够小,以至于可以将它装入在单一的病毒载体中进行治疗应用。”
这些作者认为Cas7-11的新三维结构是一种丰富的资源,可以回答有关这种酶的基本生物学问题,并揭示未来调整它的功能的其他方法。
19. Cell:揭示非编码7S RNA调节人类线粒体中基因表达机制
doi:10.1016/j.cell.2022.05.006
在一项新的研究中,来自瑞典哥德堡大学、卡罗林斯卡学院和德国科隆大学的研究人员发现一种非编码RNA分子调节着人类细胞中的线粒体基因表达。相关研究结果于2022年6月2日在线发表在Cell期刊上,论文标题为“Non-coding 7S RNA inhibits transcription via mitochondrial RNA polymerase dimerization”。论文通讯作者为哥德堡大学教授Maria Falkenberg和卡罗林斯卡医学院的B. Martin Hällberg。论文第一作者为哥德堡大学的Xuefeng Zhu和Xie Xie以及卡罗林斯卡学院的Hrishikesh Das。
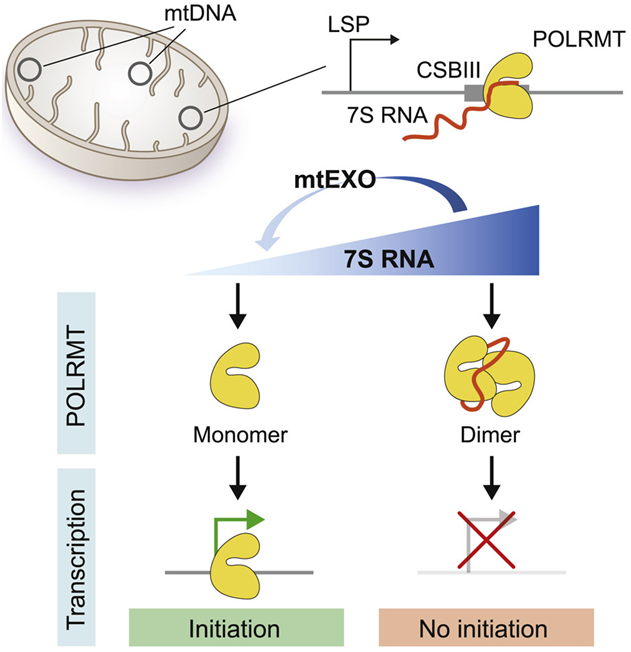
图片来自Cell, 2022, doi:10.1016/j.cell.2022.05.006。
人类线粒体7S RNA属于哺乳动物正常发育所必需的一个较大的非编码RNA分子家族。以前人们知道,线粒体7S RNA的水平根据真核细胞的代谢需要而变化,但这些变化的分子基础和功能影响尚不清楚。在这项新的研究中,这些作者开发出研究7S RNA对纯化的蛋白和细胞中线粒体基因活动的影响的方法。
这些作者发现7S RNA具有调节功能,因为它在体外和培养的人类细胞中控制线粒体的转录水平。通过使用低温电镜(cryo-EM)技术,他们发现线粒体RNA聚合酶POLRMT通过与7S RNA相互作用发生二聚化。由此产生的POLRMT二聚体界面封存了启动子识别和线粒体DNA解链所需的结构域,从而阻止了线粒体DNA转录启动。他们提出,非编码7S RNA分子是调节哺乳动物细胞线粒体转录的负反馈回路的一个组成部分。
20. Cell:重磅!下一代癌症免疫疗法即将问世!开发出远程控制的CAR-T细胞,有望更安全更有效地治疗实体瘤
doi:10.1016/j.cell.2022.03.041
在一项新的针对小鼠的研究中,来自斯坦福大学医学院的研究人员发现一种利用患者自身的经过基因修饰的免疫细胞来攻击癌细胞的癌症治疗方法,当可以通过口服药物进行开启和关闭时,会更安全和更有效。相关研究结果发表在2022年5月12日的Cell期刊上,论文标题为“Enhanced safety and efficacy of protease-regulated CAR-T cell receptors”。
这种称为CAR-T细胞疗法的癌症治疗方法对某些类型的血癌有明显的效果。但是,由于一些患者对这些经过基因改造的T细胞(一种免疫细胞)出现了威胁生命的免疫反应,CAR-T疗法通常只在其他治疗方法被尝试过后才使用。它在实体瘤患者中也不太成功,如脑癌和骨癌患者。科学家们认为,这是因为容易发出过度信号的CAR-T细胞在能够消除实肿瘤之前就已经经历功能衰竭。此外,与血癌不同的是,很难在实体瘤上确定只在癌细胞表面上而不是在正常组织中发现的分子靶标。
这些作者设计出一种经过基因修饰的CAR-T细胞疗法---称为SNIP CAR-T,它可用一种已经被美国食品药品管理局(FDA)批准用于人体的抗肝炎口服药物激活。如果没有这种药物,SNIP CAR-T细胞就没有活性。
在CAR-T细胞被输注回患者体内后,用药物控制它们的活性的能力为那些可能对经过基因改造的T细胞反应不佳的患者提供了一种安全机制。这些作者发现还发现,这些经过基因修饰后的CAR-T细胞在治疗实验室小鼠的实体瘤方面明显更有效---可能是因为当这种日常药物在小鼠体内代谢时,CAR-T细胞经历了短暂、反复的休息期。
论文通讯作者、斯坦福大学儿科教授Crystal Mackall博士说,“我们构建出一种‘远程控制’的CAR-T细胞疗法,可针对每名患者进行调整。这些经过基因修饰的CAR-T细胞不仅更安全,而且比原来的CAR-T细胞更有效力,用途更广。这是一种相当复杂的系统。”
21. Cell:重大进展!新型线粒体碱基编辑器成功开发!线粒体基因组编辑的新时代来临
doi:10.1016/j.cell.2022.03.039
在一项新的研究中,来自韩国基础科学研究所(IBS)基因组工程中心的研究人员开发出一种新的基因编辑平台,称为转录激活因子样效应物相关脱氢酶(transcription activator-like effector-linked deaminase, TALED)。TALED是能够在线粒体中进行A→G碱基转换的碱基编辑器。这一发现是几十年来治疗人类遗传疾病的一个高潮,而且TALED可以被认为是基因编辑技术中最后一块缺失的拼图。相关研究结果于2022年4月25日在线发表在Cell期刊上,论文标题为“Targeted A-to-G base editing in human mitochondrial DNA with programmable deaminases”。
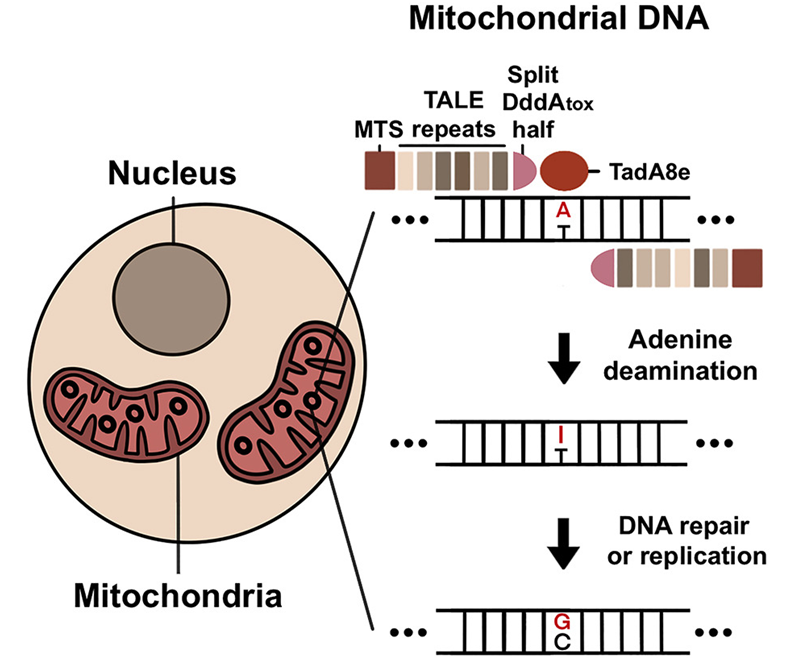
图片来自Cell, 2022, doi:10.1016/j.cell.2022.03.039。
这些作者通过将三个不同的组件融合在一起构建出TALED。第一个组件是转录激活因子样效应物(TALE),它能够靶向DNA序列。第二个组件是TadA8e,它是一种促进A→G转换的腺嘌呤脱氨酶。第三个组件是DddAtox,它是一种胞嘧啶脱氨酶,使DNA更容易被TadA8e访问。
TALED的一个有趣的方面是TadA8e有能力在拥有双链DNA(dsDNA)的线粒体中进行A→G编辑。这是一个神秘的现象,因为TadA8e是一种已知只对单链DNA(ssDNA)具有特异性的蛋白。Kim说,“以前没有人想到用TadA8e在线粒体中进行碱基编辑,因为它应当只对单链DNA具有特异性。正是这种跳出框框的思维方式,真正帮助我们发明了TALED。”
22.Cell:重磅!下一代更智能的细胞疗法出炉!表达模块化SNIPR受体的CAR-T细胞可高效杀死实体瘤,同时减少毒副作用
doi:10.1016/j.cell.2022.03.023
基于工程化免疫细胞(即经过基因改造的免疫细胞)的疗法最近成为治疗癌症的一种有希望的方法。与传统药物相比,工程化免疫细胞在检测和消除癌细胞的能力方面更加精确和精密。然而,尽管前景广阔,基于细胞的疗法仍然面临重要的限制,包括毒性和它们可能攻击健康细胞的可能性。此外,科学家们并没有很好地掌握如何对现有的治疗性细胞(therapeutic cell)进行基因修饰,以扩它们的应用范围或更好地控制它们的活性。
为了克服这些限制,格拉德斯通研究所和加州大学旧金山分校的研究人员在一项新的研究中对用于设计治疗性细胞的分子构件进行了系统分析。他们的研究为设计具有更高特异性和安全性的治疗性细胞,以及最终定制基于细胞的治疗方法制定了全面的规则手册。相关研究结果发表在2022年4月14日的Cell期刊上,论文标题为“Modular design of synthetic receptors for programmed gene regulation in cell therapies”。
这些作者构建出一个他们称之为SNIPR(synthetic intramembrane proteolysis receptor,合成膜内蛋白分解受体)的受体的目录,这些受体足够小,可以在人类细胞中进行低成本的工程化。它们也完全由人类受体片段制成,可以检测和响应少量的靶标。此外,SNIPR的活性可以被调整,以便携带它们的细胞不只是杀死靶细胞,而且还可以将特定的分子递送到精确的疾病位置。
这些作者接下来评估了这些优化的受体在白血病、间皮瘤和卵巢癌的小鼠模型中清除肿瘤的能力。为了减少杀死非靶细胞的机会,他们将经设计后用于识别肿瘤表面上的一种分子的SNIPR与经基因改后识别另一种肿瘤分子的CAR受体相结合。此外,他们使CAR受体的产生依赖于SNIPR受体的激活。这样,只有携带synNotch和CAR受体的作用靶标的细胞才会被杀死,而只携带其中的一种作用靶标的细胞则不会被杀死。
23. Cell:揭示完整HIV病毒颗粒上的Env蛋白三维结构,可揭示Gag晶格的结构变异和定位
doi:10.1016/j.cell.2022.01.013
在一项新的研究中,利用在结构生物学领域开发的强大工具和技术,来自美国华盛顿大学和斯克里普斯研究所的研究人员发现了有关人类免疫缺陷病毒(HIV)的新细节。这些发现使人们关注这种病毒表面上下的基本结构,可能有助于设计和开发预防艾滋病(AIDS)的疫苗。相关研究结果发表在2022年2月17日的Cell期刊上,论文标题为“Cryo-ET of Env on intact HIV virions reveals structural variation and positioning on the Gag lattice”。

图片来自Cell, 2022, doi:10.1016/j.cell.2022.01.013。
这些详细的发现包括在整个HIV病毒的背景下,这种病毒的包膜“刺突”蛋白(Env蛋白,在这种病毒与宿主细胞结合时使用)的结构和位置的三维视图。通常情况下,科学家们会观察从这种病毒中分离出来的蛋白颗粒,或者表达为工程蛋白或纯化蛋白。在另一项关键的发现中,这些作者对聚糖屏障(glycan shield)有了新的认识---病毒蛋白表面上存在的可以将HIV隐藏在身体免疫系统之外的糖链。
24. Cell:我国科学家领衔发现人类指纹花纹竟与肢体发育基因相关联
doi:10.1016/j.cell.2021.12.008
在迄今为止最全面的分析中,来自中国科学院、复旦大学和苏格兰爱丁堡大学的研究人员发现指纹的形状---无论它们是圆形、波浪状还是弯曲状---都受到负责肢体发育的基因的影响。这一发现可能有助于科学家们更好地理解人类的基因和表型特征之间的关联性。相关研究结果发表在2022年1月5日的Cell期刊上,论文标题为“Limb development genes underlie variation in human fingerprint patterns”。论文通讯作者为中国科学院上海营养与健康研究所研究员汪思佳(Sijia Wang)、复旦大学的金力(Li Jin)院士和爱丁堡大学的Denis J. Headon教授。
汪博士说,“人们可能想知道为什么我们的团队在研究指纹。我们开始这项研究纯粹是出于好奇心,但后来发现指纹花纹(fingerprint pattern)与肢体生长的基因有关,而这些基因对胎儿发育至关重要。这提供了另一个典型的多效性(pleiotropy)例子,即多种表型相互关联,并受相同基因的影响。”
这些作者扫描了不同种族的23000多人的DNA,发现基因组上至少有43个区域与指纹花纹有关。其中一个最具影响力的区域似乎调节一个名为EVI1的基因的表达,该基因因它在胚胎肢体发育中的作用而闻名。
25. Cell:重大进展!作为一类新的药物,反馈干扰剂有望治疗病毒感染甚至癌症
doi:10.1016/j.cell.2022.04.022
疱疹病毒家族中的病毒是全世界出生缺陷、失明和器官移植失败的主要原因。抗病毒药物可以对抗这些病毒,但是患者往往对这类药物产生抗药性,从而使得它们失去效力。
如今,在一项新的研究中,格拉斯通研究所的Leor Weinberger博士和Sonali Chaturvedi博士及其研究团队开发出一类新的称为反馈干扰剂(feedback disruptors)的药物,它们有可能成为阻止抗药性产生的药物(resistance-proof drug,即防抗药性药物)。相关研究结果于2022年5月12日在线发表在Cell期刊上,论文标题为“Disrupting autorepression circuitry generates 'open-loop lethality' to yield escape-resistant antiviral agents”。
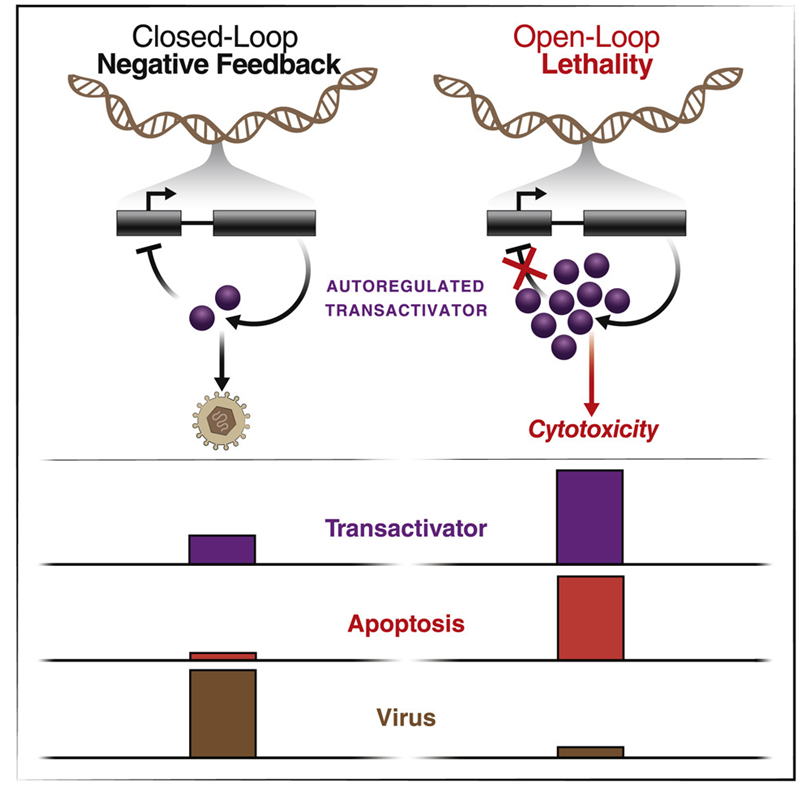
图片来自Cell, 2022, doi:10.1016/j.cell.2022.04.022。
一些对病毒生长至关重要的病毒蛋白在高浓度下会对宿主细胞产生毒性。因此,这些蛋白在水平过高时关闭它们自己的表达,以防止它们所依赖的宿主细胞死亡---这种系统被称为负反馈回路(negative feedback loop)。正如这项新的研究所报道的那样,反馈干扰剂靶向并破坏了这些遗传反馈回路,使受感染的宿主细胞自我毁灭,并阻止感染的发生。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


