天花&猴痘疫苗!Bavarian Nordic非复制型活疫苗Jynneos获美国FDA批准,获颁1张优先审评券!
来源:本站原创 2019-09-26 10:07
2019年09月26日/生物谷BIOON/--Bavarian Nordic是一家完全集成化的生物技术公司,专注于开发创新和更安全的疗法,用于癌症和传染性疾病的治疗。近日,该公司宣布,美国食品和药物管理局(FDA)已批准其疫苗产品Jynneos(天花和猴痘活疫苗,非复制型;MVA-BN,液体冷冻版),用于被确定为天花(smallpox)或猴痘(monkeypox)感染高风险的18岁及以上成人的主动

2019年09月26日/生物谷BIOON/--Bavarian Nordic是一家完全集成化的生物技术公司,专注于开发创新和更安全的疗法,用于癌症和传染性疾病的治疗。近日,该公司宣布,美国食品和药物管理局(FDA)已批准其疫苗产品Jynneos(天花和猴痘活疫苗,非复制型;MVA-BN,液体冷冻版),用于被确定为天花(smallpox)或猴痘(monkeypox)感染高风险的18岁及以上成人的主动免疫接种,以预防天花和猴痘疾病。Jynneos通过FDA的优先审查程序获得批准。Jynneos是美国唯一批准的非复制型天花疫苗,同时也是全球唯一批准的猴痘疫苗。
Jynneos被批准可广泛使用,包括免疫系统减弱的人群、湿疹患者群体、或家庭成员有湿疹的人群。此次批准是实现美国政府长期以来致力于开发一种疫苗可用于那些对传统、复制型天花疫苗有高度不良反应风险人群方面的重大突破。
美国生物医学高级研究发展局(BARDA)局长、美国卫生和公共服务部(HHS)防备及应变副助理秘书长Rick Bright博士表示:“这款疫苗产品的批准,不仅增强了美国国内的生物防御和全球健康安全,而且还展示了通过公私合作可以为美国人民做些什么。多年来与Bavarian Nordic合作研制这种疫苗,这最终意味着,如果发生涉及世界上已知的最致命疾病之一的紧急情况,美国将更好地做好准备挽救生命。”
Jynneos(MVA-BN)获得FDA批准,是基于一项综合开发项目,该项目包括22项临床研究,其中有2项III期研究。这2项III期研究数据证实了MVA-BN相对于ACAM2000的非劣效性。ACAM2000是目前获得美国批准的复制型天花疫苗。此外,没有报告与MVA-BN相关的严重不良事件,且MVA-BN中3级或更高级别的相关不良事件发生率(1.2%)低于复制型天花疫苗ACAM2000(10.3%)。
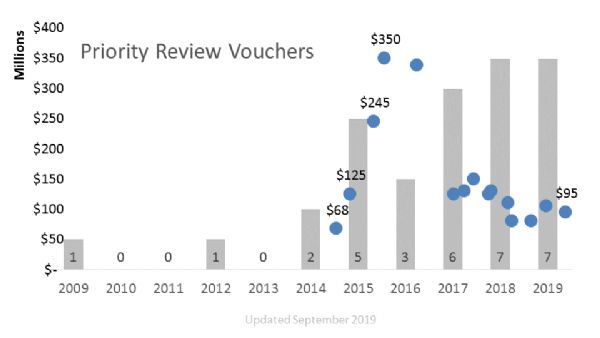
值得一提的是,在Jynneos获得批准的同时,FDA根据重大威胁医疗对策优先审评券(Material Threat Medical Countermeasure PRV)项目,颁发了一张优先审评券(PRV)给Bavarian Nordic公司,以表彰该公司在应对重大威胁医疗对策方面做出的突出贡献。这张PRV可由药企自己使用也可转手,用于加速一种新药的监管审查。Bavarian Nordic公司已打算将这张PRV卖给第三方。

PRV是美国FDA为了鼓励制药企业开发针对某些热带疾病、罕见病、物质威胁医疗对策的药物所推行的一种福利制度。凡是按照疾病清单成功开发出相关药物的制药商均可获得一张PRV。
这张PRV可由药企自己使用,也可转手卖给其他制药公司,用于不符合优先审评的任何一款药物申请优先审评,可将药品审查周期缩短4个月时间。
截至目前,FDA共颁发了32张PRV,Bavarian Nordic公司的这张PRV也是FDA在2019年颁发的第7张。
2014年7月,BioMarin公司将一张PRV以6800万美元的价格出售给了赛诺菲,由此创下了买卖PRV的先河。最初,由于稀缺性,PRV在买卖市场备受热捧,价格也一路水涨创高,艾伯维在2015年从United Therapeutics手中以3.5亿美元买进一张PRV,创造了PRV交易的天价。
但随着PRV颁发数量的逐渐增多,近年来市场上交易价一直在下降。在2019年,共发生了3笔PRV买卖交易,最近的一笔是阿斯利康从SOBI公司手中以9500万美元入手一张PRV。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->