2020年12月CRISPR/Cas研究进展
来源:本站原创 2020-12-28 20:49
2020年11月30日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。今年10月,德国马克斯-普朗克病原学研究所的Emmanuelle Charpentier博士以及美国加州大学伯克利分校的Jennifer A. Doudna博士因在CRISPR-Cas9基因编辑方面做了的
2020年12月28日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。今年10月,德国马克斯-普朗克病原学研究所的Emmanuelle Charpentier博士以及美国加州大学伯克利分校的Jennifer A. Doudna博士因在CRISPR-Cas9基因编辑方面做了的贡献荣获2020年诺贝尔化学奖。
CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。

2018年11月26日,中国科学家贺建奎声称世界上首批经过基因编辑的婴儿---一对双胞胎女性婴儿---在11月出生。他利用一种强大的基因编辑工具CRISPR-Cas9对这对双胞胎的一个基因进行修改,使得她们出生后就能够天然地抵抗HIV感染。这也是世界首例免疫艾滋病基因编辑婴儿。这条消息瞬间在国内外网站上迅速发酵,引发千层浪。有部分科学家支持贺建奎的研究,但是更多的是质疑,甚至是谴责。
即将过去的12月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Science论文解读!开发出CiBER-seq新技术,可同时分析细胞中的多达100个基因
doi:10.1126/science.abb9662
CRISPR-Cas9可以很容易地敲除或调整单个基因,以确定其对有机体或细胞,甚至另一个基因的影响。但是,如果你能一次进行几千个实验,利用CRISPR逐个对基因组中的每一个基因进行调整,并快速看到每一个基因的影响呢,那会怎么样呢?
在一项新的研究中,来自美国加州大学伯克利分校的研究人员开发出一种简单的方法来做到这一点,它让任何人都可以对细胞(包括人类细胞)进行分析,并迅速确定基因组中所有调控特定基因表达的DNA序列。相关研究结果发表在2020年12月11日的Science期刊上,论文标题为“CiBER-seq dissects genetic networks by quantitative CRISPRi profiling of expression phenotypes”。
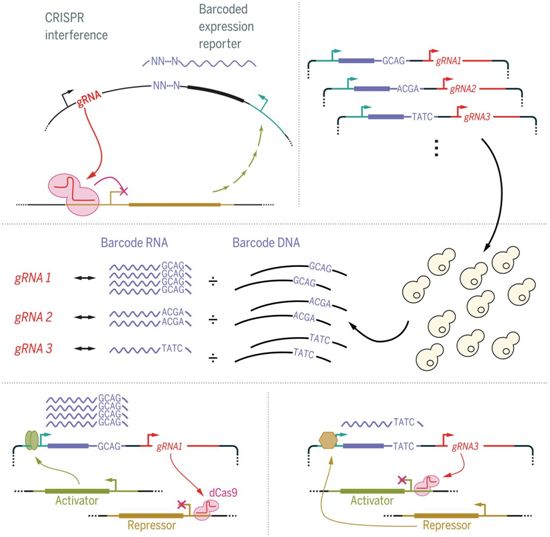
这种新技术,被称为CiBER-seq(CRISPR interference with barcoded expression reporter sequencing),通过让数万个CRISPR实验合并在一起,同时完成这些实验。该技术摒弃了荧光,采用深度测序的方式,直接测量合并样本(pooled sample)中基因活性的增加或减少。深度测序采用高通量、长读的新一代测序技术,对合并样本中表达的所有基因进行测序和基本计数。
2.Nucleic Acids Res:发现两种较小的新型Cas9核酸酶,有望更容易地进行基因组编辑
doi:10.1093/nar/gkaa998
在一项新的研究中,来自俄罗斯科学院、俄罗斯国家研究中心分子遗传学研究所和斯科尔科沃科学技术研究院等研究机构的研究人员描述了两种新的紧凑的Cas9核酸酶,即CRISPR-Cas系统具有切割活性的组分,这将有可能扩大Cas9工具箱在基因组编辑中的应用。这两种Cas9核酸酶中的一种被证实可以在人类细胞中发挥作用,因而可用于生物医学应用。相关研究结果发表在2020年12月2日的Nucleic Acids Research期刊上,论文标题为“PpCas9 from Pasteurella pneumotropica — a compact Type II-C Cas9 ortholog active in human cells”。论文通讯作者为俄罗斯国家研究中心分子遗传学研究所的Konstantin Severinov博士。
他们描述了两种新的小型Cas9核酸酶:一种来自Defluviimonas sp.20V17(一种生活在热液喷口的细菌),即DfCas9,另一种来自侵肺巴斯德菌(Pasteurella pneumotropica,一种在啮齿动物和其他哺乳动物中发现的常见细菌),即PpCas9。这两种核酸酶恰好对AAV载体来说足够小,并且具有相对较短的PAM,对于Cas9核酸酶来说,这是“两全其美”的选择。
这两种新的Cas9核酸酶与II-C型CRISPR-Cas系统有关,与SpCas9相比,通常表现为更小的Cas9效应物。这两种核酸酶采用了类似于其他Cas9蛋白的保守的双叶结构,但也有独特的特点:它们缺乏几个插入子结构域,并且有一个较小的Wedge结构域(负责与单向导RNA支架相互作用的结构域,因而更加紧凑。
3.Science子刊:利用智能手机超灵敏定量检测唾液中的新冠病毒
doi:10.1126/sciadv.abe3703
根据一项新的研究,一种基于唾液的便携式智能手机平台为COVID-19测试提供了一种超灵敏但易于使用的方法,它可以在15分钟内给出测试结果,而无需进行当前金标准所需的资源密集型实验室测试。该方法在12名COVID-19感染者和6名健康对照者中进行了测试。相关研究结果于2020年12月11日在线发表在Science Advances期刊上,论文标题为“A smartphone-read ultrasensitive and quantitative saliva test for COVID-19”。论文通讯作者为美国杜兰大学医学院的Tony Y. Hu博士。
Hu及其同事们证实,这种技术将荧光显微镜读出装置与智能手机配对,从CRISPR/Cas12a检测中确定病毒载量,与成熟的定量逆转录酶聚合酶链式反应(RT-qPCR)方法一样有效。
这些作者写道,“我们相信,未来类似的智能手机平台有可能迅速扩大COVID-19筛查能力,并有可能简化接触者追踪的验证,以改善当地的疫情遏制,并为区域疾病控制工作提供信息。”
4.Nature子刊:抗CRISPR蛋白介导的CRISPR-Cas9系统可提高基因编辑效率,同时降低脱靶效应
doi:10.1038/s42003-020-01340-2
CRISPR-Cas9基因编辑可能会引起不想要的遗传变化。在一项新的研究中,来自日本广岛大学和东京医科齿科大学的研究人员开发出一种很有前途的修复方法,即关闭CRISPR-Cas9基因编辑,直到它达到关键的细胞周期阶段,在这个阶段,更精确的修复可能会发生。根据这些研究结果,他们成功地展示了更精确的基因编辑,并抑制了称为脱靶效应的非预期基因缺失、插入或突变。相关研究结果近期发表在Communications Biology期刊上,论文标题为“A cell cycle-dependent CRISPR-Cas9 activation system based on an anti-CRISPR protein shows improved genome editing accuracy”。
虽然之前开发的方法报告了较少的与CRISPR技术相关的脱靶效应,但是这些研究人员表示,这些方法往往表现出较低的编辑效率。论文通讯作者、广岛大学生物医学与健康科学研究生院教授Wataru Nomura说,“我们的目标是开发出避免脱靶效应的方法,脱靶效应是基因组编辑领域最具挑战性的问题之一。我们的方法是一箭双雕。我们可以同时提高基因组编辑的精确性和抑制脱靶效应。”
5.重磅Cell论文详解!利用CRISPR-Cas13a和智能手机摄像头在30分钟内定量检测新冠病毒RNA
doi:10.1016/j.cell.2020.12.001
在一项新的研究中,这些研究人员概述了一种基于CRISPR的COVID-19测试技术,该技术使用智能手机摄像头,可在30分钟内提供准确结果。相关研究结果于2020年12月4日在线发表在Cell期刊上,论文标题为“Amplification-free detection of SARS-CoV-2 with CRISPR-Cas13a and mobile phone microscopy”。

在这种新的测试方法中,Cas13a蛋白与一种在切割时会产生荧光的报告分子结合在一起,然后与来自鼻腔拭子的患者样本混合。混合后的样本被放置在一种连接到智能手机的设备中。如果样本中含有SARS-CoV-2 RNA,Cas13就会被激活,并切割报告分子,导致荧光信号产生。然后,基本上变成了显微镜的智能手机摄像头可以检测到荧光,并报告测试的拭子呈病毒阳性。
论文共同通讯作者、格拉斯通病毒学研究所主任Melanie Ott博士说,“对于科学界来说,不仅要增加测试,而且要提供新的测试选择,这一直是一项紧迫的任务。我们开发的测试方法可以提供快速、低成本的检测,帮助控制COVID-19的传播。”
6.Nat Commun:利用AAV9-CRISPR-Cas9基因编辑有望清除受感染细胞DNA中的HIV DNA
doi:10.1038/s41467-020-19821-7
猿猴免疫缺损病毒(SIV)是一种与人类免疫缺陷病毒(HIV)存在密切亲缘关系的病毒。在一项新的研究中,来自美国天普大学刘易斯-卡茨医学院和杜兰大学等研究机构的研究人员在HIV研究方面迈出了重要一步:他们成功地从非人灵长类动物的基因组中剔除了SIV。这一突破使得他们比以往任何时候都更接近开发治愈人类HIV感染的方法。相关研究结果近期发表在Nature Communications期刊上,论文标题为“CRISPR based editing of SIV proviral DNA in ART treated non-human primates”。
论文共同通讯作者、天普大学刘易斯-卡茨医学院综合神经艾滋病中心主任Kamel Khalili博士说,“我们首次发现,单次注射我们的由腺相关病毒(AAV)携带的CRISPR基因编辑构建体,可以从恒河猴的受感染细胞中剔除SIV基因组。”
7.Nat Commun:新型CRISPR-Cas9变体可提高基因编辑的安全性和有效性
doi:10.1038/s41467-020-19842-2
在一项新的研究中,来自美国密歇根大学医学院的研究人员发现,使用一种新的修复DNA的CRISPR-Cas9变体将会改善备受吹捧的CRISPR-Cas9工具的安全性和有效性。相关研究结果近期发表在Nature Communications期刊上,论文标题为“MiCas9 increases large size gene knock-in rates and reduces undesirable on-target and off-target indel edits”。
论文共同通讯作者、密歇根大学医学院心血管中心内科、心脏外科、生理学、药理学和药物化学教授Y. Eugene Chen博士解释说,这两个关键问题---安全性和有效性---是继续阻碍CRISPR-Cas9基因编辑发挥其全部临床潜力的原因。另外两名论文共同通讯作者为密歇根大学医学院的Jifeng Zhang和Jie Xu。
这种新的CRISPR-Cas9变体提高了将基因或DNA片段插入到基因组的精确位置时的效率,即所谓的敲入(knocking in)。它还降低了基因编辑时经常发生的碱基对的意外插入或缺失(insertions or deletions, indels)率。
8.bioRxiv:通过编辑人类神经细胞中的关键基因或有望改变其患阿尔兹海默病的风险
doi:10.1101/2020.10.27.357830
近日,一篇发表在预印版平台bioRxiv上的研究报告中,来自拉瓦尔大学等机构的科学家们通过研究表示,通过编辑神经细胞中的关键基因或能增加个体患阿尔兹海默病的风险,文章中研究人员描述了如何对相关基因进行编辑以及其所产生的影响效应。
此前研究结果表明,参与阿尔兹海默病发生的其中一个风险因素就是脑细胞中β-淀粉样蛋白的积累,而且某些人群机体中携带有名为A673T的基因突变,相比一般人群而言,表达该基因突变的人群患阿尔兹海默病的风险要比前者低4倍,这项研究中,研究人员通过研究编辑人类脑细胞使得个体机体携带基因突变A673T,同时他们发现这或许会降低个体患阿尔兹海默病的风险。
研究者指出,A673T突变不同于不表达单一DNA元件的个体机体中所携带的同源性基因,这就表明,通过添加突变或许更加容易一些,随后研究者尝试利用CRISPR技术来对脑细胞进行编辑,虽然这一尝试相对成功一些,但研究人员还尝试了使用prime编辑技术(prime editing),这种相对较新的技术能允许研究者将一个碱基字母转换成另外一个碱基字母,利用该技术,研究者就能够在体外对大约40%的脑细胞进行编辑,这似乎并不足以防止β-淀粉样蛋白的积累,也不足以减缓阿尔兹海默病的进展;后期还需要研究人员进行更多研究得出更多的结果。
9.Cell子刊解读!开发出新型CRISPR标记技术或能提高利用干细胞培养出模式细胞的准确性!
doi:10.1016/j.celrep.2020.108460
日前,一篇刊登在国际杂志Cell Reports上题为“Master Regulators and Cofactors of Human Neuronal Cell Fate Specification Identified by CRISPR Gene Activation Screens”的研究报告中,来自杜克大学等机构的科学家们通过掌握基因调节网络的“语言”开发了一种新方法能将干细胞转化成为想要的细胞类型。将干细胞转化成为其它类型的细胞并不是一个新的想法,目前已经存在多种方法,但其所得到的结果仍然有一些值得改进的地方;通常情况下,当在实验室培养过程中,程序化的干细胞并不能正确成熟,因此研究人员就需要寻找用于实验的成体神经细胞来最终得到胚胎神经元,而胚胎神经元无法模拟迟发性的精神疾病和神经退行性疾病。
研究者Josh Black说道,这些细胞乍一看可能是对的,但他们往往缺少一种你所想要的关键细胞属性,利用CRISPR基因编辑技术,我们就能开发出新方法来识别出哪些转录因子(基因火星的主要控制器)能帮助制造好的神经元。这项研究中研究者开发出了能够制造成熟成体神经元的新方法,目前该方法能用于编程任何类型的细胞。CRISPR技术通常用于编辑DNA序列,也就是大家俗称的基因编辑,其中Cas9蛋白能与导向RNA结合并指导其切割特定位点的DNA,进而导致DNA序列的改变,DNA编辑如何已经被广泛用于改变基因的序列,但在基因被关闭的情况下其似乎并不能发挥作用。
一种失活的Cas9蛋白(dCas9)能附着在不能切割的DNA位点上。实际上,如果没有另一种分子连接或招募到它,其就不会发挥任何作用;此前研究人员报道了多种方法将不同的分子结构域吸附到dCas9蛋白上,从而来告诉细胞开启基因或重塑染色质的结构;研究人员非常感兴趣利用开启基因表达的特殊工具将一种细胞类型转化为能创造出更好的疾病模型的另一种细胞类型。
10.CRISPR-Cas9技术编辑的CAR-T细胞或能增强机体抵御血液癌症的潜力
新闻来源:CRISPR-edited CAR T cells enhance fight against blood cancers
近日,在2020年第62届美国血液学会年会(ASH)上,来自宾夕法尼亚大学的科学家们展示了他们最新的临床前研究结果,他们发现,利用CRISPR/Cas9技术敲除CAR-T细胞上能抑制T细胞激活的特殊蛋白或能增强工程化T细胞清除血液癌症的能力。研究人员敲除了CAR-T细胞上名为CD5的基因,随后将其输注回携带T细胞和B细胞白血病/淋巴瘤的小鼠体内,CD5基因能编码T细胞表面的CD5蛋白,而且还会抑制其激活。相比输注了非编辑CAR-T细胞的小鼠而言,输注了CD5被剔除的CAR-T细胞的小鼠机体外周血中的T细胞增殖水平较高,而且肿瘤尺寸发生了明显下降,且小鼠有更好的生存结局。
CRISPR技术能帮助科学家们锁定并编辑任何不需要的基因,以癌症为例,该技术就能通过剔除T细胞中的特殊基因来帮其更好地抵御肿瘤,这种方法与CAR-T细胞疗法密切相关,即研究人员通过收集患者机体自身的T细胞,对其进行工程化修饰表达新型受体从而寻找并攻击癌细胞。医学博士Marco Ruella说道,我们通过研究首次表明,我们可以成功利用CRISPR/Cas9技术来敲除CAR-T细胞表面的CD5,从而增强其攻击癌症的能力,在多种癌症模型中,编辑和非编辑CAR-T细胞之间的差异非常惊人。
研究人员首次在T细胞白血病模型中检测了这种新方法,抗CD5的CAR-T细胞能被遗传工程化修饰来寻找恶性T细胞上的CD5并对其发起攻击;由于CD5在正常T细胞中也会表达,随后研究人员从CAR-T细胞对CD5进行了移除,这样就能避免对其它CAR-T细胞的杀灭效应,从而就能潜在释放CAR-T细胞的激活,否则就会被这些细胞上CD5的存在所抑制。
实际上,在体内和体外实验中,CD5被剔除的抗CD5 CAR-T细胞要比CD5没有被剔除的CAR-T细胞的效力更强,而且有超过50%的小鼠在长期的实验中得到了治愈。为了检测CD5的剔除是否会增加靶向作用抗原而不是CD5的CAR-T细胞的抗肿瘤效应,随后研究人员在CTL019 CAR-T细胞对抗CD19+ B细胞白血病的环境下进行了证实,值得注意的是,同样在该模型中,CD5的敲除会明显增强CTL019 CAR-T细胞的抗肿瘤效率,同时还会让大部分小鼠的疾病完全缓解期延长。
11.EMBO J:如何建立小鼠模型用于疫苗研究
doi:10.15252/embj.2020105926
为了开发疫苗并研究人类的免疫应答,科学家们依赖于多种动物模型,包括可以通过基因工程B细胞受体产生人类抗体的小鼠,该B细胞受体是与B细胞膜结合的专门抗体。但是,这些小鼠通常需要数年的时间才能发育,需要复杂的基因修饰和仔细的繁殖过程。MGH,麻省理工学院和哈佛大学Ragon研究所副所长Facundo Batista博士说:“产生这些专门小鼠的时间一直是延迟疫苗开发的主要因素。随着CRISPR / Cas9等基因编辑技术的最新发展,我们知道必须有一种方法可以大大加快这一过程。”
Batista小组开发了一种新的方法来生成用于临床前疫苗评估的小鼠品系,从而大大缩短了这一时间表。在最近发表在《 EMBO》杂志上的一项研究中,这种采用CRISPR / Cas9技术的一步法可以在短短几周内产生具有基因工程人B细胞受体的小鼠。
为了测试这项技术,研究人员对小鼠进行了改造,使其具有人类B细胞受体,而人类B细胞受体是所谓的广泛中和HIV抗体的前体。已知这些抗体可有效对抗HIV,但很难通过疫苗接种来刺激。前体通过产生广泛中和的抗体样突变对目前在临床HIV试验中使用的抗原产生反应。快速评估不同抗原激活这些前体的能力的能力具有显著加速疫苗开发的潜力。
12.NEJM两项临床试验结果表明:新型基因疗法或有望治疗镰状细胞性贫血症
doi:10.1056/NEJMoa2029392; doi:10.1056/NEJMoa2031054
近日,两篇发表在国际杂志New England Journal of Medicine上的研究报告中,来自美国、德国、加拿大和法国的科学家们通过研究开发出了能靶向治疗镰状细胞性贫血(sickle-cell anemia)的新型基因疗法。在第一篇研究报告中,研究人员利用CRISPR-Cas9基因编辑系统增强了镰状细胞性贫血症患者机体中胎血红蛋白(fetal hemoglobin)的产生。在第二篇研究报告中,研究人员试图寻找能促进镰状细胞性贫血症患者机体胎血红蛋白产生的方法,他们使用了一种不同的技术,该技术主要能通过病毒载体引入RNA,从而改变胎血红蛋白基因的表达。
研究者表示,这两种新型疗法选择均为临床试验的一部分,其旨在改变主要诱发镰状细胞性贫血的致病基因;在这两种情况下,临床医生都会移除一部分患者机体的血液干细胞,并试图使得患者机体的遗传开关发生失活,随后给与患者化疗手段来破坏其机体中发生错误的细胞,这种新改变的干细胞就能被重新输注到患者体内。随着时间推移,进入患者机体的干细胞就会生长成为正常的血液细胞并让患者摆脱疾病的折磨。(生物谷 Bioon.com)
CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。

图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
即将过去的12月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Science论文解读!开发出CiBER-seq新技术,可同时分析细胞中的多达100个基因
doi:10.1126/science.abb9662
CRISPR-Cas9可以很容易地敲除或调整单个基因,以确定其对有机体或细胞,甚至另一个基因的影响。但是,如果你能一次进行几千个实验,利用CRISPR逐个对基因组中的每一个基因进行调整,并快速看到每一个基因的影响呢,那会怎么样呢?
在一项新的研究中,来自美国加州大学伯克利分校的研究人员开发出一种简单的方法来做到这一点,它让任何人都可以对细胞(包括人类细胞)进行分析,并迅速确定基因组中所有调控特定基因表达的DNA序列。相关研究结果发表在2020年12月11日的Science期刊上,论文标题为“CiBER-seq dissects genetic networks by quantitative CRISPRi profiling of expression phenotypes”。

CiBER-seq原理示意图,图片来自Science, 2020, doi:10.1126/science.abb9662。
这种新技术,被称为CiBER-seq(CRISPR interference with barcoded expression reporter sequencing),通过让数万个CRISPR实验合并在一起,同时完成这些实验。该技术摒弃了荧光,采用深度测序的方式,直接测量合并样本(pooled sample)中基因活性的增加或减少。深度测序采用高通量、长读的新一代测序技术,对合并样本中表达的所有基因进行测序和基本计数。
2.Nucleic Acids Res:发现两种较小的新型Cas9核酸酶,有望更容易地进行基因组编辑
doi:10.1093/nar/gkaa998
在一项新的研究中,来自俄罗斯科学院、俄罗斯国家研究中心分子遗传学研究所和斯科尔科沃科学技术研究院等研究机构的研究人员描述了两种新的紧凑的Cas9核酸酶,即CRISPR-Cas系统具有切割活性的组分,这将有可能扩大Cas9工具箱在基因组编辑中的应用。这两种Cas9核酸酶中的一种被证实可以在人类细胞中发挥作用,因而可用于生物医学应用。相关研究结果发表在2020年12月2日的Nucleic Acids Research期刊上,论文标题为“PpCas9 from Pasteurella pneumotropica — a compact Type II-C Cas9 ortholog active in human cells”。论文通讯作者为俄罗斯国家研究中心分子遗传学研究所的Konstantin Severinov博士。
他们描述了两种新的小型Cas9核酸酶:一种来自Defluviimonas sp.20V17(一种生活在热液喷口的细菌),即DfCas9,另一种来自侵肺巴斯德菌(Pasteurella pneumotropica,一种在啮齿动物和其他哺乳动物中发现的常见细菌),即PpCas9。这两种核酸酶恰好对AAV载体来说足够小,并且具有相对较短的PAM,对于Cas9核酸酶来说,这是“两全其美”的选择。
这两种新的Cas9核酸酶与II-C型CRISPR-Cas系统有关,与SpCas9相比,通常表现为更小的Cas9效应物。这两种核酸酶采用了类似于其他Cas9蛋白的保守的双叶结构,但也有独特的特点:它们缺乏几个插入子结构域,并且有一个较小的Wedge结构域(负责与单向导RNA支架相互作用的结构域,因而更加紧凑。
3.Science子刊:利用智能手机超灵敏定量检测唾液中的新冠病毒
doi:10.1126/sciadv.abe3703
根据一项新的研究,一种基于唾液的便携式智能手机平台为COVID-19测试提供了一种超灵敏但易于使用的方法,它可以在15分钟内给出测试结果,而无需进行当前金标准所需的资源密集型实验室测试。该方法在12名COVID-19感染者和6名健康对照者中进行了测试。相关研究结果于2020年12月11日在线发表在Science Advances期刊上,论文标题为“A smartphone-read ultrasensitive and quantitative saliva test for COVID-19”。论文通讯作者为美国杜兰大学医学院的Tony Y. Hu博士。
Hu及其同事们证实,这种技术将荧光显微镜读出装置与智能手机配对,从CRISPR/Cas12a检测中确定病毒载量,与成熟的定量逆转录酶聚合酶链式反应(RT-qPCR)方法一样有效。
这些作者写道,“我们相信,未来类似的智能手机平台有可能迅速扩大COVID-19筛查能力,并有可能简化接触者追踪的验证,以改善当地的疫情遏制,并为区域疾病控制工作提供信息。”
4.Nature子刊:抗CRISPR蛋白介导的CRISPR-Cas9系统可提高基因编辑效率,同时降低脱靶效应
doi:10.1038/s42003-020-01340-2
CRISPR-Cas9基因编辑可能会引起不想要的遗传变化。在一项新的研究中,来自日本广岛大学和东京医科齿科大学的研究人员开发出一种很有前途的修复方法,即关闭CRISPR-Cas9基因编辑,直到它达到关键的细胞周期阶段,在这个阶段,更精确的修复可能会发生。根据这些研究结果,他们成功地展示了更精确的基因编辑,并抑制了称为脱靶效应的非预期基因缺失、插入或突变。相关研究结果近期发表在Communications Biology期刊上,论文标题为“A cell cycle-dependent CRISPR-Cas9 activation system based on an anti-CRISPR protein shows improved genome editing accuracy”。
虽然之前开发的方法报告了较少的与CRISPR技术相关的脱靶效应,但是这些研究人员表示,这些方法往往表现出较低的编辑效率。论文通讯作者、广岛大学生物医学与健康科学研究生院教授Wataru Nomura说,“我们的目标是开发出避免脱靶效应的方法,脱靶效应是基因组编辑领域最具挑战性的问题之一。我们的方法是一箭双雕。我们可以同时提高基因组编辑的精确性和抑制脱靶效应。”
5.重磅Cell论文详解!利用CRISPR-Cas13a和智能手机摄像头在30分钟内定量检测新冠病毒RNA
doi:10.1016/j.cell.2020.12.001
在一项新的研究中,这些研究人员概述了一种基于CRISPR的COVID-19测试技术,该技术使用智能手机摄像头,可在30分钟内提供准确结果。相关研究结果于2020年12月4日在线发表在Cell期刊上,论文标题为“Amplification-free detection of SARS-CoV-2 with CRISPR-Cas13a and mobile phone microscopy”。

图片来自Cell, 2020, doi:10.1016/j.cell.2020.12.001。
在这种新的测试方法中,Cas13a蛋白与一种在切割时会产生荧光的报告分子结合在一起,然后与来自鼻腔拭子的患者样本混合。混合后的样本被放置在一种连接到智能手机的设备中。如果样本中含有SARS-CoV-2 RNA,Cas13就会被激活,并切割报告分子,导致荧光信号产生。然后,基本上变成了显微镜的智能手机摄像头可以检测到荧光,并报告测试的拭子呈病毒阳性。
论文共同通讯作者、格拉斯通病毒学研究所主任Melanie Ott博士说,“对于科学界来说,不仅要增加测试,而且要提供新的测试选择,这一直是一项紧迫的任务。我们开发的测试方法可以提供快速、低成本的检测,帮助控制COVID-19的传播。”
6.Nat Commun:利用AAV9-CRISPR-Cas9基因编辑有望清除受感染细胞DNA中的HIV DNA
doi:10.1038/s41467-020-19821-7
猿猴免疫缺损病毒(SIV)是一种与人类免疫缺陷病毒(HIV)存在密切亲缘关系的病毒。在一项新的研究中,来自美国天普大学刘易斯-卡茨医学院和杜兰大学等研究机构的研究人员在HIV研究方面迈出了重要一步:他们成功地从非人灵长类动物的基因组中剔除了SIV。这一突破使得他们比以往任何时候都更接近开发治愈人类HIV感染的方法。相关研究结果近期发表在Nature Communications期刊上,论文标题为“CRISPR based editing of SIV proviral DNA in ART treated non-human primates”。
论文共同通讯作者、天普大学刘易斯-卡茨医学院综合神经艾滋病中心主任Kamel Khalili博士说,“我们首次发现,单次注射我们的由腺相关病毒(AAV)携带的CRISPR基因编辑构建体,可以从恒河猴的受感染细胞中剔除SIV基因组。”
7.Nat Commun:新型CRISPR-Cas9变体可提高基因编辑的安全性和有效性
doi:10.1038/s41467-020-19842-2
在一项新的研究中,来自美国密歇根大学医学院的研究人员发现,使用一种新的修复DNA的CRISPR-Cas9变体将会改善备受吹捧的CRISPR-Cas9工具的安全性和有效性。相关研究结果近期发表在Nature Communications期刊上,论文标题为“MiCas9 increases large size gene knock-in rates and reduces undesirable on-target and off-target indel edits”。
论文共同通讯作者、密歇根大学医学院心血管中心内科、心脏外科、生理学、药理学和药物化学教授Y. Eugene Chen博士解释说,这两个关键问题---安全性和有效性---是继续阻碍CRISPR-Cas9基因编辑发挥其全部临床潜力的原因。另外两名论文共同通讯作者为密歇根大学医学院的Jifeng Zhang和Jie Xu。
这种新的CRISPR-Cas9变体提高了将基因或DNA片段插入到基因组的精确位置时的效率,即所谓的敲入(knocking in)。它还降低了基因编辑时经常发生的碱基对的意外插入或缺失(insertions or deletions, indels)率。
8.bioRxiv:通过编辑人类神经细胞中的关键基因或有望改变其患阿尔兹海默病的风险
doi:10.1101/2020.10.27.357830
近日,一篇发表在预印版平台bioRxiv上的研究报告中,来自拉瓦尔大学等机构的科学家们通过研究表示,通过编辑神经细胞中的关键基因或能增加个体患阿尔兹海默病的风险,文章中研究人员描述了如何对相关基因进行编辑以及其所产生的影响效应。
此前研究结果表明,参与阿尔兹海默病发生的其中一个风险因素就是脑细胞中β-淀粉样蛋白的积累,而且某些人群机体中携带有名为A673T的基因突变,相比一般人群而言,表达该基因突变的人群患阿尔兹海默病的风险要比前者低4倍,这项研究中,研究人员通过研究编辑人类脑细胞使得个体机体携带基因突变A673T,同时他们发现这或许会降低个体患阿尔兹海默病的风险。
研究者指出,A673T突变不同于不表达单一DNA元件的个体机体中所携带的同源性基因,这就表明,通过添加突变或许更加容易一些,随后研究者尝试利用CRISPR技术来对脑细胞进行编辑,虽然这一尝试相对成功一些,但研究人员还尝试了使用prime编辑技术(prime editing),这种相对较新的技术能允许研究者将一个碱基字母转换成另外一个碱基字母,利用该技术,研究者就能够在体外对大约40%的脑细胞进行编辑,这似乎并不足以防止β-淀粉样蛋白的积累,也不足以减缓阿尔兹海默病的进展;后期还需要研究人员进行更多研究得出更多的结果。
9.Cell子刊解读!开发出新型CRISPR标记技术或能提高利用干细胞培养出模式细胞的准确性!
doi:10.1016/j.celrep.2020.108460
日前,一篇刊登在国际杂志Cell Reports上题为“Master Regulators and Cofactors of Human Neuronal Cell Fate Specification Identified by CRISPR Gene Activation Screens”的研究报告中,来自杜克大学等机构的科学家们通过掌握基因调节网络的“语言”开发了一种新方法能将干细胞转化成为想要的细胞类型。将干细胞转化成为其它类型的细胞并不是一个新的想法,目前已经存在多种方法,但其所得到的结果仍然有一些值得改进的地方;通常情况下,当在实验室培养过程中,程序化的干细胞并不能正确成熟,因此研究人员就需要寻找用于实验的成体神经细胞来最终得到胚胎神经元,而胚胎神经元无法模拟迟发性的精神疾病和神经退行性疾病。
研究者Josh Black说道,这些细胞乍一看可能是对的,但他们往往缺少一种你所想要的关键细胞属性,利用CRISPR基因编辑技术,我们就能开发出新方法来识别出哪些转录因子(基因火星的主要控制器)能帮助制造好的神经元。这项研究中研究者开发出了能够制造成熟成体神经元的新方法,目前该方法能用于编程任何类型的细胞。CRISPR技术通常用于编辑DNA序列,也就是大家俗称的基因编辑,其中Cas9蛋白能与导向RNA结合并指导其切割特定位点的DNA,进而导致DNA序列的改变,DNA编辑如何已经被广泛用于改变基因的序列,但在基因被关闭的情况下其似乎并不能发挥作用。
一种失活的Cas9蛋白(dCas9)能附着在不能切割的DNA位点上。实际上,如果没有另一种分子连接或招募到它,其就不会发挥任何作用;此前研究人员报道了多种方法将不同的分子结构域吸附到dCas9蛋白上,从而来告诉细胞开启基因或重塑染色质的结构;研究人员非常感兴趣利用开启基因表达的特殊工具将一种细胞类型转化为能创造出更好的疾病模型的另一种细胞类型。
10.CRISPR-Cas9技术编辑的CAR-T细胞或能增强机体抵御血液癌症的潜力
新闻来源:CRISPR-edited CAR T cells enhance fight against blood cancers
近日,在2020年第62届美国血液学会年会(ASH)上,来自宾夕法尼亚大学的科学家们展示了他们最新的临床前研究结果,他们发现,利用CRISPR/Cas9技术敲除CAR-T细胞上能抑制T细胞激活的特殊蛋白或能增强工程化T细胞清除血液癌症的能力。研究人员敲除了CAR-T细胞上名为CD5的基因,随后将其输注回携带T细胞和B细胞白血病/淋巴瘤的小鼠体内,CD5基因能编码T细胞表面的CD5蛋白,而且还会抑制其激活。相比输注了非编辑CAR-T细胞的小鼠而言,输注了CD5被剔除的CAR-T细胞的小鼠机体外周血中的T细胞增殖水平较高,而且肿瘤尺寸发生了明显下降,且小鼠有更好的生存结局。
CRISPR技术能帮助科学家们锁定并编辑任何不需要的基因,以癌症为例,该技术就能通过剔除T细胞中的特殊基因来帮其更好地抵御肿瘤,这种方法与CAR-T细胞疗法密切相关,即研究人员通过收集患者机体自身的T细胞,对其进行工程化修饰表达新型受体从而寻找并攻击癌细胞。医学博士Marco Ruella说道,我们通过研究首次表明,我们可以成功利用CRISPR/Cas9技术来敲除CAR-T细胞表面的CD5,从而增强其攻击癌症的能力,在多种癌症模型中,编辑和非编辑CAR-T细胞之间的差异非常惊人。
研究人员首次在T细胞白血病模型中检测了这种新方法,抗CD5的CAR-T细胞能被遗传工程化修饰来寻找恶性T细胞上的CD5并对其发起攻击;由于CD5在正常T细胞中也会表达,随后研究人员从CAR-T细胞对CD5进行了移除,这样就能避免对其它CAR-T细胞的杀灭效应,从而就能潜在释放CAR-T细胞的激活,否则就会被这些细胞上CD5的存在所抑制。
实际上,在体内和体外实验中,CD5被剔除的抗CD5 CAR-T细胞要比CD5没有被剔除的CAR-T细胞的效力更强,而且有超过50%的小鼠在长期的实验中得到了治愈。为了检测CD5的剔除是否会增加靶向作用抗原而不是CD5的CAR-T细胞的抗肿瘤效应,随后研究人员在CTL019 CAR-T细胞对抗CD19+ B细胞白血病的环境下进行了证实,值得注意的是,同样在该模型中,CD5的敲除会明显增强CTL019 CAR-T细胞的抗肿瘤效率,同时还会让大部分小鼠的疾病完全缓解期延长。
11.EMBO J:如何建立小鼠模型用于疫苗研究
doi:10.15252/embj.2020105926
为了开发疫苗并研究人类的免疫应答,科学家们依赖于多种动物模型,包括可以通过基因工程B细胞受体产生人类抗体的小鼠,该B细胞受体是与B细胞膜结合的专门抗体。但是,这些小鼠通常需要数年的时间才能发育,需要复杂的基因修饰和仔细的繁殖过程。MGH,麻省理工学院和哈佛大学Ragon研究所副所长Facundo Batista博士说:“产生这些专门小鼠的时间一直是延迟疫苗开发的主要因素。随着CRISPR / Cas9等基因编辑技术的最新发展,我们知道必须有一种方法可以大大加快这一过程。”
Batista小组开发了一种新的方法来生成用于临床前疫苗评估的小鼠品系,从而大大缩短了这一时间表。在最近发表在《 EMBO》杂志上的一项研究中,这种采用CRISPR / Cas9技术的一步法可以在短短几周内产生具有基因工程人B细胞受体的小鼠。

图片来源:Www.pixabay.com。
为了测试这项技术,研究人员对小鼠进行了改造,使其具有人类B细胞受体,而人类B细胞受体是所谓的广泛中和HIV抗体的前体。已知这些抗体可有效对抗HIV,但很难通过疫苗接种来刺激。前体通过产生广泛中和的抗体样突变对目前在临床HIV试验中使用的抗原产生反应。快速评估不同抗原激活这些前体的能力的能力具有显著加速疫苗开发的潜力。
12.NEJM两项临床试验结果表明:新型基因疗法或有望治疗镰状细胞性贫血症
doi:10.1056/NEJMoa2029392; doi:10.1056/NEJMoa2031054
近日,两篇发表在国际杂志New England Journal of Medicine上的研究报告中,来自美国、德国、加拿大和法国的科学家们通过研究开发出了能靶向治疗镰状细胞性贫血(sickle-cell anemia)的新型基因疗法。在第一篇研究报告中,研究人员利用CRISPR-Cas9基因编辑系统增强了镰状细胞性贫血症患者机体中胎血红蛋白(fetal hemoglobin)的产生。在第二篇研究报告中,研究人员试图寻找能促进镰状细胞性贫血症患者机体胎血红蛋白产生的方法,他们使用了一种不同的技术,该技术主要能通过病毒载体引入RNA,从而改变胎血红蛋白基因的表达。
研究者表示,这两种新型疗法选择均为临床试验的一部分,其旨在改变主要诱发镰状细胞性贫血的致病基因;在这两种情况下,临床医生都会移除一部分患者机体的血液干细胞,并试图使得患者机体的遗传开关发生失活,随后给与患者化疗手段来破坏其机体中发生错误的细胞,这种新改变的干细胞就能被重新输注到患者体内。随着时间推移,进入患者机体的干细胞就会生长成为正常的血液细胞并让患者摆脱疾病的折磨。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


