2019年终盘点:2019年HIV重磅研究解读
- -1PRF
- ART
- Cas9
- cCAR-T
- CCR5
- CRISPR
- duoCAR-T
- eCD4-Ig
- FTSJ3
- GS-CA1
- HEAL
- HIV
- lncRNA
- MDC1
- RC1
- Shiftless
- SIV
- Th1细胞
- UB-421
- α4β7抗体
- 先天免疫
- 免疫原
- 抗原竞争
- 抗逆转录病毒治疗
- 特鲁瓦达
- 生发中心
- 生殖系靶向
- 疫苗
- 病毒库
- 砒霜
- 纳米颗粒
- 耐药性
- 艾滋病
- 避孕
来源:本站原创 2019-12-28 05:38
2019年11月30日讯/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,
2019年11月30日讯/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
迄今为止,全世界只报道了仅有的一名“柏林病人”Timothy Ray Brown被认为完全治愈了HIV。2007年,Brown在德国一家医院接受通过CCR5△32/CCR5△32基因型造血干细胞移植治疗白血病后,他体内的HIV病毒也完全消失了,成为世界上首例被“治愈”的艾滋病患者。2019年3月,一名被称为“伦敦病人”(London patient)的男性患者接受了HIV抵抗患者的骨髓移植后已经将近19个月没有出现HIV感染的迹象了,他很可能成为世界上第二名已知的被成功去除HIV的患者。
在即将过去的2019年,科学家们在HIV的风险因素、致病机制、检测和治疗等方面取得重大的进展,让我们一起看看这个领域在这一年里取得的重大发现。
1.Nature:重磅!揭示HIV招募FTSJ3逃避宿主先天免疫识别机制
Nature, Published online: 09 January 2019, doi:10.1038/s41586-018-0841-4
在哺乳动物中,RNA的2'-O-甲基化是细胞的先天免疫系统区分内源性信使RNA(mRNA)和外源性mRNA的一种分子特征。然而,RNA的2'-O-甲基化的分子功能尚未得到充分的理解。在一项新的研究中,法国研究人员纯化出TAR RNA结合蛋白(TRBP)、它的相互作用搭档,并鉴定出一种不依赖于DICER的含有FTSJ3的TRBP复合物,其中据推测,FTSJ3是一种2'-O-甲基化转移酶(2′O-MTase)。 体外和体内实验表明FTSJ3就是一种通过TRBP被招募到HIV RNA上的2'-O-甲基化转移酶。通过使用RiboMethSeq分析,这些研究人员在HIV基因组的特定位点上鉴定出主要依赖于FTSJ3的2'-O-甲基化。
在FTSJ3敲低细胞(指的是FTSJ3基因表达受到抑制的细胞)中产生的HIV-1病毒表现出减少的2'-O-甲基化,并通过RNA传感蛋白MDA触发人树突细胞中的1型干扰素表达。由此诱导的IFN-α和IFN-β表达导致HIV表达下降。
2.Science:揭示先天免疫系统介导的HIV纳米颗粒免疫原靶向生发中心机制
Science, 08 February 2019, doi:10.1126/science.aat9120
在一项新的研究中,来自美国麻省理工学院等多家研究机构的研究人员比较了两种不同的发生高度糖基化的HIV抗原---一种源自gp120的小蛋白和一种较大的保持稳定的包膜蛋白(Env)三聚体---在以蛋白纳米颗粒形式或者以游离形式存在时在初次免疫后的命运。不同于单体抗原的是,纳米颗粒抗原被快速地运送到滤泡树突细胞(follicular dendritic cell, FDC)网络,随后以依赖于补体、甘露糖结合凝集素(mannose-binding lectin, MBL)和免疫原聚糖(immunogen glycan)的形式聚集在生发中心。
这些研究人员随后发现在缺乏MBL的小鼠中,免疫原不能定位到FDC细胞中或者让免疫原去糖基化都会显著地影响抗体反应。这些结果在HIV疫苗开发的背景下尤其令人关注,这是因为在现存的HIV疫苗开发过程中,致密的HIV包膜“聚糖屏障(glycan shield)”通常被视为实现高效的抗体反应的障碍。
3. Cell:中科院高光侠课题组揭示新型抗病毒因子抑制HIV-1程序性-1核糖体移码机制
Cell, 24 January 2019, doi:10.1016/j.cell.2018.12.030
HIV-1使用程序性-1核糖体移码(programmed -1 ribosomal frameshifting, -1PRF)来产生病毒复制所必需的Gag和Gag-Pol。中国科学院生物物理研究所的高光侠(GAO Guangxia)及其课题组报道了一种抑制-1PRF的新型宿主抗病毒因子,他们称之为Shiftless。
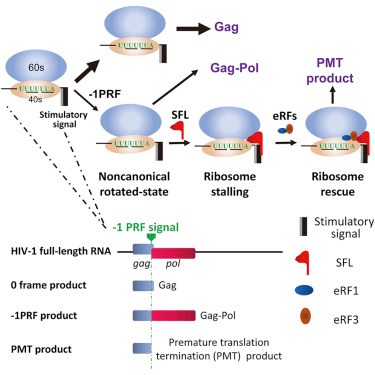
为了探究Shiftless的作用机制,高光侠课题组分析了Shiftless与-1PRF RNA和翻译中的核糖体之间的相互作用,其中后两者是-1PRF过程中的两个关键因素。Shiftless与后两者之间相互作用。基于这一结果,他们猜测Shiftless与翻译中的核糖体和-1PRF RNA同时结合可能使核糖体陷入一种非生产性状态,从而停滞在-1PRF RNA上。停滞的核糖体应当通过质量控制机制加以拯救,从而导致过早翻译终止。
4.Nature:新方法可精确测量潜伏性HIV病毒库大小,比现有方法准确10到100倍
Nature, 07 February 2019, doi:10.1038/s41586-019-0898-8
在一项新的研究中,美国约翰霍普金斯大学医学院的Robert Siliciano博士及其同事们开发出一种新型遗传技术,从而能够快速准确地计算出潜伏在患者细胞中的没有活性的HIV形式,这是评估新型HIV疗法有效性的一个关键部分。这种潜伏性HIV形式整合到细胞的基因组中,即便患者接受成功的治疗,它们也能够持续存在,这就阻碍了治愈HIV感染的努力。根据他们的报道,之前的工具将这种潜伏性HIV数量过高估计了10到100倍,这可能掩盖了实验性疗法产生的有意义的下降。尽管实现HIV治愈可能仍然需要很长的路要走,但是至少从目前而言,这项新的研究取得了重要的进展。相关研究结果发表在2019年2月7日的Nature期刊上,论文标题为“A quantitative approach for measuring the reservoir of latent HIV-1 proviruses”。
Siliciano团队通过使用两种不同颜色的荧光探针,设计出能够区分缺陷的HIV病毒模板和完整的HIV病毒模板的PCR反应。这些探针靶向的HIV病毒DNA区域容易发生能够导致HIV模板缺陷的突变,而颜色读出值能够指示HIV遗传指令是否存在缺陷。这意味着科学家们能够利用这种新技术来评估某种干预措施---比如实验性药物或药物混合物---是否正在影响实际上威胁患者生命的潜伏性HIV遗传指令库。
5.Nature:重磅!科学家发现全球第二例被彻底治愈的HIV感染者!
Nature, Published online: 05 March 2019, doi:10.1038/s41586-019-1027-4
在全球首例艾滋病患者被成功治愈的10年后,近日,来自剑桥大学等机构研究人员发现,一名被称为“伦敦病人”(London patient)的男性已经将近19个月没有出现HIV感染的迹象了,相关研究成果刊登于国际杂志Nature上。研究者表示,这位英国伦敦的HIV感染男性接受了HIV抵抗患者的骨髓移植,其很可能成为世界上第二名已知的被成功去除HIV的患者。
2003年这名英国男子感染了HIV,然而在2012年时其被诊断患有霍奇金淋巴瘤,2016年该男子病情加剧,随后医生们决定为其进行匹配的移植手术用来治疗霍奇金淋巴瘤,移植手术的捐献者机体中携带有一种名为“CCR5 delta 32”的基因突变,该突变能帮助机体有效抵 御HIV,当接受了来自捐赠者的干细胞移植后,这名英国男子机体中的HIV竟然被消除了。
研究者认为,柏林病人的治愈并不是一种反常现象,目前他们并不清楚CCR5抗性是否是患者HIV被清除的关键,携带CCR5基因突变的人群极少,仅有10%的欧洲人群携带CCR5基因突变,加上造血干细胞移植还需要配型,因此一般人希望依靠该CCR5基因突变彻底治愈疾病还有待进一步研究。
6.NEJM:重大进展!新抗体可以抑制HIV长达4个月!且不会产生耐药性!
NEJM, 18 April 2019, doi:10.1056/NEJMoa1802264
根据一项新的研究,对于正在经历短期暂停抗逆转录病毒疗法(ART)方案的病人而言,定期注入一种可以阻断艾滋病毒在人类免疫细胞的结合位点的抗体可以在长达四个月的时间里抑制艾滋病毒水平。II期开放性临床研究结果表明,这种名为UB-421的抗体是安全的,不会诱导产生具有抗体耐药性的艾滋病毒。
29名HIV病毒控制良好的志愿者在第一次注射或一周后停止了他们的日常口服抗逆转录病毒药物治疗方案。14名研究参与者每周定期注射8次UB-421, 15名参与者每隔一周注射8次高剂量UB-421。在8或16周的治疗期结束时,所有志愿者重新开始他们之前的ART方案,并在8周后的随访中进行评估。除了一名由于轻微皮疹而停止研究的参与者外,两组志愿者在没有抗逆转录病毒治疗的整个治疗期间都保持了艾滋病毒抑制的良好状态(血浆艾滋病毒RNA水平低于20拷贝/毫升)。
7.EBioMedicine:重磅!史上首次利用经过编程的MDC1细胞逼迫潜伏的HIV现身并杀死它
EBioMedicine, Published online: 02 April 2019, doi:10.1016/j.ebiom.2019.03.077
在治愈HIV病毒感染的第一次尝试中,来自美国匹兹堡大学公共卫生研究生院的研究人员报道他们开发出一种一体化的免疫治疗方法,该方法不仅能够将隐藏在免疫系统中的HIV赶出来,而且还能够杀死它。这种方法的关键在于免疫细胞经设计后可识别一种完全不同的病毒。他们对“抗原呈递1型极化的单核细胞来源的树突细胞(antigen-presenting type 1-polarized, monocyte-derived dendritic cell, MDC1)”进行改造,这些经过改造的MDC1细胞(monocyte-derived在实验室中经激发后寻找和激活CMV特异性的T细胞,而且他们认为这些特异性的T细胞也可能含有潜伏性的HIV。
当将MDC1细胞添加回到含有潜伏性HIV的辅助性T细胞中时,它们会像预期的那样逆转这种潜伏性,从而使得这种病毒无法隐藏。不用加入任何其他的药物或疗法,MDC1细胞能够招募杀伤性T细胞来清除这些受到HIV感染的细胞。仅通过MDC1细胞,就实现先赶出后杀死HIV病毒。这是首次研究对树突细胞进行编程,使得它们结合CMV来将潜伏性的HIV赶出,同时也会获得杀伤作用。
这一发现是在实验室里使用来自HIV感染者的免疫细胞取得的,尚未在临床试验中进行测试,但是它可能会导致人们开发出一种疫苗以便让HIV感染者无需每日服用药物就可控制这种病毒。
8.JEM:利用CRISPR/Cas9对B细胞进行基因编辑有望开发出HIV疫苗
JEM, Published online: 11 April 2019, doi:10.1084/jem.20190287
在大多数情形下,人体不能自然地保护自己免受HIV病毒感染。但是,在极少数情况下,受感染的个体会产生对抗这种病毒的广泛中和抗体(bNAb)。如今,在一项新的研究中,来自美国洛克菲勒大学的研究人员设计出一种方法,将这种对抗HIV的能力赋予给普通的免疫细胞。他们使用CRISPR-Cas9基因编辑技术来修饰B细胞,即一种分泌抗体的白细胞。具体而言,他们对小鼠B细胞进行基因改造,使得它们自己产生人bNAb。他们发现,以这种方式发生改变的B细胞产生的抗体水平足以保护小鼠免受HIV感染,这表明这种技术最终可能用作一种免疫工具。
虽然这项研究仍处于早期阶段,但是它证实了通过基因编辑增强免疫应答的可行性。重要的是,这种技术不会影响生殖细胞,因而避免了有时由CRISPR干预引起的伦理问题。如果能够实现,这种新的免疫方法不仅可以用于治疗HIV感染,而且还可以用于治疗任何对特定抗 体敏感的疾病。
9.Lancet:临床研究表明抗逆转录病毒治疗可抑制HIV传播
Lancet, Published online: 2 May 2019, doi:10.1016/S0140-6736(19)30418-0
在一项新的称为PARTNER的临床研究中,来自英国、德国、西班牙、法国、瑞士、丹麦、奥地利、芬兰、荷兰、瑞典、意大利和比利时的研究人员报道在782对男同性恋伴侣中,对每对男同性恋伴侣而言,有一人是HIV阳性的,并且接受抗逆转录病毒药物(ART)治疗,结果就是没有人在不使用避孕套的性行为中将HIV病毒传染给HIV呈阴性的伴侣。他们在论文中写道,“当HIV病毒载量受到抑制时,在男同性恋中通过不使用避孕套的性行为传播HIV的风险实际上是零。”
在这项新的研究中报道的PARTNER临床研究分为两个阶段进行:PARTNER1招募HIV血清检查结果不一致(在每对伴侣中,一个伴侣感染上HIV并且接受抗逆转录病毒药物治疗,另一个则没有感染上HIV)的异性恋伴侣和同性恋伴侣;PARTNER1仅招募HIV血清检查结果不一致的男同性恋伴侣。这些研究人员对这些临床试验参与者进行了平均两年的随访,在此期间,这些参与者报道了他们是否发生了不使用避孕套的性行为。尽管在这项临床研究期间,有15名HIV阴性男性确实感染上HIV,但是这些研究人员在报道中证实基因检测结果表明所感染的HIV病毒毒株来自其他性伴侣感染的不同毒株。
10.Adv Sci:我国科学家发现砒霜或可用于治疗HIV感染
Advanced Science, Published online: 07 May 2019, doi:10.1002/advs.201900319
在一项新的研究中,来自中国科学院广州生物医药与健康研究院、广州医科大学广州第八人民医院、中山大学和英国伦敦国王学院的研究人员证实作为一种砷类矿物质,临床上已被批准用于治疗急性早幼粒细胞白血病(APL)的三氧化二砷(砒霜的主要成分)能够重新激活来自HIV-1感染者和受到猿猴免疫缺陷病毒(SIV)感染的猕猴的CD4+ T细胞中的潜伏前病毒(provirus,也译为原病毒),而且不会发生全身T细胞活化和炎症反应。相关研究结果近期发表在Advanced Science期刊上,论文标题为“Arsenic Trioxide Impacts Viral Latency and Delays Viral Rebound after Termination of ART in Chronically SIV‐Infected Macaques ”。
在这项使用遭受SIVmac239慢性感染的猕猴的概念验证研究中,三氧化二砷与ART治疗联合使用延迟了ART治疗停止后的病毒反弹,减少了CD4+ T细胞中整合的SIV DNA拷贝,并恢复了体内CD4+ T细胞数量。最重要的是,一半的接受三氧化二砷治疗的猕猴在ART治疗停止后至少80天内未显示血浆中可检测到的病毒反弹。从机制上讲,这项新的研究表明CD4+ T细胞的CD4受体和CCR辅助受体在三氧化二砷治疗后受到显著下调,这就降低了前病毒重新激活后对感染的易感性。此外,三氧化二砷治疗后SIV特异性免疫反应的增加可能有助于抑制病毒反弹。
11.Cell:新的HIV疫苗递送策略可增强保护性的免疫反应
Cell, Published online: 09 May 2019, doi:10.1016/j.cell.2019.04.012
在一项新的研究中,来自美国斯克里普斯研究所、拉霍亚免疫学研究所和加州大学圣地亚哥分校等研究机构的研究人员报道一种新的HIV疫苗递送策略似乎在临床前模型中增强保护性的免疫反应。他们发现连续几天小剂量接种HIV疫苗要比一次性接种全部剂量的相同疫苗诱导更强的免疫反应。相关研究结果于2019年5月9日在线发表在Cell期刊上,论文标题为“Slow Delivery Immunization Enhances HIV Neutralizing Antibody and Germinal Center Responses via Modulation of Immunodominance”。
这些研究人员测试了三种疫苗接种策略:一种传统的疫苗,其中这种疫苗是一次性注射;一种“渗透泵(osmotic pump)”策略,在这种策略中,植入物有点像定时释放的药丸缓慢地递送疫苗;一种逐步增加剂量的策略,在这种策略中,动物每隔一天给予部分剂量的疫苗,持续12天。传统的疫苗导致了一种可预测的“糟糕”的免疫反应,这种免疫反应以非中和性抗体为主。令所有人吃惊的是,后面两种缓慢释放的策略不仅导致更多的抗体,而且导致更好的抗体产生。
12.Nature:开发出一种新的HIV免疫原---RC1
Nature, Published online: 29 May 2019, doi:10.1038/s41586-019-1250-z
在一项新的研究中,为了激活表达多克隆抗体库中广泛中和抗体的前体分子的B细胞,来自美国洛克菲勒大学和加州理工学院等研究机构的研究人员开发出一种称为RC1的免疫原,它便于识别HIV-1病毒包膜蛋白表面上的V3(variable loop 3, 可变环3)-聚糖片段(V3-glycan patch)。相关研究结果近期发表在Nature期刊上,论文标题为“Immunization expands B cells specific to HIV-1 V3 glycan in mice and macaques”。
RC1通过在病毒样颗粒上添加聚糖和/或发生多聚化来隐藏非保守的免疫显性区域。用RC1对小鼠、兔子和恒河猴进行免疫触发了靶向V3-聚糖片段的血清学反应。对抗体-包膜蛋白复合物的抗体克隆和它们的低温电镜结构证实,用RC1进行免疫会扩大携带抗V3-聚糖片段抗体的B细胞克隆,这些抗V3-聚糖片段抗体类似于人广泛中和抗体的前体分子。
13.Lancet:大型临床试验表明三种不同的避孕方法在HIV感染风险上没有显著差异
Lancet, Published online: 13 June 2019,doi:10.1016/S0140-6736(19)31288-7
在一项针对7800多名非洲妇女的随机临床试验中,来自ECHO临床试验联盟的研究人员发现相比于宫内铜节育器(copper intrauterine device, IUD)和左旋炔诺孕酮(levonorgestrel, LNG)埋植剂,一种避孕注射剂(肌肉储存型醋酸甲羟孕酮, intramuscular depot medroxyprogesterone acetate, DMPA-IM)没有显著增加HIV感染风险。这项首次在非洲地区进行的随机临床试验的结果与30年流行病学研究的结果---指出某些类型的避孕措施与感染上HIV的风险存在潜在的相关性---相反。
论文共同作者、美国华盛顿大学的Jared Baeten教授说道,“我们的随机临床试验并未发现这些所评估的避孕方法在HIV感染风险上存在显著差异,并且所有的避孕方法在阻止怀孕方面都是安全且高效的。”
14.JAMA:高风险健康人群每日服用HIV预防性药物特鲁瓦达有望遏制HIV的流行
JAMA, 11 June 2019, doi:10.1001/jama.2019.6390
近日,一篇发表在JAMA期刊上的研究报告中,来自加利福尼亚大学的科学家们通过研究表示,对于感染HIV高风险的健康人群而言,临床医生应当每天为其提供HIV预防性药物进行HIV感染的干预。最新版的指导方针旨在帮助美国每年减少大约4万例新发HIV患者。
这种方法称之为“暴露前预防”(PrEP),目前在美国一种名为特鲁瓦达(两种药物组合)的药物被推荐用于HIV感染的预防。美国预防服务工作组表示,PrEP仅适用于高风险感染的人群,这其中就包括有HIV阳性伴侣的人群,没有使用避孕套处于高风险感染的人群以及共用注射器注射毒品的人群等。
15.突破!背靠背两篇Science子刊报道新型减毒HIV疫苗,安全无毒疗效佳!
Science Translational Medicine, 17 July 2019, doi:10.1126/scitranslmed.aaw2603, doi:10.1126/scitranslmed.aaw2607
近日发表在《Science Translational Medicine》杂志上的两篇论文描述了一种表达猴免疫缺陷病毒(SIV)蛋白的恒河猴巨细胞病毒(RhCMV)毒株68-1衍生性病毒载体(下称68-1 RhCMV/SIV)疫苗是如何被减毒或削弱的,以便RhCMV不会轻易传播。这种新的疫苗成功地消灭了59%的接种过疫苗的恒河猴体内的SIV病毒,即HIV的猴子版本。这一结果与早期关于原始非减毒疫苗的结果相似。减毒疫苗产生的免疫力也很持久,因为接种疫苗的12只猴子中有9只在3年后仍能抵抗SIV感染。
这些论文很重要,因为它们总结了之前报道过的独特的CMV载体的功效,该载体具有高度衰减的基因修饰,因此在临床使用中具有潜在的安全性。此外,新研究还表明,大多数接种过疫苗的恒河猴在首次接种SIV疫苗数年后,也可以免受第二次感染。
疫苗毒性减弱是应用于人类的关键。出于安全考虑,没有疫苗使用非减毒活病毒。虽然人类感染巨细胞病毒后通常没有任何问题,但这种病毒可以对免疫系统薄弱的人造成严重破坏,比如器官移植患者。这对孕妇也是危险的,因为它会导致先天缺陷,如婴儿听力损失和小头畸形。
16.Science子刊:细胞入侵抑制剂eCD4-Ig有望抵抗高剂量的HIV病毒攻击
Science Translational Medicine, 24 July 2019, doi:10.1126/scitranslmed.aau5409
在一项新的研究中,美国研究人员研究了一种模拟HIV-1和SIV受体和辅助受体的抗体样细胞入侵抑制剂---eCD4-Ig---阻止SIVmac239感染的能力。eCD4-Ig是一种经过修饰的CD4蛋白。相关研究结果发表在2019年7月24日的期刊上,论文标题为“AAV-delivered eCD4-Ig protects rhesus macaques from high-dose SIVmac239 challenges”。
这些研究人员发现由重组腺相关病毒(AAV)载体表达的rh-eCD4-IgI39N让4只恒河猴完全免受高剂量SIVmac239攻击,相比之下,8只对照恒河猴在相同情形下全部受到感染。然而,表达rh-eCD4-IgI39N的恒河猴最终死于一系列升高的SIVmac239攻击剂量,这一系列升高的攻击剂量分别是感染对照恒河猴的攻击剂量的2倍、8倍、16倍和32倍。尽管接受了更大的攻击剂量,这些rh-eCD4-IgI39N恒河猴的病毒载量峰值和峰值后病毒载量显著低于对照恒河猴。有证据表明从这4只表达rh-eCD4-IgI39N的恒河猴中的3只体内分离出的SIV病毒经历较强的来自rh-eCD4-IgI39N的选择性免疫压力。相比于恒河猴CD4,rh-eCD4-IgI39N发生了点突变。为了逃避这种细胞入侵抑制剂的作用,这些分离出的SIV病毒也发生了突变,所发生的突变位于CD4结合位点。在一只表达rh-eCD4-IgI39N的恒河猴中,它们发生的突变利用了rh-eCD4-IgI39N和恒河猴CD4之间的点突变差异逃避这种细胞入侵抑制剂的作用。其他的逃避途径与这种病毒的适应成本(fitness cost)相关。
17.Science子刊:重大进展!duoCAR-T细胞在确保不被HIV感染的同时高效抑制HIV
Science Translational Medicine, 07 August 2019, doi: 10.1126/scitranslmed.aav5685
在一项新的研究中,来自美国生物技术公司Lentigen、阿尔伯特-爱因斯坦医学院、美国国家癌症研究所、阿拉巴马大学伯明翰分校、伯明翰退伍军人医疗中心和匹兹堡大学的研究人员发现他们构建的duoCAR-T细胞在人源化小鼠模型中有效地抵抗HIV。
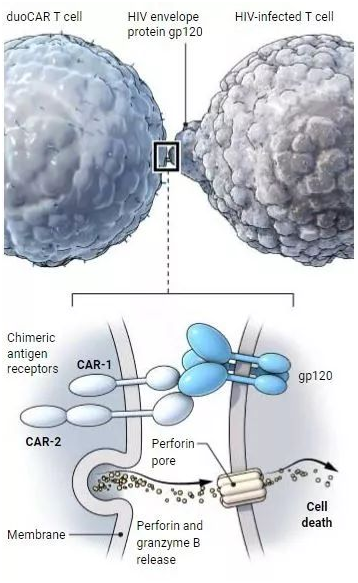
这些研究人员采用了一种更新的方法来使用CAR-T细胞来对抗HIV,让它们的CAR分子加倍。由此所获得的细胞被命名为duoCAR-T细胞。他们报道这种新方法的优势在于它靶向HIV包膜上的多个位点,而不是让T细胞发生改变后以CD4受体作为靶向位点。所使用的这两种特定的CAR分子是在开发40多种慢病毒载体并测试它们以观察哪种慢病毒载体是最有效的过程中发现的。他们报道,在实验室测试时,他们的duoCAR-T细胞消除了大约99%的受感染的免疫细胞品系。当在人类小鼠模型上进行测试时,duoCAR-T细胞的剂量在治疗仅一周后能够抑制97%的HIV感染---远远优于传统的CAR-T细胞。他们还报道,duoCAR-T细胞经证实对HIV感染有抵抗力,这就克服了传统使用CAR-T细胞治疗HIV患者所面临的一个主要问题。最后,他们报道旨在测试这种新方法的有效性和安全性的临床试验计划最早在明年春天开始。
18.最新Science期刊连发三篇文章,指出α4β7抗体并不能维持控制SIV/HIV感染
Science, 06 September 2019, doi:10.1126/science.aav6695; doi:10.1126/science.aaw8562; doi:10.1126/science.aaw7765; doi:10.1126/science.aaz2722
2016年,来自美国国家过敏症和传染病研究所及埃默里大学的一个研究小组通过研究发现在ART治疗期间及之后,将一种靶向结合α4β7整联蛋白的抗体添加到ART治疗之中能够持续控制恒河猴体内SIV病毒的感染状态。
在三个研究小组中,第一个研究小组对2016年那项研究中使用的SIV病毒进行了测序,发现它并不是野生型SIVmac239,而且是一种nef基因出现终止密码子的SIV变体(SIVmac239-nef-stop),并利用α4β7抗体治疗感染上这种SIV变体的恒河猴。第二个研究小组也使用了SIVmac239-nef-stop,但联合使用α4β7抗体和一种针对SIV膜糖蛋白的也阻断SIV病毒结合α4β7整联蛋白的抗体治疗受感染的恒河猴。第三个研究小组使用了一种更常用的致病性SIV病毒,并利用α4β7抗体治疗受感染的恒河猴。然而,这三个研究小组均未发现在停用ART治疗之后,α4β7抗体对受感染的恒河猴体内的病毒控制有任何影响。
19.Nat Med重大突破:发现一种高效长效的HIV抑制剂
Nature Medicine, Published online: 09 September 2019,doi:10.1038/s41591-019-0560-x
近日来自吉利德科学公司的Stephen R. Yant及其同事与来自犹他大学医学院和马萨诸塞大学医学院的合作者一起报告了一种新型的小分子HIV衣壳抑制剂--GS-CA1,这种抑制剂对HIV-2和所有主要HIV-1类型都具有特殊的效力,包括对目前临床使用的抗逆转录病毒药物具有耐药性的病毒变体。
研究人员对其作用机制的研究表明,GS-CA1可以直接与HIV-1衣壳结合,干扰衣壳介导的病毒DNA的核导入、HIV粒子的产生和有序衣壳组装。研究人员发现在体外选择的不适合的对GS-CA1耐药的变异衣壳仍然对其他类型的ARVs完全敏感。
GS-CA1较高的代谢稳定性和较低的溶解度使药物可以在小鼠体内持续释放,因此只需皮下给药一次就具有较好的抗病毒疗效。研究人员在感染HIV-1的人源化小鼠模型中进行的实验发现,GS-CA1作为一种长效注射单药疗法显示出了很高的抗病毒效果,其效果优于长效的利匹韦林。
20.mBio:三十年来鉴定出杀死潜伏性HIV的分子开关
mBio, Published online: 24 September, doi:10.1128/mBio.02016-19
在一项新的研究中,来自美国加州大学圣地亚哥分校医学院的研究人员通过使用基因测序,鉴定出一种控制免疫细胞中HIV增殖的关键细胞因子。关闭或剔除这种细胞因子就可清除休眠的HIV病毒库。相关研究结果于2019年9月24日在线发表在mBio期刊上,论文标题为“The Long Noncoding RNA HEAL Regulates HIV-1 Replication through Epigenetic Regulation of the HIV-1 Promoter”。
他们描述了一种称为HIV-1增强型LncRNA(HIV-1 EnchancedLncRNA, HEAL)的lncRNA。HEAL似乎是一个近期出现的基因,可调节HIV在免疫细胞(比如巨噬细胞、小神经胶质细胞和T细胞)中的复制。通过联合使用基因组、生化和细胞方法,他们发现当停止ART治疗时,利用CRISPR-Cas9沉默HEAl或者移除它可阻止HIV反弹。还需开展进一步的研究,以便在动物模型中证实这些作用。
21.NEJM:世界首例!中国科学家找到治疗艾滋病和白血病新方法!
NEJM, 26 September 2019, doi:10.1016/j.cell.2019.10.002
近日,一项刊登在国际杂志The New England Journal of Medicine上的研究报告中,来自北京大学-清华大学生命科学联合中心邓宏魁研究组、解放军总医院第五医学中心陈虎研究组及首都医科大学附属北京佑安医院吴昊研究组的研究人员通过联合研究发表了题为“CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia”(利用CRISPR基因编辑的成体造血干细胞在患有艾滋病合并急性淋巴细胞白血病患者中的长期重建)的研究论文,这项研究成果标志着世界上首例通过基因编辑干细胞治疗艾滋病和白血病患者的案例由我国科学家成功完成了!
这项研究中,研究人员报道了利用CRISPR-Cas9基因编辑的CCR5突变的HSPCs成功对感染HIV-1合并ALL的患者进行同种异体移植的案例,供体细胞完全嵌合,移植HSPCs后患者的ALL在19个月内能够保持完全缓解的状态,在此期间,经过修饰的CCR5基因能够持续存在,在骨髓细胞中CCR5突变的范围为5.20%-8.28%,研究结果证明了研究者能够实现CRISPR编辑的同种异体HSPCs的长期移植,然而移植后受体的反应效率或许还不足以达到治愈HIV-1感染的目标。
在研究者19个月的随访观察中,他们发现,CRISPR介导的CCR5剔除效率在骨髓样本中为5.20%-8.28%,同时研究者在多个造血谱系细胞中观察到了CRISPR介导的CCR5剔除的状况,这就表明CCR5剔除/突变的HSPCs能长期移植到患者机体中并发挥相应的作用。尤其是,患者机体中的CD4+ T细胞和CCR5突变体能够持续产生并不断释放到患者的外周血中,而外周血中的CD4+ T细胞的数量也会在患者移植后6个月内逐渐恢复到正常水平,同时患者接受HIV-1感染的治疗还能为其提供机会性的保护。
22.Cell:重大进展!开发出比CAR-T细胞更安全、用途更广的cCAR-T细胞技术
Cell, Published online: 24 October 2019, doi:10.1016/j.cell.2019.10.002
在一项新的研究中,来自美国格拉斯通研究所和Xyphos生物科学公司(Xyphos Biosciences, Inc.)的研究人员描述了一种攻击被HIV感染的细胞的新技术。这种新技术是CAR-T细胞免疫疗法的一种新的改进版本。通过改进使得它具有更大的覆盖范围和多功能性,这种称为convertibleCAR T细胞(cCAR-T)的新技术在多个治疗领域显示出了巨大的前景,特别是在抗击HIV方面,这是因为它可以用来缩小在接受抗逆转录病毒疗法(ART)期间HIV感染者体内持续存在的受感染细胞的库存量。相关研究结果于2019年10月24日在线发表在Cell期刊上,论文标题为“Attacking Latent HIV with convertibleCAR-T Cells, a Highly Adaptable Killing Platform”。论文通讯作者为格拉斯通研究所HIV治愈研究中心主任Warner C. Greene博士。

他们对cCAR-T细胞进行了基因改造,使得这些T细胞可以在其表面上表达受到少量修饰的人类受体蛋白NKG2D。这种受到修饰的NKG2D受体当与它的搭档结合时,可以将这些T细胞变成有效的杀手。它的搭档是一种叫做MIC-A的蛋白质,Xyphos生物科学公司的科学家对它进行了裁剪和修饰,使得它可以与cCAR-T细胞表面上这种经过修饰的NKG2D受体特异性结合。这些科学家随后将它与靶向抗体的底部融合在一起,从而构建出他们称为MicAbody的产物。因此,这种靶向性MicAbody紧密地和唯一地结合cCAR-T细胞。
为了清除潜伏性HIV病毒库,他们一直在实验室中测试称为广泛中和抗体(bNAb)的抗HIV抗体。他们与Xyphos生物科学公司的科学家合作,基于bNAb构建出MicAbody(称为Mic-bNAb),并在各种实验室分析中测试了cCAR-T细胞和Mic-bNAb的组合使用。他们发现cCAR-T细胞与Mic-bNAb的组合使用特异性地杀死了受到感染的CD4 T细胞,但未杀死未感染的细胞。它们仅与Mic-bNAb组合使用时才杀死受感染的细胞,然而,不论是单独使用还是与不靶向HIV的MicAbody组合使用都没有这种效果。
23.Science:重磅!突破性的HIV疫苗设计策略崭露头角
Science, Published online: 31 October 2019, doi:10.1126/science.aax4380
在一项新的研究中,来自美国斯克里普斯研究所等研究机构的研究人员成功地对一种先进的HIV疫苗策略进行了原理验证,这种方法也可能有效地保护人们免受其他致命性传染病的侵害。这种新的疫苗策略集中在刺激免疫系统以产生针对HIV的广泛中和抗体(bnAb)。这些特殊的抗体能够结合到HIV病毒表面上重要的但难以接近的区域,而且这些区域在不同HIV毒株之间的差异并不大,因此它们可以中和许多不同的快速突变的HIV毒株。产生此类抗体的疫苗可以挽救数百万人的生命和节省数十亿美元,并最终可能有助于消除艾滋病这一重大的公共卫生问题。基于一种称为“生殖系靶向(germline targeting)”的概念,这种新的策略可能阻止在全球传播的数百万种不同的病毒毒株。
为了证实这种策略的可行性,Schief和论文共同第一作者、Schief实验室高级科学家Jon Steichen博士首先选择了一种已知的称为BG18的HIV bnAb作为测试案例。通过对BG18与HIV病毒上的靶标结合在一起时的结构研究,这些研究人员鉴定出这种抗体的HIV捕获能力的关键特征。接下来,他们搜索了一个庞大的人类抗体基因数据库,以便寻找产生的抗体与BG18的关键特征天然相同的B细胞。他们随后使用一种复杂的策略来选择和进化一组可能潜在地激活多种BG18样B细胞(BG18-like B cell)的病毒模拟蛋白。这些蛋白最终将作为“免疫原”刺激接受疫苗接种的人体中的BG18样B细胞。对来自HIV阴性人类捐赠者的血液样本进行的测试证实这些研究人员设计出的免疫原与正常循环的具有所需的BG18样特征的B细胞良好地结合。
24.Science子刊:诱导太多Th1细胞产生会破坏HIV疫苗的效力
Science Translational Medicine, 20 November 2019, doi:10.1126/scitranslmed.aav1800
如果HIV疫苗引起错误的免疫反应,则这种疫苗接种可能适得其反。如今,在一项新的研究中,来自美国埃默里大学等研究机构的研究人员从利用与HIV病毒存在紧密亲缘关系的SIV病毒开展的几项非人灵长类动物研究中收集到证据表明构建太多的软靶标(soft target)会削弱旨在提供预防病毒感染的疫苗接种。HIV靶向协助身体产生抗病毒免疫反应的辅助性T细胞(Th细胞)并在它们当中复制。他们发现至关重要的是,针对HIV的疫苗不能为这种病毒建立更多的安全避风港。相关研究结果发表在2019年11月20日的Science Translational Medicine期刊上,论文标题为“Strong TH1-biased CD4 T cell responses are associated with diminished SIV vaccine efficacy”。
当疫苗接种产生太多特定类型的I型辅助性T细胞(Th1细胞)时,就会出现问题。这些细胞迁移到粘膜组织,比如直肠、子宫颈和阴道,在大多数感染中,HIV/SIV首先就从粘膜组织进入人体。这些Th1细胞好比是应对僵尸攻击的第一批反应者。它们最初对抗HIV病毒,但随后被这种病毒接管。论文通讯作者、埃默里大学耶克斯国家灵长类动物研究中心研究员Rama Rao Amara博士说,人们需要的是Tfh细胞,它们停留在淋巴结中,并协助免疫系统产生针对这种病毒的抗体。他说,“我们并不是说Th1细胞是坏的。但是,如果你有太多的Th1细胞,它们会使得疫苗无法产生有效的保护。”
25.Science子刊:临床试验表明抗原竞争会破坏HIV疫苗的效力
Science Translational Medicine, 20 November 2019, doi:10.1126/scitranslmed.aaw1673
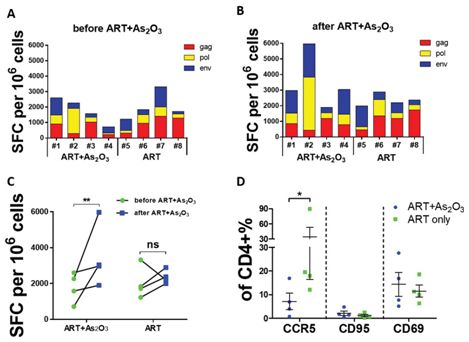
在一项新的临床研究中,来自美国、巴西、秘鲁和瑞士的研究人员给研究参与者仅接种HIV 抗原Gag/Pol,或者同时接种HIV 抗原Gag/Pol和Env,以便观察抗原竞争是否会干扰CD4 T细胞反应。他们发现当同时接种Gag/Pol和Env时,检测到的针对Gag/Pol的CD4 T细胞反应较低,这表明在疫苗中包含多种抗原可能会阻止最大的T细胞反应。相关研究结果发表在2019年11月20日的Science Translational Medicine期刊上,论文标题为“Antigenic competition in CD4+ T cell responses in a randomized, multicenter, double-blind clinical HIV vaccine trial”。
具体而言,这项称为HVTN 084的临床研究,是一项随机、多中心、双盲1期临床试验,旨在研究Gag/Pol疫苗中添加Env是否会降低Gag/Pol特异性T细胞反应的幅度或广度。五十名志愿者每人肌肉内注射一次1×1010颗粒单位(PU)的rAd5 Gag/Pol和EnvA/B/C(按照3:1:1:1比例混合在一起)或5×109颗粒单位的rAd5 Gag/Pol。在未接种Env的疫苗接种组中,疫苗接种后4周通过细胞因子表达衡量的CD4+ T细胞反应显著高于接种Env的疫苗接种组,不过这两个疫苗接种组之间的CD8+ T细胞反应没有显著差异。他们进一步揭示与Gag/Pol和Env共免疫接种相比,在不存在Env的情况下,Gag/Pol特异性T细胞反应的广度更大。向Gag/Pol疫苗中添加Env抗原导致针对Gag/Pol的CD4+ T细胞反应率和幅度降低,以及抗原表位的宽度也下降了,这就证实了抗原竞争的存在。(生物谷 Bioon.com)
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
迄今为止,全世界只报道了仅有的一名“柏林病人”Timothy Ray Brown被认为完全治愈了HIV。2007年,Brown在德国一家医院接受通过CCR5△32/CCR5△32基因型造血干细胞移植治疗白血病后,他体内的HIV病毒也完全消失了,成为世界上首例被“治愈”的艾滋病患者。2019年3月,一名被称为“伦敦病人”(London patient)的男性患者接受了HIV抵抗患者的骨髓移植后已经将近19个月没有出现HIV感染的迹象了,他很可能成为世界上第二名已知的被成功去除HIV的患者。
在即将过去的2019年,科学家们在HIV的风险因素、致病机制、检测和治疗等方面取得重大的进展,让我们一起看看这个领域在这一年里取得的重大发现。
1.Nature:重磅!揭示HIV招募FTSJ3逃避宿主先天免疫识别机制
Nature, Published online: 09 January 2019, doi:10.1038/s41586-018-0841-4
在哺乳动物中,RNA的2'-O-甲基化是细胞的先天免疫系统区分内源性信使RNA(mRNA)和外源性mRNA的一种分子特征。然而,RNA的2'-O-甲基化的分子功能尚未得到充分的理解。在一项新的研究中,法国研究人员纯化出TAR RNA结合蛋白(TRBP)、它的相互作用搭档,并鉴定出一种不依赖于DICER的含有FTSJ3的TRBP复合物,其中据推测,FTSJ3是一种2'-O-甲基化转移酶(2′O-MTase)。 体外和体内实验表明FTSJ3就是一种通过TRBP被招募到HIV RNA上的2'-O-甲基化转移酶。通过使用RiboMethSeq分析,这些研究人员在HIV基因组的特定位点上鉴定出主要依赖于FTSJ3的2'-O-甲基化。

图片来自CDC/C. Goldsmith, P. Feorino, E. L. Palmer, W. R. McManus. CC BY 0。
在FTSJ3敲低细胞(指的是FTSJ3基因表达受到抑制的细胞)中产生的HIV-1病毒表现出减少的2'-O-甲基化,并通过RNA传感蛋白MDA触发人树突细胞中的1型干扰素表达。由此诱导的IFN-α和IFN-β表达导致HIV表达下降。
2.Science:揭示先天免疫系统介导的HIV纳米颗粒免疫原靶向生发中心机制
Science, 08 February 2019, doi:10.1126/science.aat9120
在一项新的研究中,来自美国麻省理工学院等多家研究机构的研究人员比较了两种不同的发生高度糖基化的HIV抗原---一种源自gp120的小蛋白和一种较大的保持稳定的包膜蛋白(Env)三聚体---在以蛋白纳米颗粒形式或者以游离形式存在时在初次免疫后的命运。不同于单体抗原的是,纳米颗粒抗原被快速地运送到滤泡树突细胞(follicular dendritic cell, FDC)网络,随后以依赖于补体、甘露糖结合凝集素(mannose-binding lectin, MBL)和免疫原聚糖(immunogen glycan)的形式聚集在生发中心。
这些研究人员随后发现在缺乏MBL的小鼠中,免疫原不能定位到FDC细胞中或者让免疫原去糖基化都会显著地影响抗体反应。这些结果在HIV疫苗开发的背景下尤其令人关注,这是因为在现存的HIV疫苗开发过程中,致密的HIV包膜“聚糖屏障(glycan shield)”通常被视为实现高效的抗体反应的障碍。
3. Cell:中科院高光侠课题组揭示新型抗病毒因子抑制HIV-1程序性-1核糖体移码机制
Cell, 24 January 2019, doi:10.1016/j.cell.2018.12.030
HIV-1使用程序性-1核糖体移码(programmed -1 ribosomal frameshifting, -1PRF)来产生病毒复制所必需的Gag和Gag-Pol。中国科学院生物物理研究所的高光侠(GAO Guangxia)及其课题组报道了一种抑制-1PRF的新型宿主抗病毒因子,他们称之为Shiftless。

图片来自Cell, doi:10.1016/j.cell.2018.12.030。
为了探究Shiftless的作用机制,高光侠课题组分析了Shiftless与-1PRF RNA和翻译中的核糖体之间的相互作用,其中后两者是-1PRF过程中的两个关键因素。Shiftless与后两者之间相互作用。基于这一结果,他们猜测Shiftless与翻译中的核糖体和-1PRF RNA同时结合可能使核糖体陷入一种非生产性状态,从而停滞在-1PRF RNA上。停滞的核糖体应当通过质量控制机制加以拯救,从而导致过早翻译终止。
4.Nature:新方法可精确测量潜伏性HIV病毒库大小,比现有方法准确10到100倍
Nature, 07 February 2019, doi:10.1038/s41586-019-0898-8
在一项新的研究中,美国约翰霍普金斯大学医学院的Robert Siliciano博士及其同事们开发出一种新型遗传技术,从而能够快速准确地计算出潜伏在患者细胞中的没有活性的HIV形式,这是评估新型HIV疗法有效性的一个关键部分。这种潜伏性HIV形式整合到细胞的基因组中,即便患者接受成功的治疗,它们也能够持续存在,这就阻碍了治愈HIV感染的努力。根据他们的报道,之前的工具将这种潜伏性HIV数量过高估计了10到100倍,这可能掩盖了实验性疗法产生的有意义的下降。尽管实现HIV治愈可能仍然需要很长的路要走,但是至少从目前而言,这项新的研究取得了重要的进展。相关研究结果发表在2019年2月7日的Nature期刊上,论文标题为“A quantitative approach for measuring the reservoir of latent HIV-1 proviruses”。
Siliciano团队通过使用两种不同颜色的荧光探针,设计出能够区分缺陷的HIV病毒模板和完整的HIV病毒模板的PCR反应。这些探针靶向的HIV病毒DNA区域容易发生能够导致HIV模板缺陷的突变,而颜色读出值能够指示HIV遗传指令是否存在缺陷。这意味着科学家们能够利用这种新技术来评估某种干预措施---比如实验性药物或药物混合物---是否正在影响实际上威胁患者生命的潜伏性HIV遗传指令库。
5.Nature:重磅!科学家发现全球第二例被彻底治愈的HIV感染者!
Nature, Published online: 05 March 2019, doi:10.1038/s41586-019-1027-4
在全球首例艾滋病患者被成功治愈的10年后,近日,来自剑桥大学等机构研究人员发现,一名被称为“伦敦病人”(London patient)的男性已经将近19个月没有出现HIV感染的迹象了,相关研究成果刊登于国际杂志Nature上。研究者表示,这位英国伦敦的HIV感染男性接受了HIV抵抗患者的骨髓移植,其很可能成为世界上第二名已知的被成功去除HIV的患者。

图片来自CDC/WHO/UNAIDS/Avert.org/amfar.org/merckmanuals.com。
2003年这名英国男子感染了HIV,然而在2012年时其被诊断患有霍奇金淋巴瘤,2016年该男子病情加剧,随后医生们决定为其进行匹配的移植手术用来治疗霍奇金淋巴瘤,移植手术的捐献者机体中携带有一种名为“CCR5 delta 32”的基因突变,该突变能帮助机体有效抵 御HIV,当接受了来自捐赠者的干细胞移植后,这名英国男子机体中的HIV竟然被消除了。
研究者认为,柏林病人的治愈并不是一种反常现象,目前他们并不清楚CCR5抗性是否是患者HIV被清除的关键,携带CCR5基因突变的人群极少,仅有10%的欧洲人群携带CCR5基因突变,加上造血干细胞移植还需要配型,因此一般人希望依靠该CCR5基因突变彻底治愈疾病还有待进一步研究。
6.NEJM:重大进展!新抗体可以抑制HIV长达4个月!且不会产生耐药性!
NEJM, 18 April 2019, doi:10.1056/NEJMoa1802264
根据一项新的研究,对于正在经历短期暂停抗逆转录病毒疗法(ART)方案的病人而言,定期注入一种可以阻断艾滋病毒在人类免疫细胞的结合位点的抗体可以在长达四个月的时间里抑制艾滋病毒水平。II期开放性临床研究结果表明,这种名为UB-421的抗体是安全的,不会诱导产生具有抗体耐药性的艾滋病毒。
29名HIV病毒控制良好的志愿者在第一次注射或一周后停止了他们的日常口服抗逆转录病毒药物治疗方案。14名研究参与者每周定期注射8次UB-421, 15名参与者每隔一周注射8次高剂量UB-421。在8或16周的治疗期结束时,所有志愿者重新开始他们之前的ART方案,并在8周后的随访中进行评估。除了一名由于轻微皮疹而停止研究的参与者外,两组志愿者在没有抗逆转录病毒治疗的整个治疗期间都保持了艾滋病毒抑制的良好状态(血浆艾滋病毒RNA水平低于20拷贝/毫升)。
7.EBioMedicine:重磅!史上首次利用经过编程的MDC1细胞逼迫潜伏的HIV现身并杀死它
EBioMedicine, Published online: 02 April 2019, doi:10.1016/j.ebiom.2019.03.077
在治愈HIV病毒感染的第一次尝试中,来自美国匹兹堡大学公共卫生研究生院的研究人员报道他们开发出一种一体化的免疫治疗方法,该方法不仅能够将隐藏在免疫系统中的HIV赶出来,而且还能够杀死它。这种方法的关键在于免疫细胞经设计后可识别一种完全不同的病毒。他们对“抗原呈递1型极化的单核细胞来源的树突细胞(antigen-presenting type 1-polarized, monocyte-derived dendritic cell, MDC1)”进行改造,这些经过改造的MDC1细胞(monocyte-derived在实验室中经激发后寻找和激活CMV特异性的T细胞,而且他们认为这些特异性的T细胞也可能含有潜伏性的HIV。

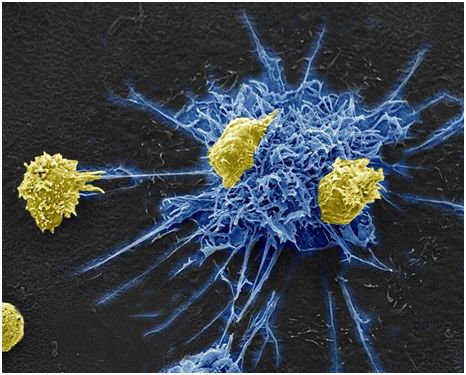
MDC1细胞(蓝色)给携带潜伏性HIV的辅助性T细胞(黄色)传递信号,图片来自Donna Stolz, Ph.D./University of Pittsburgh, Center for Biologic Imaging。
当将MDC1细胞添加回到含有潜伏性HIV的辅助性T细胞中时,它们会像预期的那样逆转这种潜伏性,从而使得这种病毒无法隐藏。不用加入任何其他的药物或疗法,MDC1细胞能够招募杀伤性T细胞来清除这些受到HIV感染的细胞。仅通过MDC1细胞,就实现先赶出后杀死HIV病毒。这是首次研究对树突细胞进行编程,使得它们结合CMV来将潜伏性的HIV赶出,同时也会获得杀伤作用。
这一发现是在实验室里使用来自HIV感染者的免疫细胞取得的,尚未在临床试验中进行测试,但是它可能会导致人们开发出一种疫苗以便让HIV感染者无需每日服用药物就可控制这种病毒。
8.JEM:利用CRISPR/Cas9对B细胞进行基因编辑有望开发出HIV疫苗
JEM, Published online: 11 April 2019, doi:10.1084/jem.20190287
在大多数情形下,人体不能自然地保护自己免受HIV病毒感染。但是,在极少数情况下,受感染的个体会产生对抗这种病毒的广泛中和抗体(bNAb)。如今,在一项新的研究中,来自美国洛克菲勒大学的研究人员设计出一种方法,将这种对抗HIV的能力赋予给普通的免疫细胞。他们使用CRISPR-Cas9基因编辑技术来修饰B细胞,即一种分泌抗体的白细胞。具体而言,他们对小鼠B细胞进行基因改造,使得它们自己产生人bNAb。他们发现,以这种方式发生改变的B细胞产生的抗体水平足以保护小鼠免受HIV感染,这表明这种技术最终可能用作一种免疫工具。
虽然这项研究仍处于早期阶段,但是它证实了通过基因编辑增强免疫应答的可行性。重要的是,这种技术不会影响生殖细胞,因而避免了有时由CRISPR干预引起的伦理问题。如果能够实现,这种新的免疫方法不仅可以用于治疗HIV感染,而且还可以用于治疗任何对特定抗 体敏感的疾病。
9.Lancet:临床研究表明抗逆转录病毒治疗可抑制HIV传播
Lancet, Published online: 2 May 2019, doi:10.1016/S0140-6736(19)30418-0
在一项新的称为PARTNER的临床研究中,来自英国、德国、西班牙、法国、瑞士、丹麦、奥地利、芬兰、荷兰、瑞典、意大利和比利时的研究人员报道在782对男同性恋伴侣中,对每对男同性恋伴侣而言,有一人是HIV阳性的,并且接受抗逆转录病毒药物(ART)治疗,结果就是没有人在不使用避孕套的性行为中将HIV病毒传染给HIV呈阴性的伴侣。他们在论文中写道,“当HIV病毒载量受到抑制时,在男同性恋中通过不使用避孕套的性行为传播HIV的风险实际上是零。”
在这项新的研究中报道的PARTNER临床研究分为两个阶段进行:PARTNER1招募HIV血清检查结果不一致(在每对伴侣中,一个伴侣感染上HIV并且接受抗逆转录病毒药物治疗,另一个则没有感染上HIV)的异性恋伴侣和同性恋伴侣;PARTNER1仅招募HIV血清检查结果不一致的男同性恋伴侣。这些研究人员对这些临床试验参与者进行了平均两年的随访,在此期间,这些参与者报道了他们是否发生了不使用避孕套的性行为。尽管在这项临床研究期间,有15名HIV阴性男性确实感染上HIV,但是这些研究人员在报道中证实基因检测结果表明所感染的HIV病毒毒株来自其他性伴侣感染的不同毒株。
10.Adv Sci:我国科学家发现砒霜或可用于治疗HIV感染
Advanced Science, Published online: 07 May 2019, doi:10.1002/advs.201900319
在一项新的研究中,来自中国科学院广州生物医药与健康研究院、广州医科大学广州第八人民医院、中山大学和英国伦敦国王学院的研究人员证实作为一种砷类矿物质,临床上已被批准用于治疗急性早幼粒细胞白血病(APL)的三氧化二砷(砒霜的主要成分)能够重新激活来自HIV-1感染者和受到猿猴免疫缺陷病毒(SIV)感染的猕猴的CD4+ T细胞中的潜伏前病毒(provirus,也译为原病毒),而且不会发生全身T细胞活化和炎症反应。相关研究结果近期发表在Advanced Science期刊上,论文标题为“Arsenic Trioxide Impacts Viral Latency and Delays Viral Rebound after Termination of ART in Chronically SIV‐Infected Macaques ”。

图片来自Advanced Science, 2019, doi:10.1002/advs.201900319。
在这项使用遭受SIVmac239慢性感染的猕猴的概念验证研究中,三氧化二砷与ART治疗联合使用延迟了ART治疗停止后的病毒反弹,减少了CD4+ T细胞中整合的SIV DNA拷贝,并恢复了体内CD4+ T细胞数量。最重要的是,一半的接受三氧化二砷治疗的猕猴在ART治疗停止后至少80天内未显示血浆中可检测到的病毒反弹。从机制上讲,这项新的研究表明CD4+ T细胞的CD4受体和CCR辅助受体在三氧化二砷治疗后受到显著下调,这就降低了前病毒重新激活后对感染的易感性。此外,三氧化二砷治疗后SIV特异性免疫反应的增加可能有助于抑制病毒反弹。
11.Cell:新的HIV疫苗递送策略可增强保护性的免疫反应
Cell, Published online: 09 May 2019, doi:10.1016/j.cell.2019.04.012
在一项新的研究中,来自美国斯克里普斯研究所、拉霍亚免疫学研究所和加州大学圣地亚哥分校等研究机构的研究人员报道一种新的HIV疫苗递送策略似乎在临床前模型中增强保护性的免疫反应。他们发现连续几天小剂量接种HIV疫苗要比一次性接种全部剂量的相同疫苗诱导更强的免疫反应。相关研究结果于2019年5月9日在线发表在Cell期刊上,论文标题为“Slow Delivery Immunization Enhances HIV Neutralizing Antibody and Germinal Center Responses via Modulation of Immunodominance”。
这些研究人员测试了三种疫苗接种策略:一种传统的疫苗,其中这种疫苗是一次性注射;一种“渗透泵(osmotic pump)”策略,在这种策略中,植入物有点像定时释放的药丸缓慢地递送疫苗;一种逐步增加剂量的策略,在这种策略中,动物每隔一天给予部分剂量的疫苗,持续12天。传统的疫苗导致了一种可预测的“糟糕”的免疫反应,这种免疫反应以非中和性抗体为主。令所有人吃惊的是,后面两种缓慢释放的策略不仅导致更多的抗体,而且导致更好的抗体产生。
12.Nature:开发出一种新的HIV免疫原---RC1
Nature, Published online: 29 May 2019, doi:10.1038/s41586-019-1250-z
在一项新的研究中,为了激活表达多克隆抗体库中广泛中和抗体的前体分子的B细胞,来自美国洛克菲勒大学和加州理工学院等研究机构的研究人员开发出一种称为RC1的免疫原,它便于识别HIV-1病毒包膜蛋白表面上的V3(variable loop 3, 可变环3)-聚糖片段(V3-glycan patch)。相关研究结果近期发表在Nature期刊上,论文标题为“Immunization expands B cells specific to HIV-1 V3 glycan in mice and macaques”。
RC1通过在病毒样颗粒上添加聚糖和/或发生多聚化来隐藏非保守的免疫显性区域。用RC1对小鼠、兔子和恒河猴进行免疫触发了靶向V3-聚糖片段的血清学反应。对抗体-包膜蛋白复合物的抗体克隆和它们的低温电镜结构证实,用RC1进行免疫会扩大携带抗V3-聚糖片段抗体的B细胞克隆,这些抗V3-聚糖片段抗体类似于人广泛中和抗体的前体分子。
13.Lancet:大型临床试验表明三种不同的避孕方法在HIV感染风险上没有显著差异
Lancet, Published online: 13 June 2019,doi:10.1016/S0140-6736(19)31288-7
在一项针对7800多名非洲妇女的随机临床试验中,来自ECHO临床试验联盟的研究人员发现相比于宫内铜节育器(copper intrauterine device, IUD)和左旋炔诺孕酮(levonorgestrel, LNG)埋植剂,一种避孕注射剂(肌肉储存型醋酸甲羟孕酮, intramuscular depot medroxyprogesterone acetate, DMPA-IM)没有显著增加HIV感染风险。这项首次在非洲地区进行的随机临床试验的结果与30年流行病学研究的结果---指出某些类型的避孕措施与感染上HIV的风险存在潜在的相关性---相反。

关于受HIV感染的T细胞的扫描电镜图,图片来自NIAID。
论文共同作者、美国华盛顿大学的Jared Baeten教授说道,“我们的随机临床试验并未发现这些所评估的避孕方法在HIV感染风险上存在显著差异,并且所有的避孕方法在阻止怀孕方面都是安全且高效的。”
14.JAMA:高风险健康人群每日服用HIV预防性药物特鲁瓦达有望遏制HIV的流行
JAMA, 11 June 2019, doi:10.1001/jama.2019.6390
近日,一篇发表在JAMA期刊上的研究报告中,来自加利福尼亚大学的科学家们通过研究表示,对于感染HIV高风险的健康人群而言,临床医生应当每天为其提供HIV预防性药物进行HIV感染的干预。最新版的指导方针旨在帮助美国每年减少大约4万例新发HIV患者。
这种方法称之为“暴露前预防”(PrEP),目前在美国一种名为特鲁瓦达(两种药物组合)的药物被推荐用于HIV感染的预防。美国预防服务工作组表示,PrEP仅适用于高风险感染的人群,这其中就包括有HIV阳性伴侣的人群,没有使用避孕套处于高风险感染的人群以及共用注射器注射毒品的人群等。
15.突破!背靠背两篇Science子刊报道新型减毒HIV疫苗,安全无毒疗效佳!
Science Translational Medicine, 17 July 2019, doi:10.1126/scitranslmed.aaw2603, doi:10.1126/scitranslmed.aaw2607
近日发表在《Science Translational Medicine》杂志上的两篇论文描述了一种表达猴免疫缺陷病毒(SIV)蛋白的恒河猴巨细胞病毒(RhCMV)毒株68-1衍生性病毒载体(下称68-1 RhCMV/SIV)疫苗是如何被减毒或削弱的,以便RhCMV不会轻易传播。这种新的疫苗成功地消灭了59%的接种过疫苗的恒河猴体内的SIV病毒,即HIV的猴子版本。这一结果与早期关于原始非减毒疫苗的结果相似。减毒疫苗产生的免疫力也很持久,因为接种疫苗的12只猴子中有9只在3年后仍能抵抗SIV感染。

HCMV的分泌蛋白质组和潜伏,图片来自Frontiers in Microbiology, 2016, doi:10.3389/fmicb.2016.00715。
这些论文很重要,因为它们总结了之前报道过的独特的CMV载体的功效,该载体具有高度衰减的基因修饰,因此在临床使用中具有潜在的安全性。此外,新研究还表明,大多数接种过疫苗的恒河猴在首次接种SIV疫苗数年后,也可以免受第二次感染。
疫苗毒性减弱是应用于人类的关键。出于安全考虑,没有疫苗使用非减毒活病毒。虽然人类感染巨细胞病毒后通常没有任何问题,但这种病毒可以对免疫系统薄弱的人造成严重破坏,比如器官移植患者。这对孕妇也是危险的,因为它会导致先天缺陷,如婴儿听力损失和小头畸形。
16.Science子刊:细胞入侵抑制剂eCD4-Ig有望抵抗高剂量的HIV病毒攻击
Science Translational Medicine, 24 July 2019, doi:10.1126/scitranslmed.aau5409
在一项新的研究中,美国研究人员研究了一种模拟HIV-1和SIV受体和辅助受体的抗体样细胞入侵抑制剂---eCD4-Ig---阻止SIVmac239感染的能力。eCD4-Ig是一种经过修饰的CD4蛋白。相关研究结果发表在2019年7月24日的期刊上,论文标题为“AAV-delivered eCD4-Ig protects rhesus macaques from high-dose SIVmac239 challenges”。
这些研究人员发现由重组腺相关病毒(AAV)载体表达的rh-eCD4-IgI39N让4只恒河猴完全免受高剂量SIVmac239攻击,相比之下,8只对照恒河猴在相同情形下全部受到感染。然而,表达rh-eCD4-IgI39N的恒河猴最终死于一系列升高的SIVmac239攻击剂量,这一系列升高的攻击剂量分别是感染对照恒河猴的攻击剂量的2倍、8倍、16倍和32倍。尽管接受了更大的攻击剂量,这些rh-eCD4-IgI39N恒河猴的病毒载量峰值和峰值后病毒载量显著低于对照恒河猴。有证据表明从这4只表达rh-eCD4-IgI39N的恒河猴中的3只体内分离出的SIV病毒经历较强的来自rh-eCD4-IgI39N的选择性免疫压力。相比于恒河猴CD4,rh-eCD4-IgI39N发生了点突变。为了逃避这种细胞入侵抑制剂的作用,这些分离出的SIV病毒也发生了突变,所发生的突变位于CD4结合位点。在一只表达rh-eCD4-IgI39N的恒河猴中,它们发生的突变利用了rh-eCD4-IgI39N和恒河猴CD4之间的点突变差异逃避这种细胞入侵抑制剂的作用。其他的逃避途径与这种病毒的适应成本(fitness cost)相关。
17.Science子刊:重大进展!duoCAR-T细胞在确保不被HIV感染的同时高效抑制HIV
Science Translational Medicine, 07 August 2019, doi: 10.1126/scitranslmed.aav5685
在一项新的研究中,来自美国生物技术公司Lentigen、阿尔伯特-爱因斯坦医学院、美国国家癌症研究所、阿拉巴马大学伯明翰分校、伯明翰退伍军人医疗中心和匹兹堡大学的研究人员发现他们构建的duoCAR-T细胞在人源化小鼠模型中有效地抵抗HIV。

图片来自Science Translational Medicine, 07 August 2019, doi: 10.1126/scitranslmed.aav5685。
这些研究人员采用了一种更新的方法来使用CAR-T细胞来对抗HIV,让它们的CAR分子加倍。由此所获得的细胞被命名为duoCAR-T细胞。他们报道这种新方法的优势在于它靶向HIV包膜上的多个位点,而不是让T细胞发生改变后以CD4受体作为靶向位点。所使用的这两种特定的CAR分子是在开发40多种慢病毒载体并测试它们以观察哪种慢病毒载体是最有效的过程中发现的。他们报道,在实验室测试时,他们的duoCAR-T细胞消除了大约99%的受感染的免疫细胞品系。当在人类小鼠模型上进行测试时,duoCAR-T细胞的剂量在治疗仅一周后能够抑制97%的HIV感染---远远优于传统的CAR-T细胞。他们还报道,duoCAR-T细胞经证实对HIV感染有抵抗力,这就克服了传统使用CAR-T细胞治疗HIV患者所面临的一个主要问题。最后,他们报道旨在测试这种新方法的有效性和安全性的临床试验计划最早在明年春天开始。
18.最新Science期刊连发三篇文章,指出α4β7抗体并不能维持控制SIV/HIV感染
Science, 06 September 2019, doi:10.1126/science.aav6695; doi:10.1126/science.aaw8562; doi:10.1126/science.aaw7765; doi:10.1126/science.aaz2722
2016年,来自美国国家过敏症和传染病研究所及埃默里大学的一个研究小组通过研究发现在ART治疗期间及之后,将一种靶向结合α4β7整联蛋白的抗体添加到ART治疗之中能够持续控制恒河猴体内SIV病毒的感染状态。
在三个研究小组中,第一个研究小组对2016年那项研究中使用的SIV病毒进行了测序,发现它并不是野生型SIVmac239,而且是一种nef基因出现终止密码子的SIV变体(SIVmac239-nef-stop),并利用α4β7抗体治疗感染上这种SIV变体的恒河猴。第二个研究小组也使用了SIVmac239-nef-stop,但联合使用α4β7抗体和一种针对SIV膜糖蛋白的也阻断SIV病毒结合α4β7整联蛋白的抗体治疗受感染的恒河猴。第三个研究小组使用了一种更常用的致病性SIV病毒,并利用α4β7抗体治疗受感染的恒河猴。然而,这三个研究小组均未发现在停用ART治疗之后,α4β7抗体对受感染的恒河猴体内的病毒控制有任何影响。
19.Nat Med重大突破:发现一种高效长效的HIV抑制剂
Nature Medicine, Published online: 09 September 2019,doi:10.1038/s41591-019-0560-x
近日来自吉利德科学公司的Stephen R. Yant及其同事与来自犹他大学医学院和马萨诸塞大学医学院的合作者一起报告了一种新型的小分子HIV衣壳抑制剂--GS-CA1,这种抑制剂对HIV-2和所有主要HIV-1类型都具有特殊的效力,包括对目前临床使用的抗逆转录病毒药物具有耐药性的病毒变体。

图片来自NIAID。
研究人员对其作用机制的研究表明,GS-CA1可以直接与HIV-1衣壳结合,干扰衣壳介导的病毒DNA的核导入、HIV粒子的产生和有序衣壳组装。研究人员发现在体外选择的不适合的对GS-CA1耐药的变异衣壳仍然对其他类型的ARVs完全敏感。
GS-CA1较高的代谢稳定性和较低的溶解度使药物可以在小鼠体内持续释放,因此只需皮下给药一次就具有较好的抗病毒疗效。研究人员在感染HIV-1的人源化小鼠模型中进行的实验发现,GS-CA1作为一种长效注射单药疗法显示出了很高的抗病毒效果,其效果优于长效的利匹韦林。
20.mBio:三十年来鉴定出杀死潜伏性HIV的分子开关
mBio, Published online: 24 September, doi:10.1128/mBio.02016-19
在一项新的研究中,来自美国加州大学圣地亚哥分校医学院的研究人员通过使用基因测序,鉴定出一种控制免疫细胞中HIV增殖的关键细胞因子。关闭或剔除这种细胞因子就可清除休眠的HIV病毒库。相关研究结果于2019年9月24日在线发表在mBio期刊上,论文标题为“The Long Noncoding RNA HEAL Regulates HIV-1 Replication through Epigenetic Regulation of the HIV-1 Promoter”。
他们描述了一种称为HIV-1增强型LncRNA(HIV-1 EnchancedLncRNA, HEAL)的lncRNA。HEAL似乎是一个近期出现的基因,可调节HIV在免疫细胞(比如巨噬细胞、小神经胶质细胞和T细胞)中的复制。通过联合使用基因组、生化和细胞方法,他们发现当停止ART治疗时,利用CRISPR-Cas9沉默HEAl或者移除它可阻止HIV反弹。还需开展进一步的研究,以便在动物模型中证实这些作用。
21.NEJM:世界首例!中国科学家找到治疗艾滋病和白血病新方法!
NEJM, 26 September 2019, doi:10.1016/j.cell.2019.10.002
近日,一项刊登在国际杂志The New England Journal of Medicine上的研究报告中,来自北京大学-清华大学生命科学联合中心邓宏魁研究组、解放军总医院第五医学中心陈虎研究组及首都医科大学附属北京佑安医院吴昊研究组的研究人员通过联合研究发表了题为“CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia”(利用CRISPR基因编辑的成体造血干细胞在患有艾滋病合并急性淋巴细胞白血病患者中的长期重建)的研究论文,这项研究成果标志着世界上首例通过基因编辑干细胞治疗艾滋病和白血病患者的案例由我国科学家成功完成了!
这项研究中,研究人员报道了利用CRISPR-Cas9基因编辑的CCR5突变的HSPCs成功对感染HIV-1合并ALL的患者进行同种异体移植的案例,供体细胞完全嵌合,移植HSPCs后患者的ALL在19个月内能够保持完全缓解的状态,在此期间,经过修饰的CCR5基因能够持续存在,在骨髓细胞中CCR5突变的范围为5.20%-8.28%,研究结果证明了研究者能够实现CRISPR编辑的同种异体HSPCs的长期移植,然而移植后受体的反应效率或许还不足以达到治愈HIV-1感染的目标。
在研究者19个月的随访观察中,他们发现,CRISPR介导的CCR5剔除效率在骨髓样本中为5.20%-8.28%,同时研究者在多个造血谱系细胞中观察到了CRISPR介导的CCR5剔除的状况,这就表明CCR5剔除/突变的HSPCs能长期移植到患者机体中并发挥相应的作用。尤其是,患者机体中的CD4+ T细胞和CCR5突变体能够持续产生并不断释放到患者的外周血中,而外周血中的CD4+ T细胞的数量也会在患者移植后6个月内逐渐恢复到正常水平,同时患者接受HIV-1感染的治疗还能为其提供机会性的保护。
22.Cell:重大进展!开发出比CAR-T细胞更安全、用途更广的cCAR-T细胞技术
Cell, Published online: 24 October 2019, doi:10.1016/j.cell.2019.10.002
在一项新的研究中,来自美国格拉斯通研究所和Xyphos生物科学公司(Xyphos Biosciences, Inc.)的研究人员描述了一种攻击被HIV感染的细胞的新技术。这种新技术是CAR-T细胞免疫疗法的一种新的改进版本。通过改进使得它具有更大的覆盖范围和多功能性,这种称为convertibleCAR T细胞(cCAR-T)的新技术在多个治疗领域显示出了巨大的前景,特别是在抗击HIV方面,这是因为它可以用来缩小在接受抗逆转录病毒疗法(ART)期间HIV感染者体内持续存在的受感染细胞的库存量。相关研究结果于2019年10月24日在线发表在Cell期刊上,论文标题为“Attacking Latent HIV with convertibleCAR-T Cells, a Highly Adaptable Killing Platform”。论文通讯作者为格拉斯通研究所HIV治愈研究中心主任Warner C. Greene博士。

图片来自Cell, 2019, doi:10.1016/j.cell.2019.10.002。
他们对cCAR-T细胞进行了基因改造,使得这些T细胞可以在其表面上表达受到少量修饰的人类受体蛋白NKG2D。这种受到修饰的NKG2D受体当与它的搭档结合时,可以将这些T细胞变成有效的杀手。它的搭档是一种叫做MIC-A的蛋白质,Xyphos生物科学公司的科学家对它进行了裁剪和修饰,使得它可以与cCAR-T细胞表面上这种经过修饰的NKG2D受体特异性结合。这些科学家随后将它与靶向抗体的底部融合在一起,从而构建出他们称为MicAbody的产物。因此,这种靶向性MicAbody紧密地和唯一地结合cCAR-T细胞。
为了清除潜伏性HIV病毒库,他们一直在实验室中测试称为广泛中和抗体(bNAb)的抗HIV抗体。他们与Xyphos生物科学公司的科学家合作,基于bNAb构建出MicAbody(称为Mic-bNAb),并在各种实验室分析中测试了cCAR-T细胞和Mic-bNAb的组合使用。他们发现cCAR-T细胞与Mic-bNAb的组合使用特异性地杀死了受到感染的CD4 T细胞,但未杀死未感染的细胞。它们仅与Mic-bNAb组合使用时才杀死受感染的细胞,然而,不论是单独使用还是与不靶向HIV的MicAbody组合使用都没有这种效果。
23.Science:重磅!突破性的HIV疫苗设计策略崭露头角
Science, Published online: 31 October 2019, doi:10.1126/science.aax4380
在一项新的研究中,来自美国斯克里普斯研究所等研究机构的研究人员成功地对一种先进的HIV疫苗策略进行了原理验证,这种方法也可能有效地保护人们免受其他致命性传染病的侵害。这种新的疫苗策略集中在刺激免疫系统以产生针对HIV的广泛中和抗体(bnAb)。这些特殊的抗体能够结合到HIV病毒表面上重要的但难以接近的区域,而且这些区域在不同HIV毒株之间的差异并不大,因此它们可以中和许多不同的快速突变的HIV毒株。产生此类抗体的疫苗可以挽救数百万人的生命和节省数十亿美元,并最终可能有助于消除艾滋病这一重大的公共卫生问题。基于一种称为“生殖系靶向(germline targeting)”的概念,这种新的策略可能阻止在全球传播的数百万种不同的病毒毒株。
为了证实这种策略的可行性,Schief和论文共同第一作者、Schief实验室高级科学家Jon Steichen博士首先选择了一种已知的称为BG18的HIV bnAb作为测试案例。通过对BG18与HIV病毒上的靶标结合在一起时的结构研究,这些研究人员鉴定出这种抗体的HIV捕获能力的关键特征。接下来,他们搜索了一个庞大的人类抗体基因数据库,以便寻找产生的抗体与BG18的关键特征天然相同的B细胞。他们随后使用一种复杂的策略来选择和进化一组可能潜在地激活多种BG18样B细胞(BG18-like B cell)的病毒模拟蛋白。这些蛋白最终将作为“免疫原”刺激接受疫苗接种的人体中的BG18样B细胞。对来自HIV阴性人类捐赠者的血液样本进行的测试证实这些研究人员设计出的免疫原与正常循环的具有所需的BG18样特征的B细胞良好地结合。
24.Science子刊:诱导太多Th1细胞产生会破坏HIV疫苗的效力
Science Translational Medicine, 20 November 2019, doi:10.1126/scitranslmed.aav1800
如果HIV疫苗引起错误的免疫反应,则这种疫苗接种可能适得其反。如今,在一项新的研究中,来自美国埃默里大学等研究机构的研究人员从利用与HIV病毒存在紧密亲缘关系的SIV病毒开展的几项非人灵长类动物研究中收集到证据表明构建太多的软靶标(soft target)会削弱旨在提供预防病毒感染的疫苗接种。HIV靶向协助身体产生抗病毒免疫反应的辅助性T细胞(Th细胞)并在它们当中复制。他们发现至关重要的是,针对HIV的疫苗不能为这种病毒建立更多的安全避风港。相关研究结果发表在2019年11月20日的Science Translational Medicine期刊上,论文标题为“Strong TH1-biased CD4 T cell responses are associated with diminished SIV vaccine efficacy”。

图片来自CC0 Public Domain。
当疫苗接种产生太多特定类型的I型辅助性T细胞(Th1细胞)时,就会出现问题。这些细胞迁移到粘膜组织,比如直肠、子宫颈和阴道,在大多数感染中,HIV/SIV首先就从粘膜组织进入人体。这些Th1细胞好比是应对僵尸攻击的第一批反应者。它们最初对抗HIV病毒,但随后被这种病毒接管。论文通讯作者、埃默里大学耶克斯国家灵长类动物研究中心研究员Rama Rao Amara博士说,人们需要的是Tfh细胞,它们停留在淋巴结中,并协助免疫系统产生针对这种病毒的抗体。他说,“我们并不是说Th1细胞是坏的。但是,如果你有太多的Th1细胞,它们会使得疫苗无法产生有效的保护。”
25.Science子刊:临床试验表明抗原竞争会破坏HIV疫苗的效力
Science Translational Medicine, 20 November 2019, doi:10.1126/scitranslmed.aaw1673
在一项新的临床研究中,来自美国、巴西、秘鲁和瑞士的研究人员给研究参与者仅接种HIV 抗原Gag/Pol,或者同时接种HIV 抗原Gag/Pol和Env,以便观察抗原竞争是否会干扰CD4 T细胞反应。他们发现当同时接种Gag/Pol和Env时,检测到的针对Gag/Pol的CD4 T细胞反应较低,这表明在疫苗中包含多种抗原可能会阻止最大的T细胞反应。相关研究结果发表在2019年11月20日的Science Translational Medicine期刊上,论文标题为“Antigenic competition in CD4+ T cell responses in a randomized, multicenter, double-blind clinical HIV vaccine trial”。
具体而言,这项称为HVTN 084的临床研究,是一项随机、多中心、双盲1期临床试验,旨在研究Gag/Pol疫苗中添加Env是否会降低Gag/Pol特异性T细胞反应的幅度或广度。五十名志愿者每人肌肉内注射一次1×1010颗粒单位(PU)的rAd5 Gag/Pol和EnvA/B/C(按照3:1:1:1比例混合在一起)或5×109颗粒单位的rAd5 Gag/Pol。在未接种Env的疫苗接种组中,疫苗接种后4周通过细胞因子表达衡量的CD4+ T细胞反应显著高于接种Env的疫苗接种组,不过这两个疫苗接种组之间的CD8+ T细胞反应没有显著差异。他们进一步揭示与Gag/Pol和Env共免疫接种相比,在不存在Env的情况下,Gag/Pol特异性T细胞反应的广度更大。向Gag/Pol疫苗中添加Env抗原导致针对Gag/Pol的CD4+ T细胞反应率和幅度降低,以及抗原表位的宽度也下降了,这就证实了抗原竞争的存在。(生物谷 Bioon.com)
生物谷2019年终盘点正在进行,更多精彩盘点,敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


