2019年终盘点:2019年基因工程领域解读
- AcrIIIB1
- Cas12a
- Cas12b
- Cas9
- Cas9-CP
- CAST
- CasX
- CRISPR
- DISCOVER-Seq
- DNA扭曲
- gRNA
- LiveFISH
- MMEJ
- prime editing
- RESCUE
- RNA编辑
- 基因工程
- 基因编辑
- 基因驱动
- 循环排列
- 微重复
- 早衰症
- 智能材料
- 胞嘧啶碱基编辑器
- 脱靶效应
- 转座酶
来源:本站原创 2019-12-28 05:37
2019年12月1日讯/生物谷BIOON/---基因工程(genetic engineering)又称基因拼接技术和DNA重组技术,是以分子遗传学为理论基础,以分子生物学和微生物学的现代方法为手段,将不同来源的基因按预先设计的蓝图,在体外构建杂种DNA分子,然后导入活细胞,以改变生物原有的遗传特性、获得新品种和生产新产品。基因工程技术为基因的结构和功能的研究提供了有力的手段。基因编辑(gene e
2019年12月1日讯/生物谷BIOON/---基因工程(genetic engineering)又称基因拼接技术和DNA重组技术,是以分子遗传学为理论基础,以分子生物学和微生物学的现代方法为手段,将不同来源的基因按预先设计的蓝图,在体外构建杂种DNA分子,然后导入活细胞,以改变生物原有的遗传特性、获得新品种和生产新产品。基因工程技术为基因的结构和功能的研究提供了有力的手段。
基因编辑(gene editing)是一种新兴的比较精确的能对生物体基因组特定目标基因或者它们的转录本进行修饰的一种基因工程技术。它能够让人类对目标基因或它们的转录本进行定点“编辑”,实现对特定DNA或RNA片段的修饰。

基因编辑技术中,以锌指核酸酶(zinc-finger nucleases, ZFN)和TALEN (transcription activator-like effector nucleases)为代表的序列特异性核酸酶技术以其能够高效率地进行定点基因组编辑,在基因研究、基因治疗和遗传改良等方面展示出了巨大的潜力。CRISPR/Cas是继“锌指核酸内切酶(ZFN)”、“转录激活子样效应因子核酸酶(TALEN)”之后出现的第三代“基因组定点编辑技术”。与前两代技术相比,其成本低、制作简便、快捷高效的优点,让它迅速风靡于世界各地的实验室,成为科研、医疗等领域的有效工具,而且经过不断改进后,更被认为能够在活细胞中最有效、最便捷地“编辑”任何基因。
基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas9是由一种原始的细菌免疫系统改编而成的,它的作用方式是首先在基因组的一个靶位点上切割双链DNA。
在2019年,科学家们在基因编辑等基因工程领域取得重大的进展,让我们一起看看这个领域在这一年里取得的重大发现。
1.基因编辑大牛张锋新力作!发现第三种CRISPR-Cas系统,显著降低脱靶效应
Nature Communications, 22 January 2019, doi:10.1038/s41467-018-08224-4
在一项新的研究中,来自美国布罗德研究所的张锋(Feng Zhang)及其团队着重关注除Cas9和Cas12a(之前称为Cpf1)之外的第三种II型蛋白效应核酸酶:Cas12b,即一种由两个gRNA引导的核酸酶,含有单个结构域:RuvC,其中这两个gRNA为crRNA和tracrRNA。尽管Cas12b蛋白通常比Cas9和Cas12a小,因而从通过病毒载体进行细胞内递送的观点来看具有吸引力,但是得到最好描述的来自嗜酸耐热菌(Alicyclobacillus acidoterrestris)的Cas12b核酸酶(AacCas12b)在48°C时表现出最佳的DNA切割活性,这阻止它在哺乳动物细胞中的应用。张锋团队试图鉴定出在较低温度下有活性的Cas12b家族成员,这样就可用于人类基因组编辑。相关研究结果于2019年1月22日发表在Nature Communications期刊上,论文标题为“Engineering of CRISPR-Cas12b for human genome editing”。
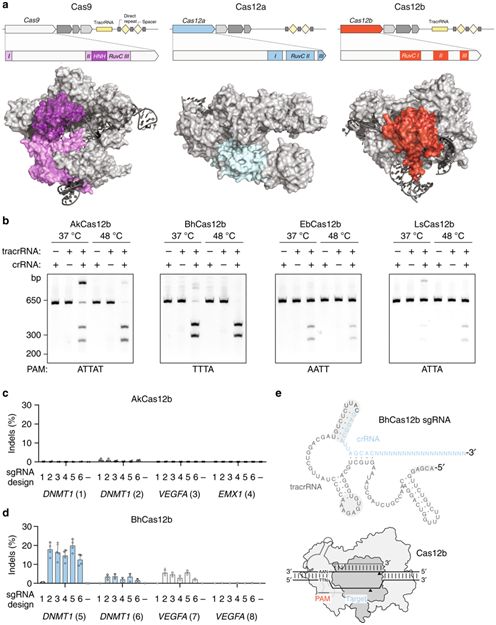
鉴于强效的基因组编辑工具应当在一系列靶标上是高效的和特异性的,张锋团队在针对293T细胞中的5个基因的56个靶位点上测试了BhCas12b v4突变体,结果观察到强效的DNA切割。接着,他们通过电穿孔技术将BhCas12b v4-sgRNA复合物递送到人CD4+ T细胞中。在3个测试的靶位点上,这些复合物表现出的indel发生率为32%~49%。这些数据表明BhCas12b v4突变体在多种基因组编辑环境下(包括一种在治疗上有重大意义的人细胞类型)可作为一种有效的可编程的核酸酶。
2.Nature:重磅!首次成功地在哺乳动物中进行基因驱动
Nature, Published online: 23 January 2019, doi:10.1038/s41586-019-0875-2
基因驱动(gene drive)是一种基因工程技术,它促进后代要比正常情形时更频繁地遗传来自一个亲本的特定等位基因。它已在昆虫中发挥作用。如今,在一项新的研究中,来自美国加州大学圣地亚哥分校的研究人员发现它也能够成功地在脊椎动物中发挥作用。在这项研究中,他们描述了一种方法,它利用CRISPR-Cas9改变雌性小鼠生殖系细胞,从而促进小鼠后代出现白色毛发和表达一种红色荧光蛋白。相关研究结果于2019年1月23日在线发表在Nature期刊上,论文标题为“Super-Mendelian inheritance mediated by CRISPR–Cas9 in the female mouse germline”。
这是首个证据表明基因驱动可在哺乳动物中发挥效果,但是它并不完美。这些研究人员正在优化Cas9在雌性小鼠中产生的时间,并且正在研究更高的效率是否可能解决雄性动物中同源介导修复的缺乏。
3.Cell:给Cas9一个开启开关,从而更好地控制CRISPR基因编辑
Cell, 10 January 2019, doi:10.1016/j.cell.2018.11.052
在一项新的研究中,来自美国加州大学伯克利分校的研究人员利用一种称为循环排列(circular permutation)的技术,构建出一套称为Cas9-CP的新型Cas9变体,这将简化Cas9融合蛋白的设计,使得它们能够用于除了简单的DNA切割之外的多种应用,比如碱基编辑和表观遗传修饰。相关研究结果发表在2019年1月10日的Cell期刊上,论文标题为“CRISPR-Cas9 Circular Permutants as Programmable Scaffolds for Genome Modification”。

通过这个相同的过程,David Savage和他的团队将“永远开启(always-on)”的Cas9分子转变为可激活的开关。这些开关保持在“关闭”位置,直到它们被蛋白酶激活。由此产生的蛋白酶感应的Cas9(protease-sensing Cas9, ProCas9)能够减少脱靶效应并实现分子感应,以及组织或器官特异性的基因组编辑。他们证实ProCas9可用于检测病毒蛋白酶,从而潜在地用作一种能够引发免疫反应的病原体感应系统。
Savage团队使用循环排列来重新设计Cas9的分子序列,因而更好地控制它的活性并为融合蛋白构建更优化的DNA结合支架。这种Cas9重新连接方法涉及将这种蛋白的末端(即它的氨基端和羧基端)与肽接头(peptide linker)连接,同时在不同的位置上分割它的序列,从而产生新的相邻的氨基端和羧基端。
4.重大进展!两篇Nature Medicine揭示一种新型CRISPR/Cas9疗法有望治疗早衰症
Nature Medicine, Published online: 18 February 2019, doi:10.1038/s41591-019-0343-4; doi:10.1038/s41591-018-0338-6
衰老是导致包括心脏病、癌症和阿尔茨海默病在内的许多衰竭性疾病的主要风险因素。这使得对抗衰老疗法的需求变得更加迫切。如今,在第一项新的研究中,来自美国沙克生物研究所的研究人员利用CRISPR/Cas9系统将基因疗法递送到表达Cas9的早衰症小鼠模型的细胞中。在递送这种基因疗法两个月后,这些小鼠变得更强壮和更活跃,而且它们的心血管健康得到改善。它们表现出下降的主要动脉血管退化和延迟的心跳过缓(bradycardia)发作---在早衰症和老年时常见的两个问题。总体而言,这些接受治疗的早衰症小鼠具有与正常小鼠相似的活动水平,而且它们的寿命增加了大约25%。
在第二项新的研究中,西班牙奥维耶多大学的José M. P. Freije、Carlos López-Otín及其团队开也发出一种基于CRISPR/Cas9的疗法来治疗哈钦森-吉尔福德早衰症综合征。对这种疗法的测试结果表明,它通过在LMNA基因中引入移码突变(frameshift mutation)逆转了在哈钦森-吉尔福德早衰症综合征小鼠模型和来自患上这种疾病的患者的细胞中发生的一些有害变化。
5.Nat Biotechnol:开发出更加高效的CRISPR–Cas12a变体
Nature Biotechnology, Published online: 11 February 2019, doi:10.1038/s41587-018-0011-0
在一项新的研究中,来自美国麻省总医院、哈佛医学院和麻省理工学院的研究人员设计了能够靶向更广泛的前间隔序列邻近基序(protospacer adjacent motif, PAM)的Cas12a变体。

这些研究人员报道特别地,一种称为enAsCas12a的变体并不需要扩展的输血传播病毒(extended transfusion-transmissible virus, TTTV)PAM,当然,野生型AsCas12a需要这种TTTV PAM。与AsCas12a野生型相比,这种变体在典型的TTTV PAM存在时平均具有两倍高的基因组编辑活性。它的靶向范围扩大了:增加了七倍。他们进一步报道他们成功地将来自enAsCas12a的一部分突变片段移植到AsCas12a上来改善后者的活性。他们声称,开发出的enAsCas12a允许更高效地进行多重基因编辑,并提供内源性基因激活和C→T碱基编辑。为了降低利用enAsCas12a观察到的高于正常的脱靶效应,他们还设计了另一种称为enAsCas12a-HF1的变体。
6.Nature:科学家发现新型的CRISPR基因编辑工具:CasX
Nature, Published online:04 February 2019, doi:10.1038/s41586-019-0908-x
在短短7年时间里,Cas9已经成为了在人类、植物、动物和细菌中能够被使用的强大基因编辑工具,其能快速并准确地切割和拼接DNA,其也有望帮助开发治疗多种人类疾病的新型疗法。日前,一项刊登在国际杂志Nature上的研究报告中,来自加州大学伯克利分校的科学家们通过研究发现了一种新型的小型CRISPR基因编辑工具:CasX,其与蛋白Cas9较为相似,但比Cas9小很多。
实际上,CasX是细菌和人类细胞中潜在的一种有效基因编辑工具,其似乎是在细菌中进化出的独立于其它Cas蛋白的一种特殊蛋白,CasX能够切割双链DNA,结合DNA并调节基因的表达,同时还能靶向作用特殊的DNA序列。由于CasX来自于细菌细胞中,因此相比Cas9而言,人类机体免疫系统或许能够更加容易地接纳CasX。
7.我国科学家在两篇Science论文上揭示胞嘧啶碱基编辑器诱导大量的脱靶突变
Science, Published online:28 February 2019, doi:10.1126/science.aaw7166; doi:10.1126/science.aav9973
在第一项新的研究中,中国科学院的李亦学(Yixue Li)课题组、杨辉(Hui Yang)课题组和美国斯坦福大学的Lars M. Steinmetz课题组开发出一种称为GOTI(genome-wide off-target analysis by two-cell embryo injection)的方法来评估三种经常使用的基因编辑工具---CRISPR/Cas9、胞嘧啶碱基编辑器3(BE3, rAPOBEC1-nCas9-UGI)、腺嘌呤碱基编辑器7.10(ABE7.10, TadA-TadA*-nCas9)---诱导的脱靶效应。他们发现在经过BE3编辑的细胞中鉴定出的90%以上的单核苷酸变异(SNV)是G>A或C>T,这一突变偏好并没有在经过Cre、Cas9或ABE7.10处理的细胞中观察到。这一突变偏好与APOBEC1本身的突变偏好相同,这表明这些突变并不是自发的而是由BE3编辑诱导的。
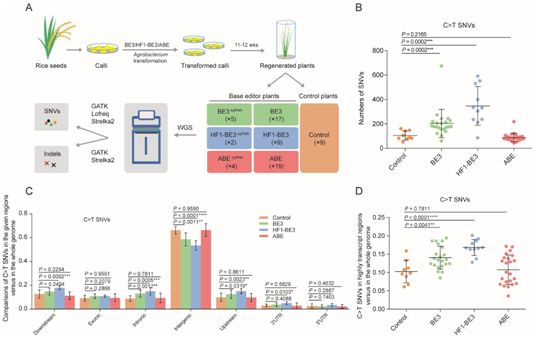
在第二项新的研究中,中国科学院的高彩霞(Caixia Gao)课题组通过对作为一种重要的作物物种的水稻进行全基因组测序对胞嘧啶碱基编辑器(BE3和HF1-BE3)和腺嘌呤碱基编辑器(ABE)产生的脱靶突变进行全面调查。他们发现胞嘧啶碱基编辑器(BE3和HF1-BE3)诱导全基因组脱靶突变。这些脱靶突变主要是C>T单核苷酸变异,在转录的基因区域中富集,通过当前的计算机方法是无法预测的。
8. Nature子刊:当心!DNA扭曲增加CRISPR-Cas9脱靶编辑风险
Nature Structural and Molecular Biology, March 2019, doi: doi:10.1038/s41594-019-0188-z
在一项新的研究中,来自英国帝国理工学院和阿斯利康公司的研究人员指出当使用CRISPR-Cas9时,在基因表达和其他细胞过程中经常发生的DNA扭曲可能导致基因组脱靶变化。这些研究结果可能有助于为在临床应用上提高基因编辑准确性铺平道路。相关研究结果发表在 2019年3月的Nature Structural and Molecular Biology期刊上,论文标题为“DNA stretching induces Cas9 off-target activity”。
CRISPR-Cas9是一种允许人们发现和编辑DNA链的基因编辑工具。随着科学家们在医学、药物发现和农业等多个领域使用CRISPR-Cas9,它因它的多种用途获得了全球的认可。在这项新的研究中,CRISPR-Cas9的准确度和精确度是通过一种新的方法进行研究的:使用光学镊 子---一种使用激光束操纵DNA的工具---模拟DNA自然经历的扭曲,就像是细胞的分子机器读取了它。他们随后利用CRISPR-Cas9编辑基因并使用荧光显微镜监测它的准确性。结果表明,当DNA松散和松弛时,CRISPR是准确的,但是当DNA发生扭曲---在这种情况下,DNA遭受 高度拉伸---时,CRISPR编辑准确性降低,并且观察到脱靶编辑。了解这种效应将有助于设计具有更高准确度的CRISPR系统,以及评估这种风险的方法。
9. Nature:开发出Cas9-MMEJ可编程基因编辑方法,有望治疗143种由DNA微重复引起的疾病
Nature, Published online:03 April 2019, doi:10.1038/s41586-019-1076-8
在一项新的研究中,来自美国马萨诸塞大学医学院的研究人员开发出一种利用CRISPR-Cas9和一种很少使用的DNA修复途径编辑和修复一种特定类型的与微重复(microduplication)相关的基因突变。这种可编程基因编辑方法克服了之前在基因校正中所遭遇的低效率。
微重复是染色体发生变化而使得 DNA上的小片段被拷贝或复制。在某些基因中,当添加的核苷酸数量不能被3整除时,这些微重复就能够导致所谓的“移码突变”。这改变了基因向蛋白的翻译,从而导致功能丧失。由微重复引起的移码突变导致多达143种不同的疾病,包 括肢带肌营养不良(limb-girdle muscular dystrophy)、赫曼斯基-普德拉克综合征(Hermansky-Pudlak syndrome)和家族黑蒙性白痴病(Tay-Sachs)。
10.Nature:震惊!CRISPR碱基编辑器能够诱导大量的脱靶RNA编辑
Nature, Published online:17 April 2019, doi:10.1038/s41586-019-1161-z
在一项新的研究中,来自美国麻省总医院、哈佛医学院和哈佛大学陈曾熙公共卫生学院的研究人员报道近期开发的几种在单个DNA碱基中产生靶向变化的碱基编辑器能够在RNA中诱导广泛的脱靶效应。他们还描述了对碱基编辑器变体进行基因改造可显著降低RNA编辑的发生 率,这同时也会增加在靶DNA编辑的精确度。相关研究结果于2019年4月17日在线发表在Nature期刊上,论文标题为“Transcriptome-wide off-target RNA editing induced by CRISPR-guided DNA base editors”。
为了研究减少或消除不需要的RNA编辑的可能性,论文通讯作者、麻省总医院病理学系的J. Keith Joung博士及其团队筛选了16种具有脱氨酶改造版本的碱基编辑器(即碱基编辑器改造版本),从中鉴定出两种碱基编辑器改造版本与它们的原始版本同样高效地诱导在靶DNA编辑,同时诱导显著少的RNA编辑。实际上,这些SECURE (SElective Curbing of Unwanted RNA Editing, 选择性抑制不需要的RNA编辑)变体甚至要比未经基因改造的脱氨酶更精确地诱导所需的DNA编辑。
11.Science:开发出一种检测CRISPR脱靶效应的新方法---DISCOVER-Seq
Science , 19 April 2019, doi:10.1126/science.aav9023; doi:10.1126/science.aax1827
当CRISPR进行切割时,DNA会被破坏。因此,为了生存,细胞将许多不同的DNA修复因子募集到基因组中的特定位点上以修复断裂并将切割末端连接在一起。美国加州大学伯克利分校的Jacob E. Corn及其团队认为如果能够找到这些DNA修复因子的位置,就可以鉴定出被CRISPR切割的位点。为此,在一项新的研究中,他们研究了一组不同的DNA修复因子。他们发现其中的一种称为MRE11的DNA修复因子是DNA切割位点的第一批响应者之一。他们利用MRE11开发了一种名为DISCOVER-Seq的新技术,它可以识别出CRISPR切割基因组的确切位点。
Corn说,“鉴于我们的方法依赖于细胞的自然修复过程来识别切割位点,它经证实是一种侵入性更小、更可靠的方法。我们能够在诱导性多能干细胞、患者细胞和小鼠中测试我们新开发的DISCOVER-Seq方法,而且我们的研究结果表明这种方法可潜在地用于任何系统,而不仅仅是在实验室中。”
12.Cell:首次发现阻断CRISPR-Cas9基因组编辑的小分子抑制剂
Cell, 02 May 2019, doi:10.1016/j.cell.2019.04.009
在一项新的研究中,来自美国布罗德研究所等研究机构的研究人员发现酿脓链球菌Cas9(SpCas9)的首批小分子抑制剂能够更精确地控制基于CRISPR-Cas9的基因组编辑。具体而言,他们通过开发一系列高通量生物化学分析方法和基于细胞的分析方法,筛选了许多小分子 ,以便鉴定出能够破坏SpCas9与DNA结合因而干扰它的DNA切割能力的化合物。这些首批小分子CRISPR-Cas9抑制剂很容易进入细胞,并且比之前发现的抗CRISPR蛋白小得多。这些新化合物可以对基于SpCas9的编辑技术进行可逆的和剂量依赖性的控制,包括它们在哺乳动物 细胞中进行基因编辑、碱基编辑和表观遗传编辑的应用。
论文通讯作者、布罗德研究所的Amit Choudhary说道,“这些技术为快速鉴定和使用针对SpCas9和下一代CRISPR相关核酸酶的小分子抑制剂奠定了基础。靶向CRISPR相关核酸酶的小分子抑制剂具有广泛应用于基础研究、生物医学和国防研究以及生物技术应用的潜力。”
13. Nature:新型基因编辑工具完成”精准“编辑
Nature, Published online:12 June 2019, doi:10.1038/s41586-019-1323-z
在最近一项研究中,哥伦比亚大学的一项新发现可以解决当前基因编辑工具(包括CRISPR)的一个主要缺点,并为基因工程和基因治疗提供了一种强有力的新方法。他们的新技术称为INTEGRATE,即利用细菌跳跃基因将任何DNA序列准确地插入基因组而不切割DNA。目前的基因编辑工具依赖于切割DNA,但这些切割可能导致错误的发生。
具体而言,研究人员发现转座子整合到细菌基因组中的特定位点,而无需切割DNA。重要的是,整合酶插入DNA的位点完全由其相关的CRISPR系统控制。他们利用这一发现创建了一种基因编辑工具,经编程后可将任何DNA序列插入到细菌基因组的任何位点。与CRISPR一样,整合酶通过向导RNA找到合适的位点。通过重编程向导RNA,他们能够精确控制供体DNA整合的位置。通过用其他DNA有效载荷替换转座子序列,它们可以将长达10000个碱基的序列插入细菌基因组中。因此,与其他基于整合的编辑工具不同,INTEGRATE技术是迄今为止研究的首个完全可编程的插入系统。
14. Science:基因编辑大牛张锋开发出新型基因编辑技术---CRISPR相关转座酶
Science, Published online:06 June 2019, doi:10.1126/science.aax9181
在一项新的研究中,来自美国麻省理工学院、布罗德研究所和美国国家卫生院(NIH)的研究人员发现CRISPR相关的转座子可用于将定制的基因插入到DNA中而不需要切割它。相关研究结果于2019年6月6日在线发表在Science期刊上,论文标题为“RNA-guided DNA insertion with CRISPR-associated transposases”。在这篇论文中,他们描述了他们的新型基因编辑技术,以及它在细菌基因组中进行测试时的效果。

近年来,CRISPR基因编辑技术因它具有治疗遗传性疾病的潜力而成为头条新闻。不幸的是,尽管围绕这种技术进行了大量研究,但它仍然不适合用于人类患者。这是因为这种技术容易出错---在切割DNA链时,CRISPR有时也会进行脱靶DNA切割,从而导致意料之外的不可预测的后果(有时会导致癌症)。在这项新的研究中,这些研究人员找到了一种方法,即将CRISPR与另一种蛋白结合使用,对DNA链进行编辑而不对它进行切割---他们称之为CRISPR相关转座酶(CRISPR-associated transposase, CAST)。他们将一种称为Tn7的转座子与用于CRISPR中的Cas12酶相结合在一起,以便对细菌基因组的一部分进行编辑。在实践中,CRISPR将Tn7转座子引导至基因组中的目标位置上---在那里,这种转座子将自身插入基因组中而无需切割它。
15.Nature:中国科学院、川大合作新成果!DNA碱基编辑器或能诱导大量脱靶RNA突变!
Nature, Published online:10 June 2019, doi:10.1038/s41586-019-1314-0
近日,一项刊登在国际杂志Nature上的研究报告中,来自中国科学院和四川大学等机构的科学家们通过研究发现,DNA碱基编辑器能够产生成千上万个脱靶的RNA单核苷酸变异(SNVs),同时通过将点突变引入脱氨酶或能消除这些脱靶的SNVs;本文研究揭示了此前DNA碱基编辑器风险中被忽略的一方面,同时研究者通过引入工程化的脱氨酶或有望解决这一问题。
为了消除碱基编辑器的RNA脱靶活性,研究者还分析了引入点突变对APOBEC1和TadA的影响效应,他们发现,三个高保真的变异:BE3W90Y+R126E, BE3 (hA3AR128A) and BE3 (hA3AY130F)能够在基准水平上降低RNA脱靶SNVs的水平,同样地,ABE突变ABE7.10F148A还能够完全消除脱靶效应。
16.Science:基因编辑大牛张锋开发出RESCUE技术,可扩大RNA编辑能力
Science, Published online:11 July 2019, doi:10.1126/science.aax7063
在一项新的研究中,美国麻省理工学院麦戈文脑科学硏究所研究员、布罗德研究所核心成员张锋(Feng Zhang)及其团队如今开发出一种称为RESCUE(RNA Editing for Specific C to U Exchange, C→U交换特异性的RNA编辑)的策略。
他们利用一种失活的Cas13将RESCUE引导到RNA转录本中的目标胞嘧啶碱基上,并使用一种新的、经过进化的、可编程的酶将不想要的胞嘧啶(C)转化为尿苷(U),从而指导RNA指令发生变化。RESCUE显著地扩展了CRISPR工具能够靶向的范围,包括蛋白中可修饰的位点,比如磷酸化位点。这些位点充当蛋白活性的开启/关闭开关,而且主要存在于信号分子和癌症相关通路中。
17.Science:重大突破!CRISPR-Cas系统新用途!开发出可编程的CRISPR反应性智能材料
Science, 23 August 2019, doi:10.1126/science.aaw5122
如今,在一项新的研究中,来自美国哈佛大学威斯生物启发工程研究所和麻省理工学院的研究人员展示了将CRISPR用作新型刺激反应性“智能(smart)”材料的控制元件。一旦被特定的天然的或用户定义的DNA刺激物激活,一种CRISPR-Cas酶就能够让多种智能材料释放出自身结合的货物,比如染料和活性酶,改变它们的结构来部署包埋的纳米颗粒和活细胞,或者调节电路从而将生物信号转化为电信号。
论文通讯作者、哈佛大学威斯生物启发工程研究所创始核心学院成员James Collins博士说,“我们的研究表明CRISPR的力量可以在实验室之外用于控制DNA反应性材料的行为。我们开发了一系列具有不同能力的材料,这就突显了可编程的CRISPR反应性智能材料(CRISPR-responsive smart material)所支持的应用范围。这些应用包括新型治疗诊断策略、即时诊断以及对流行病爆发和环境危害进行的区域监测。”
18.Science:全文解读!开发出CRISPR LiveFISH技术,成功对活细胞中的DNA和RNA进行实时成像
Science, 20 September 2019, doi:10.1126/science.aax7852
在一项新的研究中,来自美国斯坦福大学、卡斯迪加学校和中国浙江大学的研究人员报道了一种称为CRISPR活细胞荧光原位杂交(CRISPR live-cell fluorescent in situ hybridization, CRISPR LiveFISH)的实时成像方法,从而允许研究活细胞中的各种染色体功能。
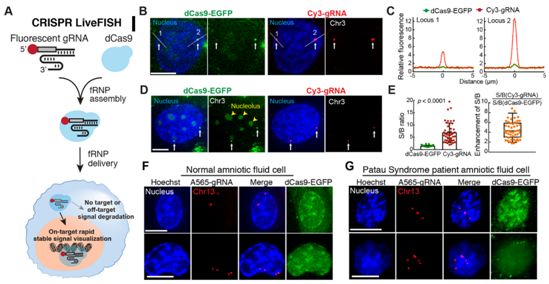
这些研究人员报道了用于活细胞DNA和RNA成像的CRISPR LiveFISH技术。化学合成的荧光gRNA与dCas蛋白形成的复合物能够促进快速稳健地、可扩展地对细胞(包括原代细胞)中的基因组DNA进行追踪和对细胞中的RNA进行成像。在富含核糖核酸酶的环境中,对Cas9:gRNA:DNA三元复合物中gRNA的靶DNA依赖性保护会富集靶信号,同时让背景噪音最小化。CRISPR LiveFISH也允许对活细胞中内源性基因组位点上发生的CRISPR诱导的基因编辑和易位事件进行动态追踪。使用dCas9和dCas13系统的双DNA/RNA CRISPR LiveFISH能够对相同细胞中的基因组DNA和RNA转录本进行实时成像。人们有可能将CRISPR LiveFISH与其他的基因操纵技术(比如,CRISPRi/a、表观遗传修饰和CRISPR-GO)结合使用来加深对基因组组装和细胞核事件的时空动态变化的理解。
19.Cell:首次发现针对III型CRISPR-Cas系统的蛋白抑制剂
Cell, 03 October 2019, doi:10.1016/j.cell.2019.09.003
在一项新的研究中,来自丹麦哥本哈根大学的研究人员发现一种针对III型CRISPR/Cas系统的抑制剂--- AcrIIIB1,它是由硫化叶菌病毒(Sulfolobus virus)SIRV2编码的。AcrIIIB1仅抑制由辅助蛋白Csx1的RNase活性介导的III-B CRISPR/Cas免疫反应。
这些研究人员发现AcrIIIB1似乎并不结合Csx1,但是与两种不同的III-B效应复合物--- Cmr-α和Cmr-γ相互作用。当结合前间隔序列转录本时,这两种III-B效应复合物合成环化寡腺苷酸(cyclic oligoadenylate, cOA),所产生的cOA激活Csx1的RNase活性。
20.Nature:新型CRISPR工具或能通过将RNA复制到基因组中精确修饰基因
Nature, Published online: 21 October 2019, doi:10.1038/s41586-019-1711-4
构成生命蓝图的DNA序列变异对任何物种的健康都是至关重要的,成千上万的DNA突变被认为都会导致疾病,经过几十年的遗传学和分子生物学研究后,如今研究人员在开发能够纠正突变的基因组编辑工具上取得了巨大的进展,但由于工具依赖于复杂和相互竞争的细胞过程,基因编辑的效率和准确性似乎受到了根本性的限制;近日,一项刊登在国际杂志Nature上的研究报告中,研究者Anzalone等人描述了一种“查找并替换”(search-and-replace)的基因组编辑技术,即将两种分子机器相结合来精确改变基因组,该技术对于生物医学科学研究具有直接且深远的影响。
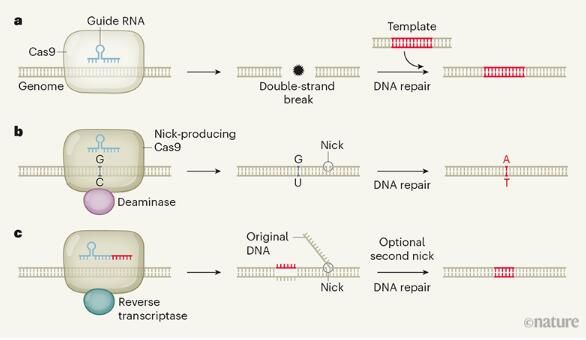
这种名为prime编辑(prime editing)的基因组编辑技术依赖于一种混合分子机器,其包括一个改良版本的Cas9,其仅切割两条DNA链中的一条,和一个转录酶,同时会在切割位点装载新的和可定制的DNA;这种组合与酵母中自然发生的过程非常相似,在酵母中,与RNA序列相对应的DNA会通过逆转录酶整合到基因组中去。prime编辑能被一种工程化、由两部分组成的向导RNA(gRNA)进行调节,gRNA中的“寻找”部分会指导Cas9进入到DNA靶点的特殊序列,从而对其中一条DNA链进行切割,随后,逆转录酶会在gRNA的“替换”部分上产生与该序列互补的DNA,并将其装载在两个被切割的DNA末端中的一个上,从而取代原来的DNA序列。
此时,被修饰的双链DNA会由两条不互补的链组成,即被编辑过的链和未被Cas9切断的完整链,非互补序列在细胞中是不被容忍的,其中一个链必须通过DNA的修复过程来固定从而匹配另外一个链,而完整的链则通常会被优先保留;因此作者通常必须使用第二种RNA向导来指导对完整链的切割,从而增加修复该链以匹配编辑序列的机会;研究者通过高效精确地将大量序列引入到DNA中,从而展示了prime编辑的多功能性,比如,研究人员在人类胚胎肾细胞中使用该技术来纠正产生血液镰刀细胞病的突变,同时还能对引发神经性Tay-Sachs病的突变进行编辑,这几乎完全避免了不完美的编辑,同时研究者还在体外对人类癌细胞和小鼠神经元进行了编辑。(生物谷 Bioon.com)
基因编辑(gene editing)是一种新兴的比较精确的能对生物体基因组特定目标基因或者它们的转录本进行修饰的一种基因工程技术。它能够让人类对目标基因或它们的转录本进行定点“编辑”,实现对特定DNA或RNA片段的修饰。

图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
基因编辑技术中,以锌指核酸酶(zinc-finger nucleases, ZFN)和TALEN (transcription activator-like effector nucleases)为代表的序列特异性核酸酶技术以其能够高效率地进行定点基因组编辑,在基因研究、基因治疗和遗传改良等方面展示出了巨大的潜力。CRISPR/Cas是继“锌指核酸内切酶(ZFN)”、“转录激活子样效应因子核酸酶(TALEN)”之后出现的第三代“基因组定点编辑技术”。与前两代技术相比,其成本低、制作简便、快捷高效的优点,让它迅速风靡于世界各地的实验室,成为科研、医疗等领域的有效工具,而且经过不断改进后,更被认为能够在活细胞中最有效、最便捷地“编辑”任何基因。
基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas9是由一种原始的细菌免疫系统改编而成的,它的作用方式是首先在基因组的一个靶位点上切割双链DNA。
在2019年,科学家们在基因编辑等基因工程领域取得重大的进展,让我们一起看看这个领域在这一年里取得的重大发现。
1.基因编辑大牛张锋新力作!发现第三种CRISPR-Cas系统,显著降低脱靶效应
Nature Communications, 22 January 2019, doi:10.1038/s41467-018-08224-4
在一项新的研究中,来自美国布罗德研究所的张锋(Feng Zhang)及其团队着重关注除Cas9和Cas12a(之前称为Cpf1)之外的第三种II型蛋白效应核酸酶:Cas12b,即一种由两个gRNA引导的核酸酶,含有单个结构域:RuvC,其中这两个gRNA为crRNA和tracrRNA。尽管Cas12b蛋白通常比Cas9和Cas12a小,因而从通过病毒载体进行细胞内递送的观点来看具有吸引力,但是得到最好描述的来自嗜酸耐热菌(Alicyclobacillus acidoterrestris)的Cas12b核酸酶(AacCas12b)在48°C时表现出最佳的DNA切割活性,这阻止它在哺乳动物细胞中的应用。张锋团队试图鉴定出在较低温度下有活性的Cas12b家族成员,这样就可用于人类基因组编辑。相关研究结果于2019年1月22日发表在Nature Communications期刊上,论文标题为“Engineering of CRISPR-Cas12b for human genome editing”。

图片来自Nature Communications, doi:10.1038/s41467-018-08224-4。
鉴于强效的基因组编辑工具应当在一系列靶标上是高效的和特异性的,张锋团队在针对293T细胞中的5个基因的56个靶位点上测试了BhCas12b v4突变体,结果观察到强效的DNA切割。接着,他们通过电穿孔技术将BhCas12b v4-sgRNA复合物递送到人CD4+ T细胞中。在3个测试的靶位点上,这些复合物表现出的indel发生率为32%~49%。这些数据表明BhCas12b v4突变体在多种基因组编辑环境下(包括一种在治疗上有重大意义的人细胞类型)可作为一种有效的可编程的核酸酶。
2.Nature:重磅!首次成功地在哺乳动物中进行基因驱动
Nature, Published online: 23 January 2019, doi:10.1038/s41586-019-0875-2
基因驱动(gene drive)是一种基因工程技术,它促进后代要比正常情形时更频繁地遗传来自一个亲本的特定等位基因。它已在昆虫中发挥作用。如今,在一项新的研究中,来自美国加州大学圣地亚哥分校的研究人员发现它也能够成功地在脊椎动物中发挥作用。在这项研究中,他们描述了一种方法,它利用CRISPR-Cas9改变雌性小鼠生殖系细胞,从而促进小鼠后代出现白色毛发和表达一种红色荧光蛋白。相关研究结果于2019年1月23日在线发表在Nature期刊上,论文标题为“Super-Mendelian inheritance mediated by CRISPR–Cas9 in the female mouse germline”。
这是首个证据表明基因驱动可在哺乳动物中发挥效果,但是它并不完美。这些研究人员正在优化Cas9在雌性小鼠中产生的时间,并且正在研究更高的效率是否可能解决雄性动物中同源介导修复的缺乏。
3.Cell:给Cas9一个开启开关,从而更好地控制CRISPR基因编辑
Cell, 10 January 2019, doi:10.1016/j.cell.2018.11.052
在一项新的研究中,来自美国加州大学伯克利分校的研究人员利用一种称为循环排列(circular permutation)的技术,构建出一套称为Cas9-CP的新型Cas9变体,这将简化Cas9融合蛋白的设计,使得它们能够用于除了简单的DNA切割之外的多种应用,比如碱基编辑和表观遗传修饰。相关研究结果发表在2019年1月10日的Cell期刊上,论文标题为“CRISPR-Cas9 Circular Permutants as Programmable Scaffolds for Genome Modification”。

图片来自Cell, 2019, doi:10.1016/j.cell.2018.11.052。
通过这个相同的过程,David Savage和他的团队将“永远开启(always-on)”的Cas9分子转变为可激活的开关。这些开关保持在“关闭”位置,直到它们被蛋白酶激活。由此产生的蛋白酶感应的Cas9(protease-sensing Cas9, ProCas9)能够减少脱靶效应并实现分子感应,以及组织或器官特异性的基因组编辑。他们证实ProCas9可用于检测病毒蛋白酶,从而潜在地用作一种能够引发免疫反应的病原体感应系统。
Savage团队使用循环排列来重新设计Cas9的分子序列,因而更好地控制它的活性并为融合蛋白构建更优化的DNA结合支架。这种Cas9重新连接方法涉及将这种蛋白的末端(即它的氨基端和羧基端)与肽接头(peptide linker)连接,同时在不同的位置上分割它的序列,从而产生新的相邻的氨基端和羧基端。
4.重大进展!两篇Nature Medicine揭示一种新型CRISPR/Cas9疗法有望治疗早衰症
Nature Medicine, Published online: 18 February 2019, doi:10.1038/s41591-019-0343-4; doi:10.1038/s41591-018-0338-6
衰老是导致包括心脏病、癌症和阿尔茨海默病在内的许多衰竭性疾病的主要风险因素。这使得对抗衰老疗法的需求变得更加迫切。如今,在第一项新的研究中,来自美国沙克生物研究所的研究人员利用CRISPR/Cas9系统将基因疗法递送到表达Cas9的早衰症小鼠模型的细胞中。在递送这种基因疗法两个月后,这些小鼠变得更强壮和更活跃,而且它们的心血管健康得到改善。它们表现出下降的主要动脉血管退化和延迟的心跳过缓(bradycardia)发作---在早衰症和老年时常见的两个问题。总体而言,这些接受治疗的早衰症小鼠具有与正常小鼠相似的活动水平,而且它们的寿命增加了大约25%。
在第二项新的研究中,西班牙奥维耶多大学的José M. P. Freije、Carlos López-Otín及其团队开也发出一种基于CRISPR/Cas9的疗法来治疗哈钦森-吉尔福德早衰症综合征。对这种疗法的测试结果表明,它通过在LMNA基因中引入移码突变(frameshift mutation)逆转了在哈钦森-吉尔福德早衰症综合征小鼠模型和来自患上这种疾病的患者的细胞中发生的一些有害变化。
5.Nat Biotechnol:开发出更加高效的CRISPR–Cas12a变体
Nature Biotechnology, Published online: 11 February 2019, doi:10.1038/s41587-018-0011-0
在一项新的研究中,来自美国麻省总医院、哈佛医学院和麻省理工学院的研究人员设计了能够靶向更广泛的前间隔序列邻近基序(protospacer adjacent motif, PAM)的Cas12a变体。

图片来源:CC0 Public Domain。
这些研究人员报道特别地,一种称为enAsCas12a的变体并不需要扩展的输血传播病毒(extended transfusion-transmissible virus, TTTV)PAM,当然,野生型AsCas12a需要这种TTTV PAM。与AsCas12a野生型相比,这种变体在典型的TTTV PAM存在时平均具有两倍高的基因组编辑活性。它的靶向范围扩大了:增加了七倍。他们进一步报道他们成功地将来自enAsCas12a的一部分突变片段移植到AsCas12a上来改善后者的活性。他们声称,开发出的enAsCas12a允许更高效地进行多重基因编辑,并提供内源性基因激活和C→T碱基编辑。为了降低利用enAsCas12a观察到的高于正常的脱靶效应,他们还设计了另一种称为enAsCas12a-HF1的变体。
6.Nature:科学家发现新型的CRISPR基因编辑工具:CasX
Nature, Published online:04 February 2019, doi:10.1038/s41586-019-0908-x
在短短7年时间里,Cas9已经成为了在人类、植物、动物和细菌中能够被使用的强大基因编辑工具,其能快速并准确地切割和拼接DNA,其也有望帮助开发治疗多种人类疾病的新型疗法。日前,一项刊登在国际杂志Nature上的研究报告中,来自加州大学伯克利分校的科学家们通过研究发现了一种新型的小型CRISPR基因编辑工具:CasX,其与蛋白Cas9较为相似,但比Cas9小很多。
实际上,CasX是细菌和人类细胞中潜在的一种有效基因编辑工具,其似乎是在细菌中进化出的独立于其它Cas蛋白的一种特殊蛋白,CasX能够切割双链DNA,结合DNA并调节基因的表达,同时还能靶向作用特殊的DNA序列。由于CasX来自于细菌细胞中,因此相比Cas9而言,人类机体免疫系统或许能够更加容易地接纳CasX。
7.我国科学家在两篇Science论文上揭示胞嘧啶碱基编辑器诱导大量的脱靶突变
Science, Published online:28 February 2019, doi:10.1126/science.aaw7166; doi:10.1126/science.aav9973
在第一项新的研究中,中国科学院的李亦学(Yixue Li)课题组、杨辉(Hui Yang)课题组和美国斯坦福大学的Lars M. Steinmetz课题组开发出一种称为GOTI(genome-wide off-target analysis by two-cell embryo injection)的方法来评估三种经常使用的基因编辑工具---CRISPR/Cas9、胞嘧啶碱基编辑器3(BE3, rAPOBEC1-nCas9-UGI)、腺嘌呤碱基编辑器7.10(ABE7.10, TadA-TadA*-nCas9)---诱导的脱靶效应。他们发现在经过BE3编辑的细胞中鉴定出的90%以上的单核苷酸变异(SNV)是G>A或C>T,这一突变偏好并没有在经过Cre、Cas9或ABE7.10处理的细胞中观察到。这一突变偏好与APOBEC1本身的突变偏好相同,这表明这些突变并不是自发的而是由BE3编辑诱导的。

图片来自Institute of Genetics and Developmental Biology, Chinese Academy of Sciences。
在第二项新的研究中,中国科学院的高彩霞(Caixia Gao)课题组通过对作为一种重要的作物物种的水稻进行全基因组测序对胞嘧啶碱基编辑器(BE3和HF1-BE3)和腺嘌呤碱基编辑器(ABE)产生的脱靶突变进行全面调查。他们发现胞嘧啶碱基编辑器(BE3和HF1-BE3)诱导全基因组脱靶突变。这些脱靶突变主要是C>T单核苷酸变异,在转录的基因区域中富集,通过当前的计算机方法是无法预测的。
8. Nature子刊:当心!DNA扭曲增加CRISPR-Cas9脱靶编辑风险
Nature Structural and Molecular Biology, March 2019, doi: doi:10.1038/s41594-019-0188-z
在一项新的研究中,来自英国帝国理工学院和阿斯利康公司的研究人员指出当使用CRISPR-Cas9时,在基因表达和其他细胞过程中经常发生的DNA扭曲可能导致基因组脱靶变化。这些研究结果可能有助于为在临床应用上提高基因编辑准确性铺平道路。相关研究结果发表在 2019年3月的Nature Structural and Molecular Biology期刊上,论文标题为“DNA stretching induces Cas9 off-target activity”。
CRISPR-Cas9是一种允许人们发现和编辑DNA链的基因编辑工具。随着科学家们在医学、药物发现和农业等多个领域使用CRISPR-Cas9,它因它的多种用途获得了全球的认可。在这项新的研究中,CRISPR-Cas9的准确度和精确度是通过一种新的方法进行研究的:使用光学镊 子---一种使用激光束操纵DNA的工具---模拟DNA自然经历的扭曲,就像是细胞的分子机器读取了它。他们随后利用CRISPR-Cas9编辑基因并使用荧光显微镜监测它的准确性。结果表明,当DNA松散和松弛时,CRISPR是准确的,但是当DNA发生扭曲---在这种情况下,DNA遭受 高度拉伸---时,CRISPR编辑准确性降低,并且观察到脱靶编辑。了解这种效应将有助于设计具有更高准确度的CRISPR系统,以及评估这种风险的方法。
9. Nature:开发出Cas9-MMEJ可编程基因编辑方法,有望治疗143种由DNA微重复引起的疾病
Nature, Published online:03 April 2019, doi:10.1038/s41586-019-1076-8
在一项新的研究中,来自美国马萨诸塞大学医学院的研究人员开发出一种利用CRISPR-Cas9和一种很少使用的DNA修复途径编辑和修复一种特定类型的与微重复(microduplication)相关的基因突变。这种可编程基因编辑方法克服了之前在基因校正中所遭遇的低效率。
微重复是染色体发生变化而使得 DNA上的小片段被拷贝或复制。在某些基因中,当添加的核苷酸数量不能被3整除时,这些微重复就能够导致所谓的“移码突变”。这改变了基因向蛋白的翻译,从而导致功能丧失。由微重复引起的移码突变导致多达143种不同的疾病,包 括肢带肌营养不良(limb-girdle muscular dystrophy)、赫曼斯基-普德拉克综合征(Hermansky-Pudlak syndrome)和家族黑蒙性白痴病(Tay-Sachs)。
10.Nature:震惊!CRISPR碱基编辑器能够诱导大量的脱靶RNA编辑
Nature, Published online:17 April 2019, doi:10.1038/s41586-019-1161-z
在一项新的研究中,来自美国麻省总医院、哈佛医学院和哈佛大学陈曾熙公共卫生学院的研究人员报道近期开发的几种在单个DNA碱基中产生靶向变化的碱基编辑器能够在RNA中诱导广泛的脱靶效应。他们还描述了对碱基编辑器变体进行基因改造可显著降低RNA编辑的发生 率,这同时也会增加在靶DNA编辑的精确度。相关研究结果于2019年4月17日在线发表在Nature期刊上,论文标题为“Transcriptome-wide off-target RNA editing induced by CRISPR-guided DNA base editors”。

图片来自CC0 Public Domain。
为了研究减少或消除不需要的RNA编辑的可能性,论文通讯作者、麻省总医院病理学系的J. Keith Joung博士及其团队筛选了16种具有脱氨酶改造版本的碱基编辑器(即碱基编辑器改造版本),从中鉴定出两种碱基编辑器改造版本与它们的原始版本同样高效地诱导在靶DNA编辑,同时诱导显著少的RNA编辑。实际上,这些SECURE (SElective Curbing of Unwanted RNA Editing, 选择性抑制不需要的RNA编辑)变体甚至要比未经基因改造的脱氨酶更精确地诱导所需的DNA编辑。
11.Science:开发出一种检测CRISPR脱靶效应的新方法---DISCOVER-Seq
Science , 19 April 2019, doi:10.1126/science.aav9023; doi:10.1126/science.aax1827
当CRISPR进行切割时,DNA会被破坏。因此,为了生存,细胞将许多不同的DNA修复因子募集到基因组中的特定位点上以修复断裂并将切割末端连接在一起。美国加州大学伯克利分校的Jacob E. Corn及其团队认为如果能够找到这些DNA修复因子的位置,就可以鉴定出被CRISPR切割的位点。为此,在一项新的研究中,他们研究了一组不同的DNA修复因子。他们发现其中的一种称为MRE11的DNA修复因子是DNA切割位点的第一批响应者之一。他们利用MRE11开发了一种名为DISCOVER-Seq的新技术,它可以识别出CRISPR切割基因组的确切位点。
Corn说,“鉴于我们的方法依赖于细胞的自然修复过程来识别切割位点,它经证实是一种侵入性更小、更可靠的方法。我们能够在诱导性多能干细胞、患者细胞和小鼠中测试我们新开发的DISCOVER-Seq方法,而且我们的研究结果表明这种方法可潜在地用于任何系统,而不仅仅是在实验室中。”
12.Cell:首次发现阻断CRISPR-Cas9基因组编辑的小分子抑制剂
Cell, 02 May 2019, doi:10.1016/j.cell.2019.04.009
在一项新的研究中,来自美国布罗德研究所等研究机构的研究人员发现酿脓链球菌Cas9(SpCas9)的首批小分子抑制剂能够更精确地控制基于CRISPR-Cas9的基因组编辑。具体而言,他们通过开发一系列高通量生物化学分析方法和基于细胞的分析方法,筛选了许多小分子 ,以便鉴定出能够破坏SpCas9与DNA结合因而干扰它的DNA切割能力的化合物。这些首批小分子CRISPR-Cas9抑制剂很容易进入细胞,并且比之前发现的抗CRISPR蛋白小得多。这些新化合物可以对基于SpCas9的编辑技术进行可逆的和剂量依赖性的控制,包括它们在哺乳动物 细胞中进行基因编辑、碱基编辑和表观遗传编辑的应用。

图片来自CC0 Public Domain。
论文通讯作者、布罗德研究所的Amit Choudhary说道,“这些技术为快速鉴定和使用针对SpCas9和下一代CRISPR相关核酸酶的小分子抑制剂奠定了基础。靶向CRISPR相关核酸酶的小分子抑制剂具有广泛应用于基础研究、生物医学和国防研究以及生物技术应用的潜力。”
13. Nature:新型基因编辑工具完成”精准“编辑
Nature, Published online:12 June 2019, doi:10.1038/s41586-019-1323-z
在最近一项研究中,哥伦比亚大学的一项新发现可以解决当前基因编辑工具(包括CRISPR)的一个主要缺点,并为基因工程和基因治疗提供了一种强有力的新方法。他们的新技术称为INTEGRATE,即利用细菌跳跃基因将任何DNA序列准确地插入基因组而不切割DNA。目前的基因编辑工具依赖于切割DNA,但这些切割可能导致错误的发生。
具体而言,研究人员发现转座子整合到细菌基因组中的特定位点,而无需切割DNA。重要的是,整合酶插入DNA的位点完全由其相关的CRISPR系统控制。他们利用这一发现创建了一种基因编辑工具,经编程后可将任何DNA序列插入到细菌基因组的任何位点。与CRISPR一样,整合酶通过向导RNA找到合适的位点。通过重编程向导RNA,他们能够精确控制供体DNA整合的位置。通过用其他DNA有效载荷替换转座子序列,它们可以将长达10000个碱基的序列插入细菌基因组中。因此,与其他基于整合的编辑工具不同,INTEGRATE技术是迄今为止研究的首个完全可编程的插入系统。
14. Science:基因编辑大牛张锋开发出新型基因编辑技术---CRISPR相关转座酶
Science, Published online:06 June 2019, doi:10.1126/science.aax9181
在一项新的研究中,来自美国麻省理工学院、布罗德研究所和美国国家卫生院(NIH)的研究人员发现CRISPR相关的转座子可用于将定制的基因插入到DNA中而不需要切割它。相关研究结果于2019年6月6日在线发表在Science期刊上,论文标题为“RNA-guided DNA insertion with CRISPR-associated transposases”。在这篇论文中,他们描述了他们的新型基因编辑技术,以及它在细菌基因组中进行测试时的效果。

图片来自CC0 Public Domain。
近年来,CRISPR基因编辑技术因它具有治疗遗传性疾病的潜力而成为头条新闻。不幸的是,尽管围绕这种技术进行了大量研究,但它仍然不适合用于人类患者。这是因为这种技术容易出错---在切割DNA链时,CRISPR有时也会进行脱靶DNA切割,从而导致意料之外的不可预测的后果(有时会导致癌症)。在这项新的研究中,这些研究人员找到了一种方法,即将CRISPR与另一种蛋白结合使用,对DNA链进行编辑而不对它进行切割---他们称之为CRISPR相关转座酶(CRISPR-associated transposase, CAST)。他们将一种称为Tn7的转座子与用于CRISPR中的Cas12酶相结合在一起,以便对细菌基因组的一部分进行编辑。在实践中,CRISPR将Tn7转座子引导至基因组中的目标位置上---在那里,这种转座子将自身插入基因组中而无需切割它。
15.Nature:中国科学院、川大合作新成果!DNA碱基编辑器或能诱导大量脱靶RNA突变!
Nature, Published online:10 June 2019, doi:10.1038/s41586-019-1314-0
近日,一项刊登在国际杂志Nature上的研究报告中,来自中国科学院和四川大学等机构的科学家们通过研究发现,DNA碱基编辑器能够产生成千上万个脱靶的RNA单核苷酸变异(SNVs),同时通过将点突变引入脱氨酶或能消除这些脱靶的SNVs;本文研究揭示了此前DNA碱基编辑器风险中被忽略的一方面,同时研究者通过引入工程化的脱氨酶或有望解决这一问题。
为了消除碱基编辑器的RNA脱靶活性,研究者还分析了引入点突变对APOBEC1和TadA的影响效应,他们发现,三个高保真的变异:BE3W90Y+R126E, BE3 (hA3AR128A) and BE3 (hA3AY130F)能够在基准水平上降低RNA脱靶SNVs的水平,同样地,ABE突变ABE7.10F148A还能够完全消除脱靶效应。
16.Science:基因编辑大牛张锋开发出RESCUE技术,可扩大RNA编辑能力
Science, Published online:11 July 2019, doi:10.1126/science.aax7063
在一项新的研究中,美国麻省理工学院麦戈文脑科学硏究所研究员、布罗德研究所核心成员张锋(Feng Zhang)及其团队如今开发出一种称为RESCUE(RNA Editing for Specific C to U Exchange, C→U交换特异性的RNA编辑)的策略。

CRISPR家族酶Cas13在发挥作用。Cas13(粉红色)是RESCUE平台的核心,它使用特定的向导分子(红色)靶向细胞中的RNA(蓝色)。图片来自Stephen Dixon。
他们利用一种失活的Cas13将RESCUE引导到RNA转录本中的目标胞嘧啶碱基上,并使用一种新的、经过进化的、可编程的酶将不想要的胞嘧啶(C)转化为尿苷(U),从而指导RNA指令发生变化。RESCUE显著地扩展了CRISPR工具能够靶向的范围,包括蛋白中可修饰的位点,比如磷酸化位点。这些位点充当蛋白活性的开启/关闭开关,而且主要存在于信号分子和癌症相关通路中。
17.Science:重大突破!CRISPR-Cas系统新用途!开发出可编程的CRISPR反应性智能材料
Science, 23 August 2019, doi:10.1126/science.aaw5122
如今,在一项新的研究中,来自美国哈佛大学威斯生物启发工程研究所和麻省理工学院的研究人员展示了将CRISPR用作新型刺激反应性“智能(smart)”材料的控制元件。一旦被特定的天然的或用户定义的DNA刺激物激活,一种CRISPR-Cas酶就能够让多种智能材料释放出自身结合的货物,比如染料和活性酶,改变它们的结构来部署包埋的纳米颗粒和活细胞,或者调节电路从而将生物信号转化为电信号。
论文通讯作者、哈佛大学威斯生物启发工程研究所创始核心学院成员James Collins博士说,“我们的研究表明CRISPR的力量可以在实验室之外用于控制DNA反应性材料的行为。我们开发了一系列具有不同能力的材料,这就突显了可编程的CRISPR反应性智能材料(CRISPR-responsive smart material)所支持的应用范围。这些应用包括新型治疗诊断策略、即时诊断以及对流行病爆发和环境危害进行的区域监测。”
18.Science:全文解读!开发出CRISPR LiveFISH技术,成功对活细胞中的DNA和RNA进行实时成像
Science, 20 September 2019, doi:10.1126/science.aax7852
在一项新的研究中,来自美国斯坦福大学、卡斯迪加学校和中国浙江大学的研究人员报道了一种称为CRISPR活细胞荧光原位杂交(CRISPR live-cell fluorescent in situ hybridization, CRISPR LiveFISH)的实时成像方法,从而允许研究活细胞中的各种染色体功能。

图片来自Science, 2019, doi:10.1126/science.aax7852。
这些研究人员报道了用于活细胞DNA和RNA成像的CRISPR LiveFISH技术。化学合成的荧光gRNA与dCas蛋白形成的复合物能够促进快速稳健地、可扩展地对细胞(包括原代细胞)中的基因组DNA进行追踪和对细胞中的RNA进行成像。在富含核糖核酸酶的环境中,对Cas9:gRNA:DNA三元复合物中gRNA的靶DNA依赖性保护会富集靶信号,同时让背景噪音最小化。CRISPR LiveFISH也允许对活细胞中内源性基因组位点上发生的CRISPR诱导的基因编辑和易位事件进行动态追踪。使用dCas9和dCas13系统的双DNA/RNA CRISPR LiveFISH能够对相同细胞中的基因组DNA和RNA转录本进行实时成像。人们有可能将CRISPR LiveFISH与其他的基因操纵技术(比如,CRISPRi/a、表观遗传修饰和CRISPR-GO)结合使用来加深对基因组组装和细胞核事件的时空动态变化的理解。
19.Cell:首次发现针对III型CRISPR-Cas系统的蛋白抑制剂
Cell, 03 October 2019, doi:10.1016/j.cell.2019.09.003
在一项新的研究中,来自丹麦哥本哈根大学的研究人员发现一种针对III型CRISPR/Cas系统的抑制剂--- AcrIIIB1,它是由硫化叶菌病毒(Sulfolobus virus)SIRV2编码的。AcrIIIB1仅抑制由辅助蛋白Csx1的RNase活性介导的III-B CRISPR/Cas免疫反应。
这些研究人员发现AcrIIIB1似乎并不结合Csx1,但是与两种不同的III-B效应复合物--- Cmr-α和Cmr-γ相互作用。当结合前间隔序列转录本时,这两种III-B效应复合物合成环化寡腺苷酸(cyclic oligoadenylate, cOA),所产生的cOA激活Csx1的RNase活性。
20.Nature:新型CRISPR工具或能通过将RNA复制到基因组中精确修饰基因
Nature, Published online: 21 October 2019, doi:10.1038/s41586-019-1711-4
构成生命蓝图的DNA序列变异对任何物种的健康都是至关重要的,成千上万的DNA突变被认为都会导致疾病,经过几十年的遗传学和分子生物学研究后,如今研究人员在开发能够纠正突变的基因组编辑工具上取得了巨大的进展,但由于工具依赖于复杂和相互竞争的细胞过程,基因编辑的效率和准确性似乎受到了根本性的限制;近日,一项刊登在国际杂志Nature上的研究报告中,研究者Anzalone等人描述了一种“查找并替换”(search-and-replace)的基因组编辑技术,即将两种分子机器相结合来精确改变基因组,该技术对于生物医学科学研究具有直接且深远的影响。

图片来源:Randall J. Platt. doi: 10.1038/d41586-019-03392-9。
这种名为prime编辑(prime editing)的基因组编辑技术依赖于一种混合分子机器,其包括一个改良版本的Cas9,其仅切割两条DNA链中的一条,和一个转录酶,同时会在切割位点装载新的和可定制的DNA;这种组合与酵母中自然发生的过程非常相似,在酵母中,与RNA序列相对应的DNA会通过逆转录酶整合到基因组中去。prime编辑能被一种工程化、由两部分组成的向导RNA(gRNA)进行调节,gRNA中的“寻找”部分会指导Cas9进入到DNA靶点的特殊序列,从而对其中一条DNA链进行切割,随后,逆转录酶会在gRNA的“替换”部分上产生与该序列互补的DNA,并将其装载在两个被切割的DNA末端中的一个上,从而取代原来的DNA序列。
此时,被修饰的双链DNA会由两条不互补的链组成,即被编辑过的链和未被Cas9切断的完整链,非互补序列在细胞中是不被容忍的,其中一个链必须通过DNA的修复过程来固定从而匹配另外一个链,而完整的链则通常会被优先保留;因此作者通常必须使用第二种RNA向导来指导对完整链的切割,从而增加修复该链以匹配编辑序列的机会;研究者通过高效精确地将大量序列引入到DNA中,从而展示了prime编辑的多功能性,比如,研究人员在人类胚胎肾细胞中使用该技术来纠正产生血液镰刀细胞病的突变,同时还能对引发神经性Tay-Sachs病的突变进行编辑,这几乎完全避免了不完美的编辑,同时研究者还在体外对人类癌细胞和小鼠神经元进行了编辑。(生物谷 Bioon.com)
生物谷2019年终盘点正在进行,更多精彩盘点,敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


