新型CRISPR工具或能通过将RNA复制到基因组中**修饰基因
来源:本站原创 2019-11-18 21:56
2019年11月19日 讯 /生物谷BIOON/ --构成生命蓝图的DNA序列变异对任何物种的健康都是至关重要的,成千上万的DNA突变被认为都会导致疾病,经过几十年的遗传学和分子生物学研究后,如今研究人员在开发能够纠正突变的基因组编辑工具上取得了巨大的进展,但由于工具依赖于复杂和相互竞争的细胞过程,基因编辑的效率和准确性似乎受到了根本性的限制;近日,一项刊登在国际杂志Nature上的研究报告中,研
2019年11月19日 讯 /生物谷BIOON/ --构成生命蓝图的DNA序列变异对任何物种的健康都是至关重要的,成千上万的DNA突变被认为都会导致疾病,经过几十年的遗传学和分子生物学研究后,如今研究人员在开发能够纠正突变的基因组编辑工具上取得了巨大的进展,但由于工具依赖于复杂和相互竞争的细胞过程,基因编辑的效率和准确性似乎受到了根本性的限制;近日,一项刊登在国际杂志Nature上的研究报告中,研究者Anzalone等人描述了一种“查找并替换”(search-and-replace)的基因组编辑技术,即将两种分子机器相结合来精确改变基因组,该技术对于生物医学科学研究具有直接且深远的影响。
人类对基因组进行改造的努力早于对基因乃至遗传起源的了解,第一个基因组工程依靠自然变异和通过选择性繁殖的人工选择。比如,现代玉米就是通过9000多年前的人工选择,从其野生型祖先-大刍草(Teosinte,墨西哥玉米)进化而来;后来人们意识到DNA序列会影响生命,同时还能利用诱变剂(比如辐射或化学药物)来增强和加速人工进化,这就推动了后代的发展。
图片来源:Randall J. Platt. doi: 10.1038/d41586-019-03392-9
接下来科学家们发现,修复DNA序列错误的细胞过程可能会被劫持,其能允许来自外源性模板的DNA序列在DNA断裂时插入到基因组中,如果DNA被故意破坏,这个过程就会被大大加强,这一发现引发了科学家们20多年来对一种酶类的研究,这种酶类可以在科学家们感兴趣的任意位点来切割DNA,最终研究人员采用了细菌的CRISPR-Cas9系统,其中Cas9酶类能够利用一种定制化的RNA向导来在人类细胞中寻找DNA序列并进行切割。
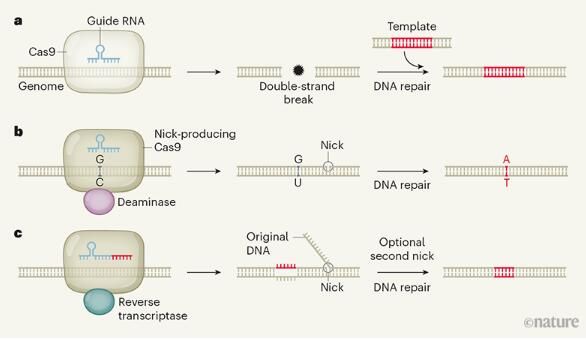
CRISPR-Cas9系统能够帮助所有研究人员对基因组进行编辑,这引发了生物医学研究领域的一场革命,然而最终其也仅仅是一把能够切割DNA的分子剪刀,由于对DNA的切割对细胞会带来致命性的作用,因此必须通过许多独立途径中的一种对其进行紧急修复;在基因组编辑的背景下,研究者所想得到的结果常常是通过DNA来指导修复,从而实现更加精确地编辑,但大多数细胞更喜欢利用另一种机制,在这种机制中,DNA模板会被忽略,而DNA的两个断裂末端并不会被完美地缝合在一起,这或许就是基因组编辑的主要限制。
过去几年,研究人员重点集中在将不完美的平衡转化为精确的基因编辑,其中一种有效的策略就是对DNA进行编辑而不切断双螺旋中的两条DNA链,双链的断裂时导致不完美编辑的主要原因,在这方面的一个里程碑就是对碱基编辑的发展,在该过程中,只切割一条DNA链的Cas9酶能与另一种酶类相结合,然而,碱基编辑的技术限制及需要修改的不仅仅是单个DNA碱基,意味着科学家们仍然迫切需要开发出新型的基因编辑方法。
为此,研究者Anzalone等人开发出了一种名为prime编辑(prime editing)的新型基因编辑技术,该技术依赖于一种混合分子机器,其包括一个改良版本的Cas9,其金辉切割两条DNA链中的一条,和一个转录酶,同时会在切割位点安装新的和可定制的DNA;这种组合与酵母中自然发生的过程非常相似,在酵母中,与RNA序列相对应的DNA会通过逆转录酶整合到基因组中去。
prime编辑能被一种工程化、两部分组成的RNA向导进行调节,向导中的“寻找”部分会指导Cas9进入到DNA靶点的特殊序列,从而对其中一条DNA链进行切割,随后,逆转录酶会在RNA向导的替换部位产生与该序列互补的DNA,并将其安装在被切割的其中一个DNA末端处,从而取代原来的DNA序列。
此时,被修饰的双链DNA会由两条不互补的链组成,即被编辑过的链和未被Cas9切断的完整链,非互补序列在细胞中是不被容忍的,其中一个链必须通过DNA的修复过程来固定从而匹配另外一个链,而完整的链则通常会被优先保留;因此作者通常必须使用第二种RNA向导来指导对完整链的切割,从而增加修复该链以匹配编辑序列的机会;研究者通过高效精确地将大量序列引入到DNA中,从而展示了prime编辑的多功能性,比如,研究人员在人类胚胎肾细胞中使用该技术来纠正产生血液镰刀细胞病的突变,同时还能对引发神经性Tay-Sachs病的突变进行编辑,这几乎完全避免了不完美的编辑,同时研究者还在体外对人类癌细胞和小鼠神经元进行了编辑。
几十年来,基因组编辑的潜力一直受到难以进行精确修改的限制,因此很多技术主要集中在不完美的DNA编辑有用的情况下,这种基因编辑能用来破坏基因的功能,并未理解其功能提供了一定的途径;如今prime编辑技术能够更快更容易地建立或纠正多个特定的突变,与此前相比,其能够对更多类型的细胞进行操作。
尽管如此,prime编辑技术也尤其局限性,发生在prime编辑组分之间的复杂、多步分子“舞蹈”还无法被预测,而且其并不总是会如预期那样出现;因此仍然可能出现不完全的随机编辑,这意味着研究人员可能需要测试几个组分的不同组合,从而确定每个感兴趣编辑所需要的编排方式;其次,将大型的prime编辑系统引入到特定的细胞类型中非常具有挑战性,因为之前许多尝试都在Cas9系统中失败了。
基于这样的研究目的,这些限制或许是不方便的,后期研究人员还会进行更为深入的研究对其进行克服,并更好地理解和调整当前方法;但是,对于医学应用而言,这些问题提出了很大的挑战,即不完美的DNA编辑是不可接受的,且将prime编辑系统引有效引入到细胞中将会至关重要;因此,尽管prime编辑能对生命的蓝图进行空前地控制,但只有时间才能够证明其是CRISPR工具箱中另一种治疗遗传性疾病的万能药物。(生物谷Bioon.com)
参考资料:
【1】Randall J. Platt. CRISPR tool modifies genes precisely by copying RNA into the genome, Nature (2019) doi:10.1038/d41586-019-03392-9
【2】Andrew V. Anzalone, Peyton B. Randolph, Jessie R. Davis, et al. Search-and-replace genome editing without double-strand breaks or donor DNA. Nature (2019) doi:10.1038/s41586-019-1711-4
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


