中国选择性RET抑制剂!基石药业普吉华®(普拉替尼)新适应症申请被纳入优先审评:治疗甲状腺癌!
来源:本站原创 2021-04-27 02:53
普拉替尼(pralsetinib)是一种强效RET抑制剂,具有“不限癌种”潜力。

2021年04月26日讯 /生物谷BIOON/ --基石药业(CStone Pharmaceuticals)近日宣布,选择性RET抑制剂普吉华®(普拉替尼胶囊,pralsetinib)扩展适应症申请已获中国国家药品监督管理局(NMPA)受理并被纳入优先审评,该项扩展适应症包括:(1)需要系统性治疗的晚期或转移性转染重排(RET)基因突变甲状腺髓样癌(MTC);(2)需要系统性治疗且放射性碘难治(如放射性碘适用)的晚期或转移性RET融合阳性甲状腺癌(TC)。
今年3月,NMPA批准普拉替尼(pralsetinib)以商品名普吉华®上市销售,用于既往接受过含铂化疗的RET基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的治疗。值得一提的是,普吉华®是中国首个获批的选择性RET抑制剂。
此次普吉华®扩展适应症的受理是基于一项全球I/II期ARROW临床研究,该研究旨在评估普拉替尼在RET融合阳性的非小细胞肺癌(NSCLC)、甲状腺癌以及其它携带RET变异的晚期实体瘤患者中的安全性、耐受性和有效性。
2020年9月,欧洲医学肿瘤学会(ESMO)虚拟大会上公布了ARROW研究RET突变MTC患者的数据。截至2020年2月13日数据截止日的结果显示,在接受400mg每日一次的起始剂量的疗效可评估的患者中,普拉替尼具有强效而持久的抗肿瘤活性。在53名既往接受卡博替尼(cabozantinib)或凡德他尼(vandetanib)治疗的患者中,客观缓解率(ORR)为60%(95%CI:46%-74%),一例缓解待确认,中位持续缓解时间(DOR)尚未达到(95%CI:不可评估)。在19名未经系统性治疗的患者中,确认的ORR为74%(95%CI:49%-91%),中位DOR尚未达到(95%CI:7个月-不可评估)。在ARROW研究包括RET变异的438名肿瘤患者中,研究者报告的最常见的治疗相关不良事件(≥15%)是天门冬氨酸转氨酶升高、贫血、丙氨酸转氨酶升高、高血压、便秘、白细胞计数降低、中性粒细胞减少症、中性粒细胞计数降低和高磷血症。
普拉替尼(pralsetinib)是一种口服、强效、选择性RET抑制剂,由基石药业合作伙伴Blueprint Medicines公司开发。2018年6月,基石药业与Blueprint Medicines公司达成了独家合作和许可协议,获得普拉替尼在大中华地区,包括中国大陆、香港、澳门和台湾地区的独家开发和商业化权利。
值得一提的是,2020年7月,罗氏与Blueprint Medicines签署一项许可及合作协议,获得了在美国以外地区(不包括大中华区)合作开发和商业化口服RET抑制剂普拉替尼的独家权利。在美国,罗氏旗下基因泰克获得了普拉替尼联合商业化权利,并平等分享利润。
普拉替尼的英文商品名为Gavreto,于2020年9月率先获得美国FDA批准治疗肺癌、2020年12月获FDA批准治疗甲状腺癌。在美国,该药适用于治疗:(1)经FDA批准的检测方法检测证实为转移性RET融合阳性非小细胞肺癌的成年患者;(2)需要系统治疗的12岁及以上晚期或转移性RET突变甲状腺髓样癌成人和儿童患者;(3)以及需要系统治疗且放射性碘(如适用)难治的12岁及以上晚期或转移性RET融合阳性甲状腺癌成人和儿童患者。
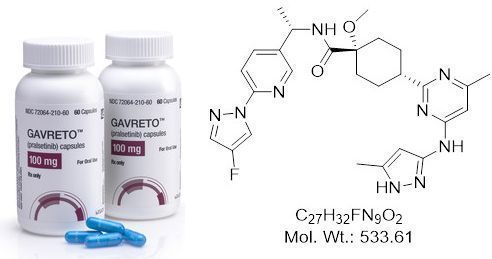
普拉替尼pralsetinib分子结构式(图片来源:aobious.com)
RET激活型融合和突变是许多癌症类型的关键疾病驱动因素,包括NSCLC和MTC。RET融合涉及约1-2%的NSCLC患者、约10-20%的甲状腺乳头状癌(PTC)患者,而RET突变牵涉到约90%的晚期MTC患者。此外,在结直肠癌、乳腺癌、胰腺癌和其他癌症中,也观察到低频率的RET改变,在耐药、EGFR突变的NSCLC患者中也观察到RET融合。
普拉替尼(pralsetinib)是由Blueprint Medicines的研究团队依据其专有化合物文库所设计的。在临床前研究中,pralsetinib针对最常见RET基因融合、激活突变和耐药突变始终表现出次纳摩尔水平的效价。此外,pralsetinib对RET的选择性与已批准的多激酶抑制剂相比有显著提高,其中,对RET有效性与VEGFR2相比有超过90倍的提高。通过抑制原发和继发突变,pralsetinib有望克服和预防临床耐药性的发生。这种治疗方法预期可以在携带不同RET变异的患者中实现持久的临床缓解,且具有良好的安全性。

Retevmo-selpercatinib分子结构式(图片来源medchemexpress.cn)
值得一提的是,礼来Retevmo(selpercatinib)是第一个被批准的RET抑制剂。该药由礼来旗下肿瘤学公司Loxo Oncology开发,于2020年5月获得美国FDA批准,用于治疗RET基因存在基因改变(突变或融合)的3种类型肿瘤患者:非小细胞肺癌(NSCLC)、甲状腺髓样癌(MTC)、其他类型的甲状腺癌。
用药方面,Retevmo每日口服2次,可与或不与食物同服。Retevmo是第一个被批准专门用于携带RET基因改变的癌症患者的治疗药物。该药适用于治疗:(1)晚期或转移性NSCLC成人患者;(2)年龄≥12岁、需要系统治疗的晚期或转移性MTC患者;(3)年龄≥12岁、需要系统治疗、对放射性碘治疗停止应答或不适合放射性碘治疗的晚期RET融合阳性甲状腺癌患者。特别值得一提的是,高达50%的RET融合阳性NSCLC患者可能存在肿瘤脑转移,在存在基线脑转移的患者中,Retevmo显示出强劲疗效,颅内缓解(CNS-ORR)高达91%(n=10/11)。(生物谷Bioon.com)
原文出处:基石药业、生物谷
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


