CAR-T细胞疗法研究进展(第26期)
来源:本站原创 2022-03-01 20:58
2022年3月30日讯/生物谷BIOON/---CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被 认为是最有前景的肿瘤治疗方式之一。正如所有的技术一
2022年3月1日讯/生物谷BIOON/---CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被 认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实 验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产 生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Nature:揭示CAR-T细胞可在人体内持续存在至少10年,并实现白血病持续缓解
doi:10.1038/s41586-021-04390-6
2010年夏天,Bill Ludwig和Doug Olson正在与一种叫做慢性淋巴细胞白血病(CLL)的凶恶血癌作斗争。他们都接受了许多治疗,由于剩下的治疗选择越来越少,他们自愿成为美国宾夕法尼亚大学艾布拉姆森癌症中心和佩雷尔曼医学院正在进行的一项实验性疗法临床试验的首批参与者。该疗法将根除他们的晚期白血病,成为全球的头条新闻,并开创一个高度个性化的医学新时代。
在这种称为嵌合抗原受体(CAR)T细胞(CAR-T)疗法的实验性疗法中,经过基因改造的靶向肿瘤细胞的T细胞是用每名患者自己的T细胞为他们制作的活体药物。如今,在一项新的研究中,来自宾夕法尼亚大学和费城儿童医院的研究人员发表了对这两名患者的分析,解释了CAR-T细胞疗法记录到目前为止对CLL的最长持续时间,并显示CAR-T细胞在输注到患者体内后至少十年仍可检测到,这两名患者的病情持续缓解。相关研究结果于2022年2月2日在线发表在Nature期刊上,论文标题为“Decade-long leukaemia remissions with persistence of CD4+ CAR T cells”。
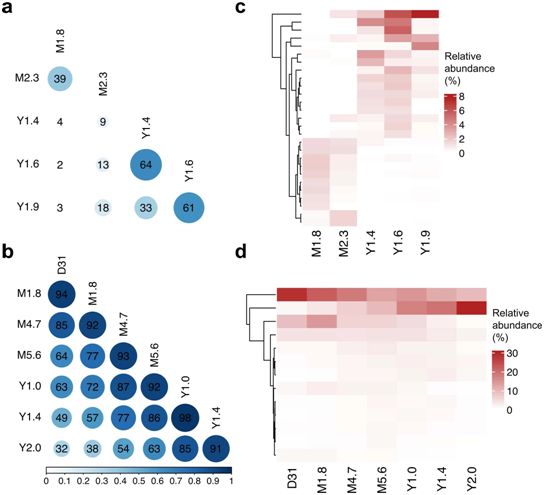
基于T细胞受体测序数据,分析患者1、2体内的CAR-T细胞克隆进化。图片来自Nature, 2022, doi:10.1038/s41586-021-04390-6。
2.Nat Commun:新研究表明GRP78 CAR-T细胞有望高效安全地治疗急性髓细胞性白血病
doi:10.1038/s41467-022-28243-6
在一项新的研究中,来自美国圣犹大儿童研究医院的研究人员开发出首个靶向GRP78的嵌合抗原受体(CAR)T细胞(CAR-T,下称GRP78 CAR-T)。他们的GRP78 CAR-T细胞在实验室中成功靶向并摧毁了急性髓细胞性白血病(AML)细胞。相关研究结果于2022年1月31日发表在Nature Communications期刊上,论文标题为“CAR T cells redirected to cell surface GRP78 display robust anti-acute myeloid leukemia activity and do not target hematopoietic progenitor cells”。
这些作者确定GRP78为候选的AML抗原,因为它在AML癌细胞表面上表达,但在正常骨髓中不表达。GRP78存在于每个细胞的内质网中。在正常细胞中,GRP78在应对内质网应激时过度表达,然后细胞要么死亡要么恢复正常。在AML癌细胞中,GRP78过度表达并转位到细胞表面,使其成为CAR-T细胞疗法的一种有吸引力的靶标。
在圣犹大儿童研究医院,这些作者使用一种肽来识别抗原GRP78,基于此设计出他们的GRP78 CAR-T细胞,从而使得它的抗原识别结构域更小。为了解决CAR-T细胞的持久性问题,他们使用达沙替尼(dasatinib)来设计他们的CAR。达沙替尼是一种获得美国食品药品管理局(FDA)批准的药物,最近被证实可以通过让CAR-T细胞“休息”来改善它们的功能。CAR-T细胞的制造对T细胞来说是一种应激性的过程,会导致GRP78暂时迁移到它们的表面。他们发现,达沙替尼不仅改善了T细胞的功能,而且还阻止了GRP78暂时迁移到CAR-T细胞的表面。通过阻断GRP78向细胞表面的迁移,达沙替尼防止GRP78 CAR-T细胞彼此相互混淆作为靶标进行攻击。这提高了GRP78 CAR-T细胞的适应性,使它们能够持续更长时间,更有效地清除癌细胞。
3.Science:重大突破!注射脂质纳米颗粒封装的mRNA在体内产生CAR-T细胞,可显著逆转心脏纤维化
doi:10.1126/science.abm0594
在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员发现类似于基于信使RNA(mRNA)的COVID-19疫苗,一种实验性免疫疗法只需注射一次mRNA就能暂时重编程患者的免疫细胞以攻击特定靶标。相关研究结果发表在2022年1月7日的Science期刊上,论文标题为“CAR T cells produced in vivo to treat cardiac injury”。
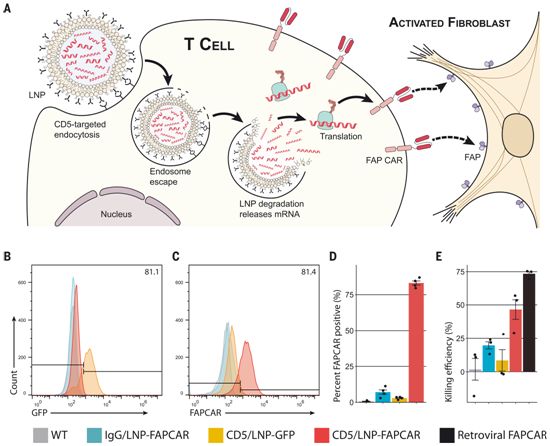
靶向CD5的脂质纳米颗粒在体外产生功能性的、基于mRNA的FAPCAR T细胞。图片来自Science, 2022, doi:10.1126/science.abm0594。
4.Nat Chem Biol:开发出可作为微型制药厂的CAR-T细胞,不受T细胞衰竭的影响
doi:10.1038/s41589-021-00932-1
被称为嵌合抗原受体(CAR)T细胞(CAR-T)的免疫疗法使对来自患者自身的T细胞进行基因改造来对抗癌症。这类疗法为癌症治疗注入了活力,尤其是对某些类型的血癌患者。如今,在一项新的研究中,来自美国纪念斯隆-凯特琳癌症中心(SKI)的研究人员开发出新的CAR-T细胞,它们可以做一些它们的前辈不能做的事情:制造药物。相关研究结果于2021年12月30日在线发表在Nature Chemical Biology期刊上,论文标题为“Engineering CAR-T cells to activate small-molecule drugs in situ”。
尽管它们对治疗血癌很有用,但目前的CAR-T模型有几个限制。其一是CAR-T细胞只能杀死含有它们经基因改造后可识别的标志物的癌细胞。然而癌细胞停止制造这种标志物因而 “逃避”这种疗法的情况并不少见。第二个问题是CAR-T细胞可能经历“衰竭”,甚至被癌细胞本身抑制。最后,现有的CAR-T细胞只对它们能轻易到达的血癌有良好的效果。对于肺部或乳腺中密集的实体瘤,它们大多无能为力。
为了克服这些障碍,这些作者设计出一种全新的作为一种“微型制药厂”起作用的CAR-T细胞:它可以直接向肿瘤提供有毒的药物载荷,杀死含有癌症标志物的肿瘤细胞,以及附近不含这种标志物的癌细胞。更重要的是,CAR-T细胞即使处于衰竭状态时也能产生药物,而且所产生的药物不受癌症抑制。
论文共同通讯作者、SKI分子药理学项目主任David A. Scheinberg说,“我们称它们为SEAKER细胞。SEAKER是合成酶武装的杀伤(Synthetic Enzyme-Armed KillER)细胞的缩写。这些细胞结合了免疫细胞的靶标搜索能力和局部产生强效抗癌药物的能力,以达到双重效果。”
5.Blood Cancer Discov:阻断γ干扰素有望降低CAR-T细胞的不良反应
doi:10.1158/2643-3230.BCD-21-0181
在一项新的研究中,来自美国麻省总医院的研究人员开发出一种新的方法,它有潜力减少与嵌合抗原受体(CAR)T细胞(CAR-T)疗法相关的严重不良反应。相关研究结果于2021年12月10日在线发表在Blood Cancer Discovery期刊上,论文标题为“Blockade or deletion of IFNg reduces macrophage activation without compromising CAR-T function in hematologic malignancies”。论文通讯作者为麻省总医院细胞免疫学项目主任Marcela Maus博士。

来自健康供者免疫系统的人T细胞的扫描电镜图,图片来自NIAID。
Maus总结说,“综合来看,这提示着我们可以将毒性和疗效分开。阻断或敲除CAR-T细胞中的这种细胞因子可能能够预防或治疗细胞因子释放综合征,同时仍然保留[CAR-T细胞疗法]的抗肿瘤效果。这可能使CAR-T细胞成为患者更容易接受的疗法。”Maus指出,还需要进行更多的研究来了解IFNγ在CAR-T细胞治疗实体瘤中的作用。
6.Nat Commun:新鲜制造的靶向CD19的CAR-T细胞比低温冻存的CAR-T细胞更有效地治疗B细胞恶性肿瘤
doi:10.1038/s41467-021-27312-6
新设计的靶向CD19抗原的嵌合抗原受体(CAR)T细胞(CAR19-T)对治疗成人和儿童B细胞恶性肿瘤患者很有效,尤其是在大学附属医院塞德曼癌症中心(University Hospitals Seidman Cancer Center)提供的医疗场所制造时。这是2021年12月10日发表在Nature Communications期刊上的一项新的研究得出的结论。该研究详细介绍了用于治疗复发性/难治性小儿B细胞急性淋巴细胞白血病(ALL)或成人B细胞淋巴瘤患者的CAR19-T细胞的两项I期临床试验。
这两项I期临床试验涉及31名儿童患者和23名成人患者,分别位于俄罗斯和美国克利夫兰市。经过17个月的中位随访,ALL完全反应者的一年生存率为79.2%,中位反应时间为10.2个月。对于非霍奇金淋巴瘤(NHL),完全反应者的一年生存率为92.9%,中位反应持续时间尚未达到。
CAR19-T细胞首先在癌症细胞系和小鼠异种移植模型中进行了测试,均获得积极的结果。在小鼠异种移植实验中,当地设施生产的新鲜CAR19-T细胞被证明比在CAR-T细胞治疗应用中更常用的细胞低温冻存具有优势。在研究的第11天和第13天,与剂量匹配的低温冻存的CAR19-T细胞相比,输注新鲜制造的CAR19-T细胞可显著降低肿瘤负荷。在研究的第21天和第28天,用新鲜制造的CAR19-T细胞和低温冻存的CAR19-T细胞治疗的小鼠组别都对肿瘤产生类似的强效排斥。然而,新鲜制造的CAR19-T细胞提前8天减少了肿瘤负荷,并立即开始减少肿瘤负荷,而低温冻存的CAR19-T细胞在控制生长之前首先允许肿瘤生长。
7.Nat Med:病例研究显示一名多发性骨髓瘤患者在接受BCMA CAR-T细胞治疗出现类似于帕金森病的神经系统症状
doi:10.1038/s41591-021-01564-7
在一项新的研究中,来自美国西奈山伊坎医学院的研究人员首次报告与一种称为CAR-T细胞疗法的新形式免疫疗法有关的潜在严重副作用,其中这种CAR-T细胞疗法近期被批准用于治疗多发性骨髓瘤。他们的发现作为病例研究发表在2021年12月的Nature Medicine期刊上,论文标题为“Neurocognitive and hypokinetic movement disorder with features of parkinsonism after BCMA-targeting CAR-T cell therapy”。

人淋巴细胞的电子显微图,图片来自Dr. Triche/National Cancer Institute。
论文第一作者、西奈山伊坎医学院博士生Oliver Van Oekelen说,“我们的发现将影响BCMA CAR-T细胞疗法治疗多发性骨髓瘤的风险-效益评估,并且已经导致BCMA靶向疗法的临床试验对神经系统不良事件的监测和主动管理得到改善。”
8.Blood Cancer Discov:新研究指出NGS-MRD可准确预测CAR-T细胞治疗后的白血病复发,并有足够的时间进行干预
doi:10.1158/2643-3230.BCD-21-0095; doi:10.1158/2643-3230.BCD-21-0199
在一项新的研究中,美国南加州大学凯克医学中心儿科教授Michael Pulsipher博士及其团队发现在接受tisagenlecleucel(Kymriah)治疗的儿童和年轻成人急性淋巴细胞白血病(ALL)患者中,基于DNA测序的治疗3至12个月后的残留疾病检测能准确识别所有最终会复发的患者,而其他方法的预测性则较差。相关研究结果于2021年12月1日在线发表在Blood Cancer Discovery期刊上,论文标题为“Next-Generation Sequencing of Minimal Residual Disease for Predicting Relapse after Tisagenlecleucel in Children and Young Adults with Acute Lymphoblastic Leukemia”。
在这项新的研究中,Pulsipher及其同事们利用从ELIANA和ENSIGN二期临床试验中收集的血液和骨髓样本,在输注tisagenlecleucel后的1、3、6、9和12个月,调查了流式细胞仪以及下一代DNA测序最小残留疾病(next-generation DNA sequencing minimal residual disease, NGS-MRD)监测的预测价值。利用流式细胞仪可分析细胞是否存在CD9、CD10、CD13、CD19、CD20、CD22、CD33、CD34、CD38、CD45、CD58、CD66c和CD123。利用下一代DNA测序(NGS),就可分析IgH、IgK和IgL的基因序列的重排和易位。
T细胞,图片来自CC0 Public Domain。
对骨髓样本的NGS-MRD监测在预测复发方面比流式细胞仪更准确。在输注tisagenlecleucel 3个月或6个月后有任何可检测到的疾病DNA的患者中,100%经历了复发或进展到另一种疗法,只有一名失去随访的患者除外。NGS-MRD检测也能在复发前找到那些有风险的人。那些NGS-MRD阳性水平最低的患者在阳性检测后平均168天复发,而且该检测方法能检测出100%的复发。相比之下,流式细胞术在复发前平均52天检测为阳性,并且有50%的复发被错过。
9.Cell子刊:T细胞衰竭影响CAR-T细胞临床疗效
doi:10.1016/j.celrep.2021.110079
在一项新的研究中,这些研究人员使用了来自一项称为SJCAR19的临床试验的样本,这是首个在圣犹大儿童研究医院开展的CAR-T细胞治疗临床研究。利用这些临床数据,他们能够确定为什么CAR-T细胞疗法的效果会随着时间的推移而减弱。相关研究结果发表在2021年11月30日的Cell Reports期刊上,论文标题为“CD19-CAR T cells undergo exhaustion DNA methylation programming in patients with acute lymphoblastic leukemia”。
为了更深入地了解与CAR-T细胞分化相关的分子特征,这些作者在急性淋巴细胞白血病(ALL)患者输注中的靶向CD19的CD8+ CAR-T细胞进行了纵向全基因组DNA甲基化分析。他们报告说,CAR-T细胞在效应物相关基因上经历了快速和广泛的抑制性DNA甲基化重编程。CAR-T细胞在输注后的变化进一步表现为与记忆潜力相关的基因(如TCF7和LEF1)受到抑制,以及与DNA甲基化特征相关的基因(如CX3CR1、BATF和TOX的去甲基化)受到抑制,这标志着向衰竭祖细胞T细胞(exhaustion-progenitor T cell)过渡。因此,CAR-T细胞经历了与衰竭相关的DNA甲基化程序,因此阻止这一过程可能是提高CAR-T细胞疗效的一种有吸引力的方法。
10.Cell:重大进展!抑制ID3或SOX4可逆转T细胞衰竭,有望让CAR-T细胞更高效地对抗实体瘤
doi:10.1016/j.cell.2021.11.016
称为CAR-T细胞的特殊工程化免疫细胞已被证明是对付血癌的有力武器,但它们对付实体瘤的效果要差得多,部分原因在于一种称为T细胞衰竭的过程。如今,在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员阐明了T细胞衰竭的关键分子细节,指出了克服这一过程的具体策略。相关研究结果于2021年12月2日在线发表在Cell期刊上,论文标题为“An NK-like CAR T cell transition in CAR T cell dysfunction”。

图片来自Cell, 2021, doi:10.1016/j.cell.2021.11.016。
论文共同通讯作者、宾夕法尼亚大学佩雷尔曼医学院病理学与实验室医学系免疫疗法教授Carl June博士说,“这使我们离下一代CAR-T细胞疗法更近了一步,它对实体癌的疗效将更大。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


