肝癌(HCC)双重免疫一线治疗!阿斯利康Imfinzi+tremelimumab方案显示前所未有生存益处:3年存活率31%!
来源:本站原创 2022-01-20 00:38
Imfinzi和tremelimumab均为免疫检查点抑制剂,Imfinzi可阻断PD-L1,tremelimumab可阻断CTLA-4。

2022年01月19日讯 /生物谷BIOON/ --阿斯利康(AstraZeneca)近日公布了HIMALAYA 3期试验的阳性结果,数据显示:在既往未接受过系统治疗且不符合局部治疗资格的不可切除性肝细胞癌(HCC)患者中,与口服多激酶抑制剂索拉非尼(sorafenib)相比,将单次高启动剂量tremelimumab(抗CTLA-4单抗)添加至抗PD-L1疗法Imfinzi(英飞凡,通用名:durvalumab,度伐利尤单抗)用于一线治疗,显示出具有统计学意义和临床意义的总体生存(OS)益处。
该试验中,Imfinzi+tremelimumab组成的这种新的给药和治疗方案称为STERID方案(单次给药tremelimumab+常规间隔给药[4周一次]durvalumab)。在2020年1月,Imfinzi与tremelimumab均被美国FDA授予了治疗HCC的孤儿药资格(ODD)。
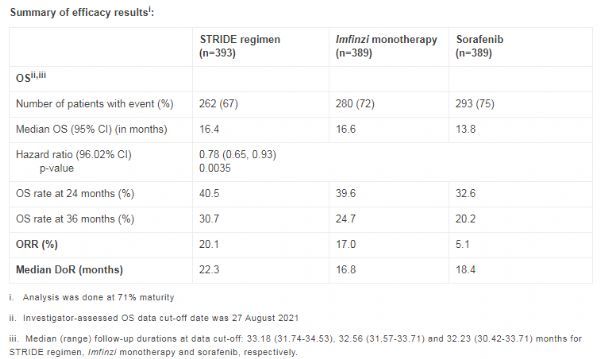
结果显示:STERID方案一线治疗不可切除性HCC显示出前所未有的生存率,3年生存率达到31%,而索拉非尼治疗组3年生存率为20%。该研究中,STERID方案显示出良好的安全性,在Imfinzi中添加tremelimumab不会增加严重肝脏毒性。该研究中,与索拉非尼相比,Imfinzi单药治疗在OS方面显示出非劣性,数值趋势有利于Imfinzi,耐受性也有所改善。
肝癌是全球癌症死亡的第三大原因,也是全球第六大最常见癌症类型,肝细胞癌(HCC)约占原发性肝癌的75%。每年,在美国、欧盟、日本约有8万人、中国约有2.6万人患有晚期、不可切除性HCC。HCC患者中,约80-90%也存在肝硬化,这主要是由乙肝病毒(HBV)或丙肝病毒(HCV)感染引起的。慢性肝病与炎症有关,随着时间的推移,炎症导致免疫抑制,并可导致HCC的发展。
肝癌独特的免疫环境为研究利用免疫系统的力量来治疗HCC的药物提供了明确的理论基础。对于面临有限治疗选择的HCC患者,存在着一个关键的未满足医疗需求。一半以上的患者在疾病的晚期阶段被诊断出,通常是在症状首次出现时。在晚期HCC患者中,5年存活率仅为7%。
HIMALAYA试验结果
HIMALAYA 3期试验的首席研究员、纪念斯隆凯特林癌症中心主治医师Ghassan Abou-Alfa表示:“不可切除性HCC患者面临着糟糕的预后,拥有可改善长期生存的新治疗方案至关重要。STERID方案的3年总生存率和良好的安全性为一线治疗不可切除性HCC设定了新的基准,并强调了这一创新治疗方法的潜力。”
阿斯利康肿瘤研发部执行副总裁Susan Galbraith表示:“HIMALAYA试验强化了我们对tremelimumab的科学方法,利用CTLA-4抑制的潜力和独特的给药方案来启动免疫系统,以帮助患者存活得更久且副作用最小。我们期待着尽快为无法切除的HCC患者带来这种潜在的新治疗选择,这是一个有着高度未满足医疗需求的领域。”
HIMALAYA是一项随机、开放标签、多中心、全球性3期临床试验,正在评估Imfinzi单药疗法、STERID方案(单次启动剂量300mg tremelimumab+1500mg剂量Imfinzi,然后每4周一次1500mg剂量Imfinzi)、标准治疗药物sorafenib(索拉非尼,一种多激酶抑制剂),用于先前未接受过系统治疗、且没有资格接受局部区域治疗(局限于肝脏的治疗)的不可切除性、晚期HCC患者。该研究正在美国、欧洲、加拿大、南美、亚洲等16个国家的189个临床中心开展,主要终点是总生存期(OS),关键次要终点包括客观缓解率(ORR)和无进展生存期(PFS)。
结果显示,与索拉非尼相比,采用STERID方案治疗的患者死亡风险降低了22%(HR=0.78;96.02%CI:0.65-0.93;p=0.0035)、OS显著延长(中位OS:16.4个月 vs 13.8个月)、3年生存率大幅提高(31% vs 20%)。此外,与索拉非尼相比,STERID方案的ORR显著提高(20.1% vs 5.1%)、中位缓解持续时间(DOR)延长(22.3个月 vs 18.4个月)。安全性方面,在Imfinzi中添加tremelimumab没有增加严重肝脏毒性,没有观察到出血风险。
该研究还对Imfinzi单药疗法进行了测试,结果显示,Imfinzi单药治疗的OS非劣效于索拉非尼(HR=0.86;95.67%CI:0.73-1.03;非劣效性界值1.08)、中位OS表现出改善(16.6个月 vs 13.8个月),且与索拉非尼相比耐受性有所改善。
该研究中,STERID方案和Imfinzi单独用药的安全性特征与每种药物的已知特征一致,并且没有发现新的安全性信号。STERID方案治疗组有25.8%的患者、Imfinzi单药治疗组有12.9%的患者、索拉非尼治疗组有36.9%的患者,出现3级或4级治疗相关不良事件(AE)。各治疗组3级或4级治疗相关肝脏事件的发生率较低(STERID方案组为5.9%,Imfinzi单药组为5.2%,索拉非尼组为4.5%)。与治疗相关的不良事件导致STERID方案组8.2%的患者、Imfinzi单药组4.1%的患者、索拉非尼组11%的患者停止治疗。
Imfinzi(英飞凡,度伐利尤单抗)是一种人单克隆抗体,靶向结合细胞程序性死亡因子配体1(PD-L1),阻断PD-L1与PD-1和CD80的相互作用,对抗肿瘤的免疫逃避策略并释放免疫反应的抑制作用。
基于3期PACIFIC研究的结果,Imfinzi是唯一被批准在不可切除性局部晚期(III期)NSCLC患者接受化放疗之后进行治愈性治疗的免疫疗法,现已成为全球标准护理方案。此外,基于3期CASPIAN研究的结果,Imfinzi也在全球多个国家(包括美国、整个欧盟、中国、日本)被批准用于治疗广泛期小细胞肺癌(ES-SCLC)。此外,Imfinzi也在多个国家被批准用于治疗先前接受过治疗的晚期膀胱癌患者。
tremelimumab是一种人单克隆抗体,靶向细胞毒性T淋巴细胞抗原4(CTLA-4),阻断CTLA-4的活性、促进T细胞活化、启动肿瘤免疫反应、促进癌细胞死亡。tremelimumab与百时美施贵宝已上市抗体药物Yervoy(伊匹木单抗)靶向的是同一个靶点CTLA-4。
作为新药研发项目的一部分,Imfinzi目前正以单药或者联合tremelimumab以及其它药物,探索在非小细胞肺癌、小细胞肺癌、膀胱癌、头颈癌、肝癌、宫颈癌、胆管癌和其它实体肿瘤等方向的治疗前景。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->