糖尿病重磅!礼来Trulicity获美国FDA批准,在有/无心血管疾病患者中降低心血管风险的降糖药
来源:本站原创 2020-02-22 15:10
2020年02月22日讯 /生物谷BIOON/ --礼来(Eli Lilly)近日宣布,美国食品和药物管理局(FDA)已批准每周一次胰高血糖素样肽-1受体激动剂(GLP-1RA)降糖药Trulicity(dulaglutide,度拉鲁肽),用于患有心血管(CV)疾病或存在多种心血管风险因素的2型糖尿病成人患者,降低主要不良心血管事件(MACE)发生风险。值得

2020年02月22日讯 /生物谷BIOON/ --礼来(Eli Lilly)近日宣布,美国食品和药物管理局(FDA)已批准每周一次胰高血糖素样肽-1受体激动剂(GLP-1RA)降糖药Trulicity(dulaglutide,度拉鲁肽),用于患有心血管(CV)疾病或存在多种心血管风险因素的2型糖尿病成人患者,降低主要不良心血管事件(MACE)发生风险。值得一提的是,此次批准使Trulicity成为第一个也是唯一一个被批准用于一级和二级预防人群降低MACE风险的2型糖尿病药物。
这一新适应症反映了Trulicity心血管结局试验REWIND的差异化患者群体。虽然所有的参与者都有心血管风险因素,但这项研究主要是由没有心血管疾病的患者组成。结果显示,与安慰剂相比,Trulicity将主要不良心血管事件(MACE 3:非致死性心肌梗死[心脏病发作]、非致死性卒中、心血管死亡的复合终点)风险显著降低了12%。此外,Trulicity在主要的人口统计学和疾病(包括有或无CV疾病)亚组中具有一致的MACE风险降低效应,在整个研究过程中,CV风险持续降低。Trulicity的安全性与GLP-1RA类药物一致,导致Trulicity停药的最常见不良事件是胃肠道事件。
根据REWIND研究结果,Trulicity是第一个在入组的大部分患者存在CV风险因素但无CV疾病的患者研究中显著降低MACE事件的2型糖尿病药物。糖尿病患者本身具有更高的CV风险。该研究数据非常重要,证实了Trulicity对广泛2型糖尿病患者群体的治疗益处。
REWIND研究主席、麦克马斯特大学医学教授及汉密尔顿健康科学学院人口卫生所副所长Hertzel Gerstein表示:“该试验旨在研究2型糖尿病的广泛人群,反映出普通人群中的患者群体。因此,我们评估了Trulicity对存在心血管疾病的患者以及存在多种心血管危险因素的患者的影响。在全球范围内,超过4.15亿人患有2型糖尿病,该病本身就是一个心血管危险因素。然而,只有大约三分之一的患者有心血管疾病,这就是为什么这一新的适应症和支持性证据对美国数百万糖尿病患者来说很重要。”
礼来医疗事务副总裁Sherry Martin表示:“这是首次,医疗保健提供者可以为患有和未患有心血管疾病的2型糖尿病患者处方一种被证明能显著降低心血管事件发生风险的糖尿病药物。Trulicity可以帮助患者实现血糖(A1C)控制目标,并通过每周一次的、易于使用的治疗选项,保护他们免受心血管事件的影响。”

Trulicity是一种胰高血糖素样肽-1(GLP-1)受体激动剂(RA),每周皮下注射一次,适用于结合饮食控制及锻炼,用于2型糖尿病成人患者改善血糖控制。GLP-1 RA是糖尿病药物中备受瞩目的一类药物。GLP-1 RA不是胰岛素,而是一类新型的胰岛素促分泌制剂,其作用机制与天然激素GLP-1类似,促进患者进食时机体自身胰岛素的分泌,具有降糖效果强、低血糖风险较低、同时具有减肥效果和使心血管获益的优势。
自2014年起在美国上市以来,Trulicity已成为第一大处方GLP-1RA。除了已被证实的降糖功效和易于使用的设备,Trulicity现在还可以用来帮助2型糖尿病患者降低心血管事件的风险。医药市场调研机构EvaluatePharma预测,Trulicity在2024年的销售额将达到71.3亿美元,成为全球最畅销的降糖药。
REWIND是一项多中心、随机、双盲、安慰剂对照研究,旨在评估每周一次Trulicity 1.5mg相对于安慰剂(均添加至标准护理)对2型糖尿病成人患者CV事件的作用。主要CV终点为主要不良心血管事件(MACE 3:包括心血管死亡、非致死性心肌梗死、非致死性卒中)的首次发生时间,次要终点包括主要CV终点中每个组成部分,以及包括视网膜或肾脏疾病在内的复合临床微血管预后、不稳定性心绞痛住院、需要住院治疗的心衰、需要就诊的紧急心衰、全因死亡率。研究共入组了全球24个国家的9901例2型糖尿病患者,这些患者平均病程为10.5年,平均基线A1C为7.2%。该研究中,虽然所有患者都有心血管危险因素,但仅31%患者在基线时存在CV疾病。
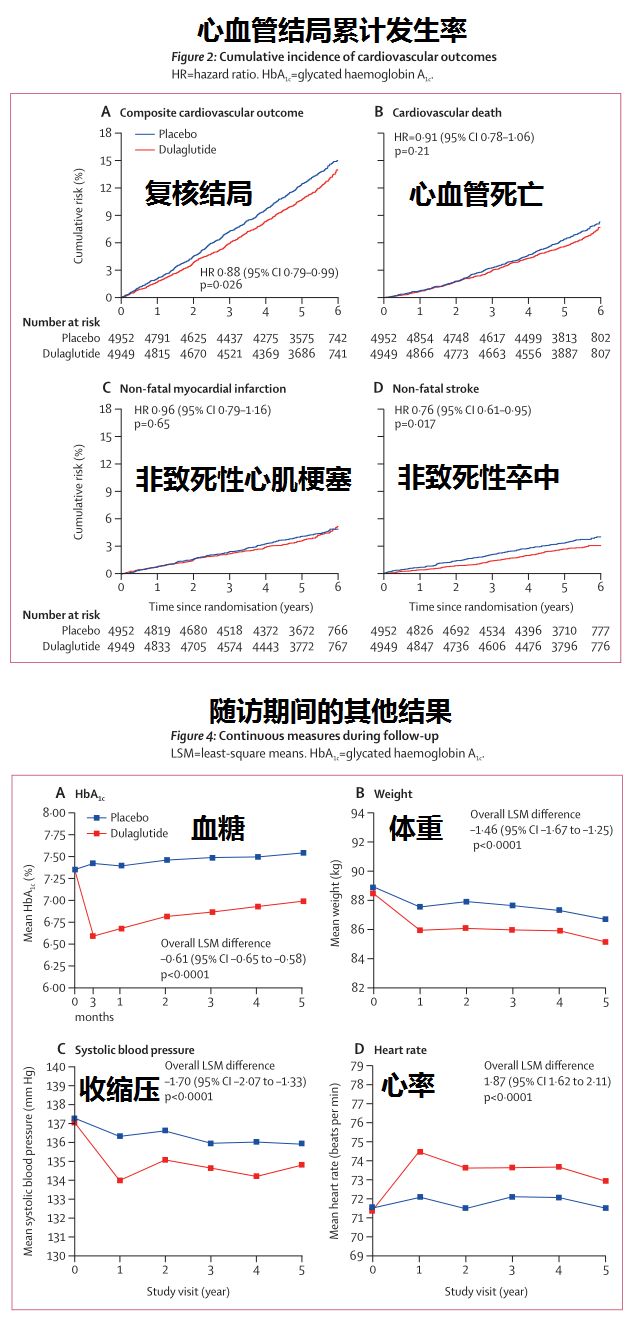
结果显示,该研究达到了主要疗效目标:在整个研究群体中,与安慰剂相比,Trulicity显著降低了MACE事件风险(HR=0.88,95%CI:0.79-0.99),这一疗效在各个亚组中均保持一致:(1)存在CV疾病(HR=0.87, 95% CI: 0.74-1.02)和不存在CV疾病(HR=0.87, 95% CI: 0.74-1.02);(2)基线A1C≥7.2%(HR=0.86, 95% CI: 0.74-1.00)和基线A1C<7.2%(HR=0.90, 95% CI: 0.76-1.06);(3)女性(HR=0.85, 95% CI: 0.71-1.02)和男性(HR=0.90, 95% CI: 0.79-1.04)。
MACE 3的各个组成部分均表现出风险降低,包括心血管死亡(HR=0.91,95%CI:0.78-1.06)、非致命性心脏病发作(HR=0.96,95%CI:0.79-1.16)和非致命性中风(HR=0.76,95%CI:0.61-0.95)。此外,Trulicity进一步显示降低了复合微血管结局(HR=0.87,95%CI:0.79-0.95)。对肾脏结局的分析表明,长期使用Trulicity与2型糖尿病患者肾脏疾病进展降低有关。
除了长期随访评估心血管结局外,REWIND研究还提供了Trulicity治疗糖尿病疗效的其他证据。与安慰剂相比,Trulicity使整个研究群体的A1C从中位基线7.2%降低(A1C:-0.46%[Trulicity],+0.16[安慰剂];体重:-2.95kg[Trulicity],-1.49kg[安慰剂])。该研究中,Trulicity的安全性与GLP-1受体激动剂类一致。导致Trulicity治疗中断的最常见不良事件是胃肠道事件。
REWIND研究与其他CV预后临床研究截然不同,这是由于入组该研究中已确诊CV疾病的患者较少,这也使得能够在广泛的2型糖尿病患者群体中评价Trulicity的CV效应。重要的是,REWIND研究的中位随访时间(中位随访5.4年)超过5年,是所有GLP-1RA CV预后研究中随访时间最长的研究。此外,该研究也是迄今为止所有糖尿病CV研究中具有最低基线A1C(7.2%)、女性(46.3%)与男性(53.7%)比例更为均衡的一项研究。这种患者群更能代表临床实践中常见的2型糖尿病患者。相比之下,其他CV预后研究中有更高比例的患者存在较高的基线A1C、并有更高比例的患者在基线时确诊CV疾病。
REWIND是一项雄心勃勃的研究,评估了Trulicity是否能保护无CV疾病患者免于经历首次CV事件,以及在存在CV疾病患者中是否能预防之后发生的CV事件。该研究结果清楚地显示,Trulicity在广泛的2型糖尿病群体中有效地降低了MACE事件风险,数据令人信服。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


