全球BCMA靶向疗法!葛兰素史克GSK2857916获欧盟EMA加速评估,治疗复发/难治多发性骨髓瘤!
来源:本站原创 2020-02-07 14:47
2020年02月07日讯 /生物谷BIOON/ --葛兰素史克(GSK)近日宣布,欧洲药品管理局(EMA)已受理该公司提交的一份营销授权申请(MAA),该MAA寻求批准B细胞成熟抗原(BCMA)靶向抗体药物偶联物(ADC)belantamab mafodotin(GSK2857916,2.5mg/kg剂量)的营销授权申请(MAA),用于治疗既往已接受过多种疗

2020年02月07日讯 /生物谷BIOON/ --葛兰素史克(GSK)近日宣布,欧洲药品管理局(EMA)已受理该公司提交的一份营销授权申请(MAA),该MAA寻求批准B细胞成熟抗原(BCMA)靶向抗体药物偶联物(ADC)belantamab mafodotin(GSK2857916,2.5mg/kg剂量)的营销授权申请(MAA),用于治疗既往已接受过多种疗法(包括一种免疫调节剂、一种蛋白酶体抑制剂、一种抗CD38抗体)的复发或难治性多发性骨髓瘤(R/R MM)患者。
目前,EMA人用医药产品委员会(CHMP)已启动对belantamab mafodotin进行加速评估。对于一种药物,如果CHMP从公共卫生的角度认定其具有重大意义,并代表治疗创新,则可给予加速评估。在2018年,欧盟有超过4.8万人被诊断为MM。
belantamab mafodotin有潜力成为上市的首个抗BCMA疗法。2017年,belantamab mafodotin获美国FDA授予突破性药物资格(BTD)以及欧盟EMA授予优先药物资格(PRIME),成为被授予BTD和PRIME的首个BCMA靶向制剂。这些资格认定旨在促进在重大未满足医疗需求领域具有临床前景的在研药物的开发。
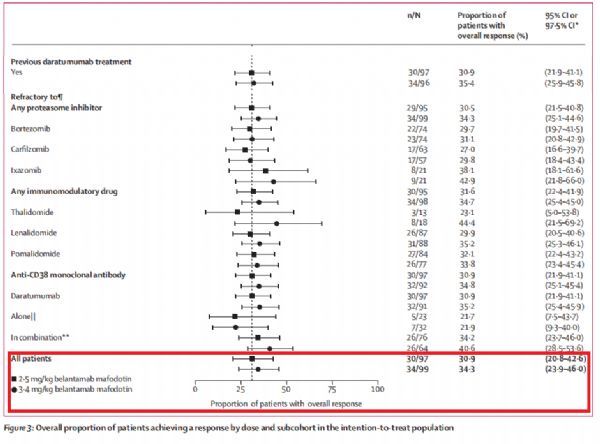
belantamab mafodotin的BLA和MAA,均基于单药治疗R/R MM的关键性临床研究DREAMM-2(NCT03525678)的数据,相关结果已发表于《柳叶刀肿瘤学》(The Lancet Oncology)。这是一项随机、开放标签、双臂II期研究,共纳入了196例既往过度治疗的(heavily pretreated)R/R MM患者,这些患者尽管接受当前的标准治疗但病情恶化、既往接受的治疗方案中位数为7种、对免疫调节药物和蛋白酶体抑制剂难治、并对抗CD38抗体难治和/或不耐受。研究中,患者被随机分为两组,接受每三周一次2.5mg/kg或3.4mg/kg剂量belantamab mafodotin治疗。
(图片来源文献:DOI:https://doi.org/10.1016/S1470-2045(19)30788-0)
结果显示,研究达到了主要终点:在这一难治性患者群体中,belantamab mafodotin 2.5mg/kg剂量组的总缓解率(ORR)为31%(n=30/97),3.4mg/kg剂量组的ORR为34%(n=34/99),数据具有临床意义。2.5mg/kg剂量组,在病情缓解的30例患者中,有18例病情获得了非常好的部分缓解或更好的缓解(≥VGPR),包括3例获得了严格完全缓解(sCR)。中位随访6个月,中位缓解持续时间(DoR)尚未达到,总生存期(OS)也尚未达到。
该研究中,belantamab mafodotin的安全性和耐受性与首个人体临床研究DREAMM-1中观察到的一致,2.5mg/kg组中最常见的3或4级不良反应为角膜病变(27%)、血小板减少(20%)和贫血(20%)。总的来说,DREAMM-2研究的患者比DREAMM-1研究的患者病情更为严重,预后和表现更差。而且与DREAMM-1研究相比,DREAMM-2研究的患者先前接受过更多种的治疗方案。DREAMM-2研究的结果与DREAMM-1研究中类似患者子集的结果一致。
接受目前可用的治疗方法但疾病仍在进展的R/R MM患者的治疗选择有限,预后也很差。来自DREAMM-2研究的数据显示,如果获得批准,belantamab mafodotin将为这些患者提供一个重要的新治疗选择。
DREAMM-1研究和DREAMM-2研究是DREAMM临床开发项目的一部分,该项目共包括10项临床研究(DREAMM-1至DREAMM-10),正在评估belantamab mafodotin作为单药疗法以及用于组合疗法一线、二线及多线治疗MM的疗效和安全性。
2019年3月,GSK公布了DREAMM-1研究的更新数据,这是评估belantamab mafodotin的首个人体临床研究,目的是调查该药在R/R MM和其他表达BCMA的晚期血液学恶性肿瘤患者中的疗效和安全性。结果显示,在BCMA阳性R/R MM患者中,belantamab mafodotin治疗的总缓解率(ORR)达到了60%。

多发性骨髓瘤(MM)是仅次于非霍奇金淋巴瘤的第二大常见血液学恶性肿瘤。近年来,尽管在化疗、蛋白酶体抑制剂、免疫调节剂沙利度胺衍生物和CD38靶向抗体方面取得了很大的进展,但几乎所有患者最终仍会复发。因此,对新治疗方案存在着迫切需求。MM市场2017年接近140亿美元,预计2027年将达到近290亿美元。
BCMA是一种极其重要的B细胞生物标志物,广泛存在于MM细胞表面,近年来已成为MM和其他血液系统恶性肿瘤的一个非常热门的免疫治疗靶点。目前,针对BCMA开发的免疫疗法超过20种,主要分为3类:嵌合抗原受体T细胞疗法(CAR-T,新基/蓝鸟生物、诺华为代表)、双特异性抗体(BsAb,安进为代表)、抗体药物偶联物(ADC,葛兰素史克为代表)。
belantamab mafodotin是一种新型人源化Fc-改造过的抗BCMA单抗与细胞毒制剂MMAF(monomethyl auristatin-F)通过一种非裂解链接子(药物链接技术从西雅图遗传学取得授权)偶联而成的ADC药物。belantamab mafodotin通过抗BCMA单抗靶向结合MM细胞表面的BCMA,之后迅速被MM细胞内化,在溶酶体中降解并在MM细胞内释放出非渗透性的MMAF发挥作用。MMAF是一种有丝分裂抑制剂,为抗微管蛋白化合物,能通过阻断微管聚合抑制细胞分裂,可使肿瘤细胞停止于G/M期并诱导caspase-3依赖的细胞凋亡。此外,belantamab mafodotin还能诱导NK细胞介导的ADCC(抗体依赖性细胞介导的细胞毒性作用),同时诱导巨噬细胞介导ADCP(抗体依赖性细胞介导的吞噬作用)。
belantamab mafodotin通过多种细胞毒作用机制选择性作用于MM细胞,有望为该类癌症提供有极具潜力的下一代免疫治疗选择。目前,belantamab mafodotin正处于临床开发,用于R/R MM和其他表达BCMA的晚期血液系统恶性肿瘤患者的治疗。(生物谷Bioon.com)
原文出处:GSK announces European Medicines Agency (EMA) accepted marketing authorisation application for belantamab mafodotin for the treatment of relapsed or refractory multiple myeloma
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->