Nat Mater:金纳米颗粒有望让基于CRISPR的基因疗法治疗HIV感染和血液疾病
来源:本站原创 2019-06-07 13:11
2019年6月7日讯/生物谷BIOON/---在一项新的研究中,来自美国弗雷德哈钦森癌症研究中心的研究人员通过简化将基因编辑指令递送给细胞的方式,朝着让基因疗法变得更加实用的方向迈出了一步。通过使用金纳米颗粒替换灭活病毒,他们安全地在HIV和遗传性血液疾病的实验室模型中递送基因编辑工具。相关研究结果近期发表在Nature Materials期刊上,论文标题为“Targeted homology-d
2019年6月7日讯/生物谷BIOON/---在一项新的研究中,来自美国弗雷德哈钦森癌症研究中心的研究人员通过简化将基因编辑指令递送给细胞的方式,朝着让基因疗法变得更加实用的方向迈出了一步。通过使用金纳米颗粒替换灭活病毒,他们安全地在HIV和遗传性血液疾病的实验室模型中递送基因编辑工具。相关研究结果近期发表在Nature Materials期刊上,论文标题为“Targeted homology-directed repair in blood stem and progenitor cells with CRISPR nanoformulations”。
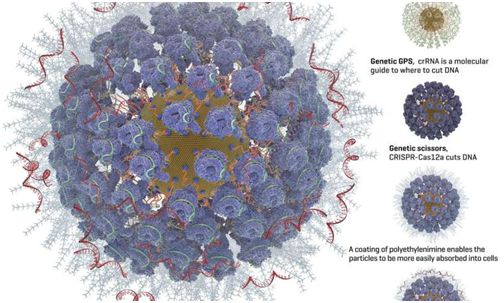
这是第一次使用装载CRISPR的金纳米颗粒来编辑稀有但功能强大的造血干细胞亚群中的基因,其中造血干细胞是体内所有血细胞的来源。这些携带CRISPR的金纳米颗粒成功地对造血干细胞中的基因进行编辑,而且没有毒副作用。
论文通讯作者、弗雷德哈钦森癌症研究中心临床研究部助理成员Jennifer Adair博士说,“随着基因疗法在临床试验中取得成功并为患者所用,我们需要一种更实用的方法。我想找到一种更简单的方法,一种可以被动地将基因编辑工具递送给造血干细胞的方法。”她补充道,世界上有数百万人无法使用目前的基因治疗方法。
虽然人们能够更快地和更容易地让CRISPR对基因组进行基因修饰,但是它仍然存在挑战。让细胞接受CRISPR基因编辑工具涉及施加较小的电击,这能够破坏甚至杀死细胞。如果需要精确的基因编辑,那么必须设计额外的分子来递送它们,这又会增加成本和时间。
金纳米颗粒是一种很有前途的替代品,这些因为这些微小球体(大约是食盐粒度的十亿分之一)的表面允许其他分子容易地粘附在它们上并保持粘附。
论文第一作者、弗雷德哈钦森癌症研究中心博士后研究员Reza Shahbazi博士说,“我们设计了金纳米颗粒,它们能够快速地跨过细胞膜,避开试图破坏它们的细胞器,并直接进入细胞核中进行基因编辑。”7年来,他一直在研究用于药物和基因递送的金纳米颗粒。
Shahbazi利用纯化的以液体形式装在一个小实验室瓶子里的实验室级金制成金纳米颗粒。他将纯化的金与导致单个金离子形成微小颗粒的溶液混合在一起,随后他们测量所形成的颗粒的尺寸。他们发现特定尺寸---19纳米宽---是最好的,这是因为它足够大、足够粘,能够将基因编辑工具添加到这些颗粒的表面上,同时又足够小,可以被细胞吸收。
通过包裹在这些金纳米颗粒上,Adair及其团队添加了下面的基因编辑组分:
(1)一种称为crRNA的分子向导,起着遗传GPS(全球定位系统)的作用,可将CRISPR复合物引导到基因组中遭受切割的位点上。
(2)CRISPR核酸酶蛋白,通常被称为“基因剪刀”,可以切割DNA。最常用的CRISPR核酸酶蛋白是Cas9。但是,Adair团队还研究了Cas12a(以前称为Cpf1),这是因为Cas12a在DNA中进行交错切割。他们希望这可以让细胞更有效地修复切割,同时将新的遗传指令嵌入细胞中。Cas12a优于Cas9的另一个优点是它仅需要一个分子向导,鉴于金纳米颗粒的空间限制,这一点是很重要的。Cas9需要两个分子向导。
(3)有关进行基因变化的指令(“ssDNA”)。 Adair团队选择了两种免受疾病的遗传性基因变化:CCR5可阻止HIV感染,γ血红蛋白可阻止镰状细胞病和地中海贫血等血液疾病。
(4)聚乙烯亚胺涂层聚集在这些金纳米颗粒的表面上,使得它们携带更多的正电荷,这能够让它们更容易被细胞吸收。这是对让细胞摄取基因编辑工具的另一种称为电穿孔的方法进行改进。在电穿孔中,给细胞施加较小的电击,让这些细胞接受外来的遗传指令的进入。
这些研究人员随后分离出细胞表面上携带着蛋白标志物CD34的造血干细胞。这些CD34阳性造血干细胞含有产生整个血液和免疫系统的造血祖细胞。
Adair说,“这些细胞每天补充体内的血液,使得它们成为一次性基因治疗的良好候选者,这是因为它们能够自我更新,在一生当中持续存在。”
通过在实验室培养皿中观察人造血干细胞,这些研究人员发现他们的装载着基因编辑工具的金纳米颗粒在加入后6小时内被细胞自然摄取,并且在24到48小时内能够看到基因编辑发生。他们观察到相比于更常用的Cas9 CRISPR蛋白伴侣,Cas12a CRISPR蛋白伴侣更好地对细胞进行基因编辑。
在这些研究人员将这些经过基因编辑的细胞注射到小鼠模型体内8周后,基因编辑效应达到顶峰;注射22周后,这些经过基因编辑的细胞仍然存在。他们还在这些小鼠模型的骨髓、脾脏和胸腺中发现了这些经过基因编辑的细胞,这表明这些器官中发生细胞分裂的血细胞能够发挥治疗作用,无需再对这些小鼠进行治疗。
Adair说,“我们相信我们有两种良好的候选疾病---HIV感染和血红蛋白病---虽然我们也正在评估其他的疾病---以及如何产生更大的遗传变化,在这些疾病中,较小的遗传变化能够产生重大影响。下一步是增加基因编辑在每个细胞中发生的程度,这绝对是可行的。这将让它更接近成为一种有效的治疗方法。”
在这项新的研究中,这些研究人员报道10%到20%的造血干细胞发生了基因编辑,这是一个很有希望的开端,但是他们的目标是50%或以上的细胞发生基因编辑,他们相信这将有很大的机会对抗这些疾病。(生物谷 Bioon.com)
参考资料:
Reza Shahbazi et al. Targeted homology-directed repair in blood stem and progenitor cells with CRISPR nanoformulations. Nature Materials, 2019, doi:10.1038/s41563-019-0385-5.

图片来自the Adair lab at Fred Hutch。
这是第一次使用装载CRISPR的金纳米颗粒来编辑稀有但功能强大的造血干细胞亚群中的基因,其中造血干细胞是体内所有血细胞的来源。这些携带CRISPR的金纳米颗粒成功地对造血干细胞中的基因进行编辑,而且没有毒副作用。
论文通讯作者、弗雷德哈钦森癌症研究中心临床研究部助理成员Jennifer Adair博士说,“随着基因疗法在临床试验中取得成功并为患者所用,我们需要一种更实用的方法。我想找到一种更简单的方法,一种可以被动地将基因编辑工具递送给造血干细胞的方法。”她补充道,世界上有数百万人无法使用目前的基因治疗方法。
虽然人们能够更快地和更容易地让CRISPR对基因组进行基因修饰,但是它仍然存在挑战。让细胞接受CRISPR基因编辑工具涉及施加较小的电击,这能够破坏甚至杀死细胞。如果需要精确的基因编辑,那么必须设计额外的分子来递送它们,这又会增加成本和时间。
金纳米颗粒是一种很有前途的替代品,这些因为这些微小球体(大约是食盐粒度的十亿分之一)的表面允许其他分子容易地粘附在它们上并保持粘附。
论文第一作者、弗雷德哈钦森癌症研究中心博士后研究员Reza Shahbazi博士说,“我们设计了金纳米颗粒,它们能够快速地跨过细胞膜,避开试图破坏它们的细胞器,并直接进入细胞核中进行基因编辑。”7年来,他一直在研究用于药物和基因递送的金纳米颗粒。
Shahbazi利用纯化的以液体形式装在一个小实验室瓶子里的实验室级金制成金纳米颗粒。他将纯化的金与导致单个金离子形成微小颗粒的溶液混合在一起,随后他们测量所形成的颗粒的尺寸。他们发现特定尺寸---19纳米宽---是最好的,这是因为它足够大、足够粘,能够将基因编辑工具添加到这些颗粒的表面上,同时又足够小,可以被细胞吸收。
通过包裹在这些金纳米颗粒上,Adair及其团队添加了下面的基因编辑组分:
(1)一种称为crRNA的分子向导,起着遗传GPS(全球定位系统)的作用,可将CRISPR复合物引导到基因组中遭受切割的位点上。
(2)CRISPR核酸酶蛋白,通常被称为“基因剪刀”,可以切割DNA。最常用的CRISPR核酸酶蛋白是Cas9。但是,Adair团队还研究了Cas12a(以前称为Cpf1),这是因为Cas12a在DNA中进行交错切割。他们希望这可以让细胞更有效地修复切割,同时将新的遗传指令嵌入细胞中。Cas12a优于Cas9的另一个优点是它仅需要一个分子向导,鉴于金纳米颗粒的空间限制,这一点是很重要的。Cas9需要两个分子向导。
(3)有关进行基因变化的指令(“ssDNA”)。 Adair团队选择了两种免受疾病的遗传性基因变化:CCR5可阻止HIV感染,γ血红蛋白可阻止镰状细胞病和地中海贫血等血液疾病。
(4)聚乙烯亚胺涂层聚集在这些金纳米颗粒的表面上,使得它们携带更多的正电荷,这能够让它们更容易被细胞吸收。这是对让细胞摄取基因编辑工具的另一种称为电穿孔的方法进行改进。在电穿孔中,给细胞施加较小的电击,让这些细胞接受外来的遗传指令的进入。
这些研究人员随后分离出细胞表面上携带着蛋白标志物CD34的造血干细胞。这些CD34阳性造血干细胞含有产生整个血液和免疫系统的造血祖细胞。
Adair说,“这些细胞每天补充体内的血液,使得它们成为一次性基因治疗的良好候选者,这是因为它们能够自我更新,在一生当中持续存在。”
通过在实验室培养皿中观察人造血干细胞,这些研究人员发现他们的装载着基因编辑工具的金纳米颗粒在加入后6小时内被细胞自然摄取,并且在24到48小时内能够看到基因编辑发生。他们观察到相比于更常用的Cas9 CRISPR蛋白伴侣,Cas12a CRISPR蛋白伴侣更好地对细胞进行基因编辑。
在这些研究人员将这些经过基因编辑的细胞注射到小鼠模型体内8周后,基因编辑效应达到顶峰;注射22周后,这些经过基因编辑的细胞仍然存在。他们还在这些小鼠模型的骨髓、脾脏和胸腺中发现了这些经过基因编辑的细胞,这表明这些器官中发生细胞分裂的血细胞能够发挥治疗作用,无需再对这些小鼠进行治疗。
Adair说,“我们相信我们有两种良好的候选疾病---HIV感染和血红蛋白病---虽然我们也正在评估其他的疾病---以及如何产生更大的遗传变化,在这些疾病中,较小的遗传变化能够产生重大影响。下一步是增加基因编辑在每个细胞中发生的程度,这绝对是可行的。这将让它更接近成为一种有效的治疗方法。”
在这项新的研究中,这些研究人员报道10%到20%的造血干细胞发生了基因编辑,这是一个很有希望的开端,但是他们的目标是50%或以上的细胞发生基因编辑,他们相信这将有很大的机会对抗这些疾病。(生物谷 Bioon.com)
参考资料:
Reza Shahbazi et al. Targeted homology-directed repair in blood stem and progenitor cells with CRISPR nanoformulations. Nature Materials, 2019, doi:10.1038/s41563-019-0385-5.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


