第6款阿达木单抗生物仿制药!迈兰/协和麒麟Hulio获美国FDA批准,将2023年上市!
来源:本站原创 2020-07-11 16:39
Humira(阿达木单抗)是全球最畅销的药物,2019年销售额191亿美元。

2020年07月11日讯 /生物谷BIOON/ --迈兰(Mylan)与合作伙伴协和麒麟(Fujifilm Kyowa Kirin)近日联合宣布,美国食品和药物管理局(FDA)已批准Hulio(adalimumab-fkjp),该药是艾伯维(AbbVie)公司超重磅产品Humira(修美乐,通用名:adalimumab,阿达木单抗)的生物仿制药,用于治疗:类风湿性关节炎(RA)、幼年特发性关节炎(JIA,年龄≥4岁)、银屑病关节炎(PsA)、强直性脊柱炎(AS)、成人克罗恩病(CD)、溃疡性结肠炎(UC)、斑块型银屑病(PsO)。
根据先前与艾伯维签署的许可协议,迈兰被允许在2023年7月将Hulio推向美国市场。迈兰总裁Rajiv Malik表示:“我们非常高兴FDA批准了Hulio,该药是全球最畅销药物Humira的一款生物仿制药,将有助于为患有慢性炎症的美国患者带来另一种高质量、更实惠的治疗选择。”
此次批准,基于一项综合性的分析、临床前和临床项目。由协和麒麟开展的一项III期临床研究ARABESC的结果显示,在类风湿性关节炎(RA)患者中,Hulio与参考产品Humira在安全性、疗效、免疫原性方面没有临床意义的差异。
Hulio是由协和麒麟开发的一款阿达木单抗生物仿制药。2018年4月,迈兰与协和麒麟达成合作,获得了Hulio在欧洲的独家商业化权利。在欧洲,Hulio已于2018年9月获批,用于Humira的全部适应症。在2019年,迈兰和协和麒麟将合作关系扩大至全球。今年6月底,Hulio在日本获得批准。迄今为止,这些批准和产品发布构成了迈兰对患者承诺的一部分,通过提供行业最大、最多样化的全球生物仿制药专营权之一,专注于肿瘤学、免疫学、内分泌学、眼科学和皮肤病学领域。
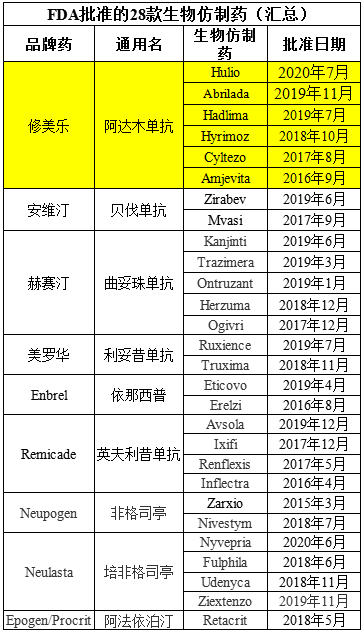
根据美国FDA生物仿制药数据库,截至目前,该机构共批准了28个生物仿制药。Hulio是FDA在2020年批准的第2款生物仿制药,也是该机构迄今为止批准的第6个阿达木单抗生物仿制药。除了迈兰/协和麒麟的Hulio之外,另外5个已批准的阿达木单抗生物仿制药分别为:Abrilada(辉瑞,2019年11月)、Hadlima(三星Bioepis/默沙东,2019年7月)、Hyrimoz(诺华山德士,2018年10月)、Cyltezo(勃林格殷格翰,2017年8月)、Amjevita(安进,2016年9月)。
Humira作为艾伯维的旗舰产品,是全球第一个获批的抗肿瘤坏死因子TNF-α药物,该药也是全球最畅销的抗炎药,自上市以来,目前已获全球90多个国家批准,获批达10多个适应症,包括:类风湿性关节炎有、幼年特发性关节炎、银屑病关节炎、强直性脊柱炎、成人克罗恩病、小儿克罗恩病、溃疡性结肠炎、银屑病、化脓性汗腺炎和葡萄膜炎。
Humira是艾伯维的一款超级重磅产品,连续数年稳坐全球“药王”宝座,2019年全球销售额为191.69亿美元,较上一年略微下降(3.9%)。其中,美国市场销售额148.64亿美元、国际市场销售额43.05亿美元(大部分是欧洲市场)。
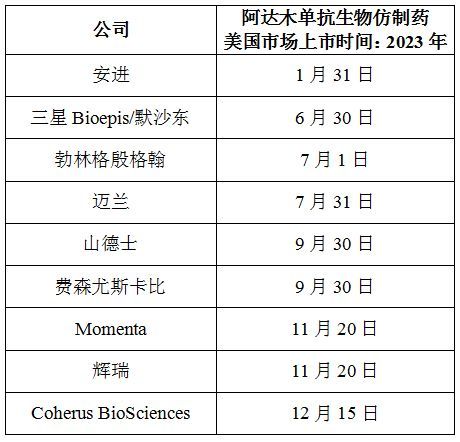
在欧洲,目前已有多款阿达木单抗生物仿制药上市,但在美国市场,艾伯维已先后与9家制药公司达成和解协议,包括:安进、三星Bioepis/默沙东、迈兰、山德士、费森尤斯卡比(Fresenius Kabi)、Momenta、辉瑞、Coherus BioSciences、勃林格殷格翰。
根据协议条款,这些公司的阿达木单抗生物仿制药可在2023年的不同时间点登陆美国市场,并且不会因为其他已授权公司产品的上市而提前上市。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


