新型抗生素!盐野义新型铁载体头孢菌素cefiderocol获美国FDA咨询委员会推荐批准!
来源:本站原创 2019-10-18 08:45
2019年10月18日/生物谷BIOON/--日本药企盐野义(Shionogi)近日宣布,美国食品和药物管理局(FDA)抗菌药物咨询委员会已召开会议对新型抗菌药cefiderocol(头孢地尔)治疗复杂性尿路感染(cUTI,包括肾盂肾炎)的新药申请(NDA)进行了讨论和表决,该委员会以14票赞成、2票反对的投票结果认为,作为NDA的一部分,盐野义提供了cefiderocol疗效的确凿证据和安全性的
2019年10月18日/生物谷BIOON/--日本药企盐野义(Shionogi)近日宣布,美国食品和药物管理局(FDA)抗菌药物咨询委员会已召开会议对新型抗菌药cefiderocol(头孢地尔)治疗复杂性尿路感染(cUTI,包括肾盂肾炎)的新药申请(NDA)进行了讨论和表决,该委员会以14票赞成、2票反对的投票结果认为,作为NDA的一部分,盐野义提供了cefiderocol疗效的确凿证据和安全性的充分证据。
FDA咨询委员会向FDA提供独立的建议和推荐,FDA在审查药物时通常会考虑其建议。此前,FDA已授予cefiderocol合格传染病产品(QIDP)资格认定和快速通道资格。根据处方药用户收费法(PDUFA),FDA将在2019年11月14日作出审查决定。如果获得批准,cefiderocol将以品牌名Fetroja销售。
欧盟方面,cefiderocol的上市许可申请(MAA)于今年3月获欧洲药品管理局(EMA)受理并被授予了加速评估。
cefiderocol治疗cUTI的临床研究APEKS-cUTI已于2017年成功完成。结果显示,研究达到了临床治愈和病原菌根除的主要终点。cefiderocol治疗组有72.6%的患者实现了临床治愈和病原菌根除,亚胺培南+西司他丁钠治疗组患者比例为54.6%。严重副作用方面,cefiderocol治疗组为4.7%,对照组为8.1%。
盐野义总裁兼首席执行官Isao Teshirogi博士表示:“我们对FDA咨询委员会做出的推荐批准cefiderocol的积极建议感到高兴。我们感谢委员会成员认真审查我们的数据,并将继续与FDA密切合作。革兰阴性病原体引起的cUTI患者继续面临着高发病率和死亡率的严峻挑战。如果获得批准,我们相信cefiderocol将有助于解决一个治疗方案有限的领域存在的重大未满足医疗需求,来抗击这些危及生命的感染。”
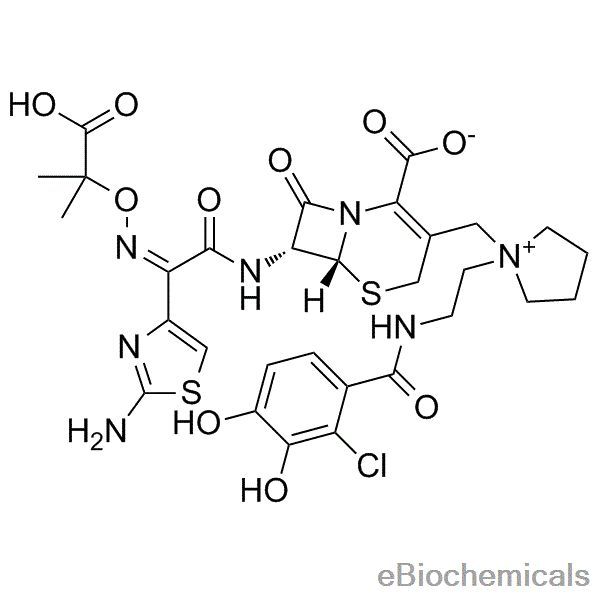
cefiderocol分子结构式(图片来源:eBiochemicals)
cefiderocol是一种新型的铁载体头孢菌素,具有独特的穿透革兰氏阴性菌细胞膜的作用机制:cefiderocol与三价铁结合,并通过细菌铁转运蛋白,通过细胞膜外膜被积极地转运至细菌细胞内。这种特洛伊木马策略允许cefiderocol在细菌细胞周质中达到更高的浓度,结合受体并抑制细菌细胞壁的合成。
值得一提的是,cefiderocol是首个进入III期临床开发的铁载体头孢菌素,体外研究显示,该药对世界卫生组织(WHO)确定的具有最高优先权的所有革兰氏阴性菌具有强劲活性,包括关键的耐碳青霉烯革兰氏阴性非发酵鲍氏不动杆菌、铜绿假单胞菌、难治性耐碳青霉烯肠杆菌科。cefiderocol开发用于死亡率很高且存在严重未满足医疗需求的疾病领域。
抗生素耐药性(AMR)是一个急需解决的健康负担。仅在美国和欧洲,每年就有5.6万人死于抗生素耐药感染。如果不采取任何措施,每年将有1千万人死于抗生素耐药感染,到2050年,全球经济负担将100万亿美元。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


