针对新冠病毒SARS-CoV-2/COVID-19,Science期刊研究进展一览(第2期)
来源:本站原创 2020-06-28 21:35
2020年6月28日讯/生物谷BIOON/---自2019年12月8日以来,中国湖北省武汉市报告了几例病因不明的肺炎。大多数患者在当地的华南海鲜批发市场工作或附近居住。在这种肺炎的早期阶段,严重的急性呼吸道感染症状出现了,一些患者迅速发展为急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)、急性呼吸衰竭和
2020年6月28日讯/生物谷BIOON/---自2019年12月8日以来,中国湖北省武汉市报告了几例病因不明的肺炎。大多数患者在当地的华南海鲜批发市场工作或附近居住。在这种肺炎的早期阶段,严重的急性呼吸道感染症状出现了,一些患者迅速发展为急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)、急性呼吸衰竭和其他的严重并发症。2020年1月7日,中国疾病预防控制中心(China CDC)从患者的咽拭子样本中鉴定出一种新型冠状病毒,最初被世界卫生组织(WHO)命名为2019-nCoV。大多数2019-nCoV肺炎患者的症状较轻,预后良好。到目前为止,一些患者已经出现严重的肺炎,肺水肿,ARDS或多器官功能衰竭和死亡。
2020年2月11日,世卫组织将这种疾病病重命名为2019年冠状病毒病(COVID-19)。同一天,负责分类和命名病毒的的国际病毒分类学委员会的冠状病毒研究小组在bioRxiv上发表了一篇文章,指出该研究小组已经决定,新型冠状病毒2019-nCoV是导致2002-2003年爆发严重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)的变种。因此,将这种新病原体重新命名为严重急性呼吸综合征冠状病毒2号(severe acute respiratory syndrome coronavirus 2),或SARS-CoV-2。值得注意的一点是,尽管国际病毒分类委员会冠状病毒研究小组将病毒命名为SARS-CoV-2,但该研究小组主席John Ziebuhr认为这个名字(SARS-CoV-2)和SARS(严重急性呼吸综合征,也称非典型肺炎)没有关联。不过,这种病毒的重新命名引起了不少争议。据《科学》网站报道,世界卫生组织不满意SARS-CoV-2这个名字,而且不打算采用此名称。
冠状病毒可引起多种动物的多系统感染。在此之前已有6种冠状病毒可以感染人类,它们主要引起人类的呼吸道感染:两种高度致命性的冠状病毒,即严重急性呼吸道综合征(SARS)冠状病毒(SARS-CoV)和中东呼吸综合征(MERS)冠状病毒(MERS-CoV);4种可导致温和的上呼吸道疾病的冠状病毒,即HCoV-OC43、HCoV-229E、HCoV-NL63和HCoV-HKU1。
基于此次疫情给中国和全世界带来严重的危害,小编针对Science期刊上发表的2019-nCoV/COVID-19研究进行一番梳理,以飨读者。
1.两篇Science论文指出在恒河猴中,DNA疫苗可预防SARS-CoV-2感染,而且之前的感染可预防再次感染
doi:10.1126/science.abc6284; doi:10.1126/science.abc4776
全球有近500万例确诊病例,有30多万人死于COVID-19,但对导致这种疾病的SARS-CoV-2病毒仍有许多未知数。两个关键问题是疫苗是否能够预防新型冠状病毒SARS-CoV-2感染,以及已经从COVID-19中恢复过来的人是否能够避免再次感染。由美国贝斯以色列女执事医疗中心(BIDMC)的研究人员领导的两项新的研究为解答这些问题提供了新的启示。相关研究结果于2020年5月20日在线发表在Science期刊上,论文标题分别为“DNA vaccine protection against SARS-CoV-2 in rhesus macaques”和“SARS-CoV-2 infection protects against rechallenge in rhesus macaques”。

在第一项研究中,这些研究人员证实六种候选DNA疫苗在恒河猴中诱导出中和抗体反应,并可预防它们感染SARS-CoV-2。Barouch及其同事们在1月中旬中国科学家发布病毒基因组时,就开始研制COVID-19疫苗,开发了一系列表达刺突蛋白变体的候选DNA疫苗,其中,刺突蛋白是新型冠状病毒SARS-CoV-2的关键抗体靶点。这些疫苗旨在训练人体的免疫系统在接触病毒后迅速识别它并作出反应。
为了评估这些疫苗的疗效,这些研究人员对25只成年恒河猴进行了研究性DNA疫苗免疫接种,另外10只恒河猴接受了模拟对照(sham control)接种。接种过疫苗的恒河猴产生了抗病毒的中和抗体。在加强疫苗接种三周后,所有35只恒河猴都暴露于病毒中。随访测试显示,与对照组相比,接种疫苗的恒河猴的病毒载量显著降低。在25只接种疫苗的恒河猴中,有8只恒河猴在暴露于病毒中后的任何一个时间点上都没有表现出可检测到的病毒,剩下的17只具有较低的病毒水平。此外,较高的抗体水平与较低的病毒载量有关,这表明中和抗体可能作为保护的一个相关因素,并可能被证明是临床测试SARS-CoV-2疫苗的一个基准。
在第二项研究中,这些研究人员证实,从COVID-19中恢复的恒河猴会产生天然的保护性免疫力,防止再次感染。Barouch说,“从许多病毒感染中恢复过来的个体通常会产生抗体,这些抗体可以防止再次感染,但并不是所有的病毒感染都会产生这种天然的保护性免疫力。”
这些研究人员将9只成年恒河猴暴露于SARS-CoV-2病毒中后,随着这些恒河猴的恢复,对它们的病毒水平进行了监测。这9只动物都恢复了,并产生了抗病毒的抗体。在初次感染后一个多月后,他们让这些恒河猴再次暴露在病毒中。在第二次暴露后,它们近乎完全预防这种病毒的再次感染。这些数据表明这种动物模型在初次感染后对COVID-19具有天然的保护性免疫力。
2.Science:气候的局部变化不太可能导致早期的COVID-19大流行
doi:10.1126/science.abc2535
在一项新的研究中,来自美国普林斯顿大学的研究人员发现气候的局部变化不太可能主导COVID-19的第一波疫情。他们发现大量的人仍然容易受到导致COVID-19疫情的新型冠状病毒SARS-CoV-2毒株的影响,而且这种病原体的传播速度意味着气候条件只可能对目前的感染率产生影响。相关研究结果于2020年5月18日在线发表在Science期刊上,论文标题为“Susceptible supply limits the role of climate in the early SARS-CoV-2 pandemic”。
论文第一作者兼论文通讯作者、普林斯顿大学普林斯顿环境研究所博士后研究助理Rachel Baker说,“我们预测更温暖或更潮湿的气候不会在COVID-19疫情的早期阶段减缓这种病毒的传播速度。我们确实观察到气候对COVID-19疫情的规模和时间有一定的影响,但是总地来说,由于人群中有如此多人存在易感性,无论气候条件如何,这种病毒都会迅速传播。”
Baker说,这种病毒在巴西、厄瓜多尔、澳大利亚和其他热带和南半球国家的迅速传播---这种病毒在夏季开始流行的地方---表明较暖的环境确实无助于阻止COVID-19疫情。
3.Science:定量确定不同的干预措施对COVID-19病例数量的影响
doi:10.1126/science.abb789
在一项新的研究中,来自德国马克斯-普朗克动力学与自组织研究所和哥廷根大学的研究人员如今成功地分析了与过去的遏制措施有关的德国COVID-19病例数量,并得出了未来几周的情况。他们的计算机模型还可以为其他国家采取干预措施的有效性提供新的见解。相关研究结果于2020年5月15日在线发表在Science期刊上,论文标题为“Inferring change points in the spread of COVID-19 reveals the effectiveness of interventions”。
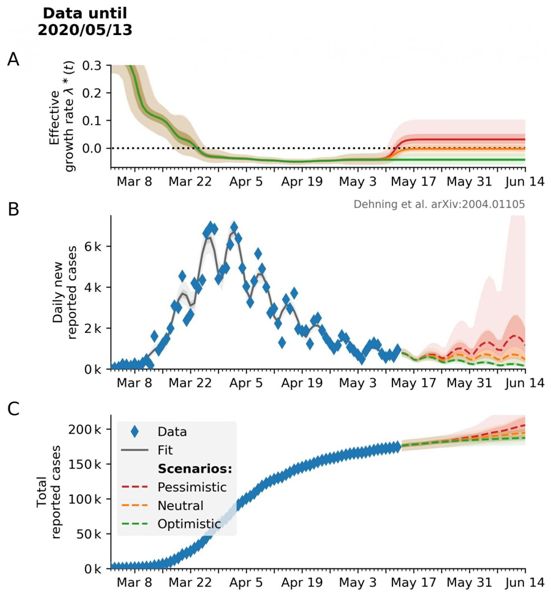
目前,许多人都在关注最近几周内遏制疫情的干预措施效果如何,以及未来几周事态将如何发展。马克斯-普朗克动力学与自组织研究所的科学家们一直在研究这些问题。他们从3月中旬开始,就与哥廷根大学的科学家们一起,对德国的新冠病毒疫情过程进行了模拟。在他们的模型计算中,这些研究人员将3月份逐渐增加的公共生活限制与COVID-19病例数的发展联系起来。特别是,他们研究了3月份的三套干预措施的影响:3月8日左右取消大型公共活动,3月16日关闭教育机构和许多商店,3月22日大范围的禁止接触。
为此,这些研究人员将COVID-19新感染的时间过程数据与流行病学动力学模型相结合,分析了迄今为止的疫情发展过程,并对未来的情景进行了研究。根据计算机模型,一揽子遏制措施最初减缓了COVID-19的传播速度,最终阻止了可怕的指数式增长。论文通讯作者、马克斯-普朗克动力学与自组织研究所小组负责人Viola Priesemann说,“我们的分析清楚地显示了各种干预措施的效果,这些干预措施最终共同导致了强烈的趋势逆转。因此,我们的模型计算向我们展示了与干预措施密切相关的人们行为变化的整体影响。”
在这项新的研究中,这些研究人员并不只考虑到德国。论文共同第一作者Jonas Dehning说,“从一开始,我们就设计出了我们的计算机模型,以便它可以适用于其他国家和地区。我们的分析工具可以在GitHub上免费提供,并且已经被世界各地的研究人员使用和进一步开发。”目前,这些研究人员正在努力将这种模型应用到欧洲国家。特别重要的是,找出不同国家采取的干预措施的不同时间点,这可以让我们对各种干预措施的有效性得出结论。
4.Science:法国仅有4.4%的人感染了SARS-CoV-2病毒,远低于群体免疫所需达到的水平
doi:10.1126/science.abc3517
在一项新的研究中,来自法国、英国和美国的研究人员发现法国仅有4.4%的人感染了SARS-CoV-2病毒,这一比例远远低于群体免疫(herd immunity)所需的比例。相关研究结果于2020年5月13日在线发表在Science期刊上,论文标题为“Estimating the burden of SARS-CoV-2 in France”。在这篇论文中,他们描述了他们对法国医院和监测数据的研究以及由此取得的研究结果。
随着COVID-19大流行病继续在全球范围内蔓延,许多国家已经开始努力解决何时放松为了减缓COVID-19传播而采取的封锁限制的问题。实施这类限制措施是为了“拉平疫情增长曲线”,以防止医院和其他医疗机构超负荷运转。但是这类限制措施导致了经济问题--企业倒闭、裁员和销售放缓,从而让许多国家陷入了经济衰退。鉴于医学家们提醒道,疫苗甚至有效治疗这种疾病的药物可能要等一年或更久的时间,因此世界各国领导人面临着要求现在就取消限制的压力,而且许多领导人已经软化了态度。5月11日,法国取消了许多限制,允许人们重返工作岗位,尽管采取了新的规定,比如社交距离(social distancing)等。
在包括法国在内的国家开始取消限制的同时,医学科学家们也开始发声,指出如果过快取消限制可能带来的问题。他们指出,在没有疫苗的情况下,摆脱大流行的唯一途径是通过群体免疫,即有足够多的人携带抗体,病毒就会自行销毁(假设携带抗体的人确实具有免疫能力)。大多数科学家都认为,当大约65%到75%的人群被感染时,就会出现群体免疫。在这项新的研究中,这些研究人员发现,法国离群体免疫还差得很远,因此,随着限制措施的放松,很可能面临着第二波感染。
5.全文编译!我国科学家发表Science论文,发现两种非竞争性人类中和抗体可阻断SARS-CoV-2病毒结合人ACE2受体
doi:10.1126/science.abc2241
SARS-CoV-2病毒属于β冠状病毒属,β冠状病毒属包括5种能够感染人类的病原体。在这5种病原体中,SARS-CoV和中东呼吸综合征冠状病毒(MERS-CoV)是两种高致病性冠状病毒。与其他冠状病毒一样,位于SARS-CoV-2病毒表面上的刺突糖蛋白(S蛋白)同源三聚体在受体结合和病毒进入中起着至关重要的作用。S蛋白是一种I类融合蛋白---每个S蛋白原体由S1和S2结构域组成,受体结合结构域(RBD)位于S1结构域上。先前的研究显示,与SARS-CoV类似的是,SARS-CoV-2也利用人ACE2(hACE2)受体进入细胞。科学家们已经发现了许多靶向SARS-CoV或MERS-CoV RBD的中和抗体。因此,筛选出靶向SARS-CoV-2 RBD的中和抗体是当务之急。
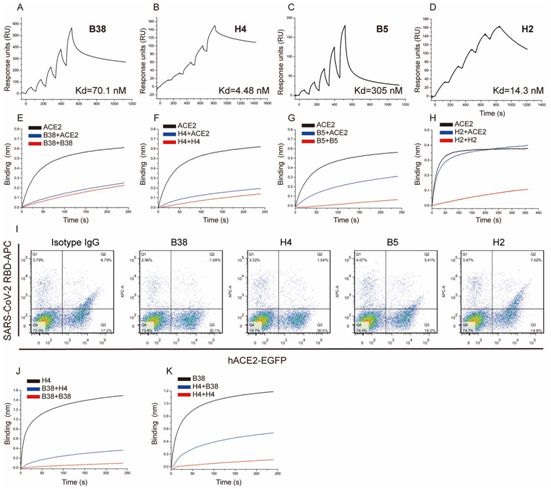
在一项新的研究中,来自中国科学院、中国科学院大学、首都医科大学、中国科学技术大学、深圳市第三人民医院、中国农业大学、山西高等创新研究院、中国疾病预防控制中心和中国食品药品检定研究院的研究人员表达了SARS-CoV-2 RBD蛋白作为诱饵,从COVID-19患者外周血单核细胞(PBMC)中分离出特异性的记忆B细胞。编码抗体重链和轻链的可变区分别从不同的B细胞中扩增出来,然后与抗体恒定区一起被克隆到pCAGGS质粒载体中,以产生IgG1抗体。相关研究结果于2020年5月13日在线发表在Science期刊上,论文标题为“A noncompeting pair of human neutralizing antibodies block COVID-19 virus binding to its receptor ACE2”。
6.Science:专家们概述了SARS-CoV-2疫苗研发计划
doi:10.1126/science.abc5312
近日,Science杂志发表了一篇观点文章,作者提出将需要前所未有的合作和资源来研究和开发安全有效的COVID-19疫苗,以数十亿剂的规模生产和交付给全球人民。
疫苗开发通常需要数年时间。为了加快这一进程,福瑞德•哈金森癌症研究中心(Fred Hutchinson Cancer Research Center)的Larry Corey博士和美国国立卫生研究院的专家们提出了一种设想,即创建一种协调和有效的方法来生产COVID-19疫苗。
在这篇观点文章中,Corey和合着者Anthony Fauci博士、John Mascola博士以及Francis Collins博士分享了他们将产业界、政府和学术界联合起来以满足这一迫切需求的计划。Fauci博士是美国国立卫生研究院(NIH)下属的美国国家过敏症和传染病研究所的所长。
Mascola博士是NIAID疫苗研究中心的主任,Collins博士是NIH的主任。 "我们正在经历一系列前所未有的事件,这种疾病已经在全球范围内传播,在短时间内感染的人数比现代任何其他感染都要多,"Fred Hutch的前任总裁兼主任、疫苗和传染病部门的教授Corey说。"为了克服我们面前的挑战,我们每个人都需要做到最好。新型冠状病毒疫苗的研发需要创造力、合作和承诺,以尽快拯救尽可能多的生命。"
7.Science展望:如何快速开发COVID-19疫苗?应该注意什么?
doi:10.1126/science.abb8923
快速开发预防COVID-19的疫苗是一项全球当务之急,确定利害关系和潜在障碍至关重要,因为监管和医疗决策是基于利益制定的:也就是风险计算。通过建立群体免疫可以降低大流行性传播病毒的能力,而一个关键的问题在于通过开发有效的疫苗或者接下来几年反复感染达到60%~70%的人被感染是否可以防止SARS-CoV-2的传播。由于人类还是首次接触SARS-CoV-2,所以重复流行的后果将是高得令人无法接受的死亡率、严重的经济破坏和对我们生活方式的重大调整。因此,开发一种有效疫苗的好处是非常大的,如果能够及时部署以防止重复或持续的流行,好处就更大。
疫苗开发通常以数十年为单位,因此在2020年底甚至2021年之前获得可大规模分发的批准疫苗将是前所未有的。然而,新的制造平台、基于结构的抗原设计、计算生物学、蛋白质工程和基因合成为现在快速和精确地制造疫苗提供了工具。抗病毒疫苗可分为两大类。基于基因的疫苗传递编码宿主细胞产生的蛋白质抗原的基因序列。这些疫苗包括活病毒疫苗、重组疫苗载体或核酸疫苗。以蛋白质为基础的疫苗包括全灭活病毒、单个病毒蛋白质或子域,或以颗粒形式组装的病毒蛋白质,所有这些都是在体外制造的。重组疫苗载体和核酸疫苗最适合快速生产,因为它们更容易适应平台生产技术,其中上游供应链和下游流程对于每个产品都是相同的。通过了解疫苗抗原的原子结构和疫苗中保存的目标抗原表位,可以达到精确抗原递送。
对于任何打算产生抗体介导免疫的疫苗来说,提供构象正确的蛋白质都是至关重要的。CoV刺突蛋白展示在病毒表面并帮助病毒进行入侵。它通过进行大规模重组来完成这一过程,这种重组将病毒和细胞膜拉在一起并融合它们。因此,刺突蛋白是一种动态亚稳态蛋白,主要有两种构象状态:融合前和融合后构象。展示这种抗原,使其保持原始的原生融合前刺突蛋白的表面轮廓和化学性质,将保留高质量中和抗体反应所需的抗原表位。疫苗的配方和递送也可以影响T细胞的功能和反应模式。基于基因的疫苗可诱导CD8+ T细胞,同时产生CD4+ T辅助性1型细胞免疫应答,具有良好的抗病毒特性。佐剂不仅可用于提高蛋白质疫苗引起的抗体反应的强度和持久性,还可影响T细胞来源的细胞因子模式,从而调节免疫反应。
安全性是为健康人群接种疫苗的首要目标,接种疫苗有可能使随后的SARS-CoV-2感染更加严重。这种情况以前也发生过。以前有两种不同的综合症与接种疫苗增强的疾病有关。一个是抗体依赖的增强反应(ADE),另一种是疫苗增强的呼吸道疾病(VAERD), ADE是一个Fc(抗体的尾端)介导增强反应,通常与虫媒病毒感染相关,如登革热病毒(3)。ADE的机制设计病毒抗体复合物对表达FcR的细胞的结合能力增强,这会促进病毒进入细胞。当疫苗诱导的抗体由于浓度或亲和力不足或特异性错误而不能有效中和病毒时,更有可能发生这种情况。
8.Science展望:COVID-19药物的快速再利用
doi:10.1126/science.abb9332
冠状病毒生命周期涉及大量的潜在通路的步骤,包括进入宿主细胞的内吞作用(涉及血管紧张素转换酶2 (ACE2)和跨膜蛋白酶丝氨酸(TMPRSS2)]、RNA复制和转录(涉及解旋酶和依赖RNA的RNA聚合酶(RdRp)]、翻译和蛋白水解处理过程(涉及胰凝乳蛋白酶样和木瓜蛋白酶样蛋白酶)、病毒粒子的组装以及新病毒的释放过程等。除了病毒编码的靶点外,许多宿主靶点对于病毒复制和疾病进展都是必不可少的。
SARS-CoV-2的细胞受体是ACE2。重组人ACE2 (rhACE2,或APN01)目前正在开发中,用于治疗急性肺损伤和肺动脉高压,并在健康志愿者的一期试验中证明了良好的耐受性。rhACE2已被证明可以显着减少病毒进入人类细胞衍生的器官,可能是作为病毒结合的诱饵。这为正在调查用APN01阻断病毒进入COVID-19患者的临床试验提供了支持。成功的病毒进入需要蛋白水解处理病毒的刺突糖蛋白(S蛋白),可由TMPRSS2进行。TMPRSS2抑制剂卡莫司他(camostat)在日本被批准用于治疗慢性胰腺炎术后胃返流,一般耐受性良好,偶见罕见的严重副作用。卡莫司他和相关的萘莫司他(nafamostat)都可以阻止在表达TMPRSS2的人类细胞中SARS-CoV-2的复制。卡莫司他已被证明可以在小鼠模型中阻断SARS-CoV-2感染。因此,有充分的理由支持这些药物用于COVID-19的临床试验,这些试验已经在荷兰和德国启动。
冠状病毒利用内溶酶体途径在脱壳前进入细胞。氯喹(CQ)和羟基氯喹(HCQ)是影响体内功能和阻断自噬体-溶酶体融合的抗疟药物。这两种药物已被证明可以在细胞模型中抑制SARS-CoV-2复制。阿奇霉素(Azithromycin, AZ)是一种广泛使用的广谱抗生素,它还能阻止自噬小体在人类细胞中的清除以及寨卡病毒和流感病毒在体外在人类细胞中的复制。COVID-19患者HCQ小范围随机试验的初步结果显示,病人恢复的时间缩短了。一项小型的开放标签试验表明,与单独接受HCQ和AZ联合治疗的COVID-19患者相比,HCQ和AZ联合治疗的患者的病毒载量降低了,尽管这项研究由于从研究分析中剔除了几个受试者而受到严厉批评。这些产生假设的研究已经证明,在美国紧急批准使用它们治疗COVID-19是合理的,这两种药物在美国都被广泛使用。
然而,HCQ和AZ都有潜在的心脏毒性(QT延长,可导致致命的心律失常),而且HCQ对眼睛也有潜在的负面影响。如果这些药物要成为治疗COVID-19的标准,了解风险-效益比是至关重要的。在美国和欧洲进行的几项事后分析表明,对COVID-19患者进行HCQ单药治疗最多只能获得有限的益处;一项针对美国退伍军人的大型事后分析显示,HCQ对病人有伤害。鉴于这一机制的基本原理,但缺乏设计良好的临床研究和药物诱导毒性的潜力,有必要进行对照、随机试验,以测试这些药物对COVID-19患者的疗效和安全性。
9.Science:如今可依照合乎伦理的方式开展COVID-19疫苗人体试验
doi:10.1126/science.abc1076
在美国西北大学生物伦理学家Seema Shah的领导下,一个专家小组在Science期刊上发表了一篇标题为“Ethics of controlled human infection to study COVID-19”的政策论坛论文,他们认为可以以合乎伦理的方式在人类志愿者身上测试可能的COVID-19疫苗。这类测试将涉及在疫苗接种后让志愿者接触病毒,以观察是疫苗否能预防感染。
数百年来,医学科学家一直在进行受控人类感染(controlled human infection, CHI)研究,也被称为人类挑战试验(human challenge trials),作为减缓或阻止疾病传播的努力的一部分。然而,在大多数情况下,人们对对之前病原体威胁的了解比对SARS-CoV-2的了解还要多,这表明此时启动针对COVID-19的CHI研究可能涉及到伦理问题。在他们的论文中,Shah和她的同事们认为,现在可以以合乎伦理的方式进行CHI研究,而且由于疫情的严重性,这样做是合理的。他们提出的框架首先承认这样的研究可能带来的社会价值,这将大大加快COVID-19疫苗的开发。他们指出,如果没有疫苗,未来数月和数年内将有数十万人死亡---如果有疫苗的话,这些人本来是可以得到拯救的。这个专家小组还建议,以伦理的方式进行此类研究,需要由世界卫生组织等受人尊敬的机构进行协调和监督。
这个专家小组还建议,志愿者应从不会出现较严重的疾病症状的低风险群体中挑选,没有基础疾病的年轻、健康的成年人是很好的候选者。他们还建议对此类测试的地点进行仔细选择。如果志愿者出现更严重的症状,这些地点不仅需要为他们提供最好的护理,而且还应该有能力通过建立一个不被其他患者挤占的环境来保护卫生工作者。
10.Science全文编译:全球首个!中国团队发布新冠疫苗动物实验研究结果
doi:10.1126/science.abc1932
为了构建用于SARS-CoV-2候选疫苗开发的临床前体外中和模型和挑战模型,在一项新的研究中,来自中国医学科学院医学实验动物研究所、浙江省疾病预防控制中心、科兴控股生物技术有限公司、中国科学院生物物理研究所、中国食品药品检定研究院和中国疾病预防控制中心传染病预防控制所等研究机构的研究人员从11名住院患者(包括5名重症监护患者)---5名来自中国、3名来自意大利、1名来自瑞士、1名来自英国和1名来自西班牙---的支气管肺泡灌洗液(BALF)样本中分离出SARS-CoV-2毒株。这些患者在最近的疫情爆发期间感染了SARS-CoV-2。这11份样本含有的SARS-CoV-2毒株在利用所有可用序列构建的系统发育树上广泛分布,在一定程度上代表了传播的SARS-CoV-2毒株。
相关研究结果于2020年5月6日在线发表在Science期刊上,论文标题为“Rapid development of an inactivated vaccine candidate for SARS-CoV-2”。
目前COVID19的严重流行,以及全球死亡人数急剧增加,使得迫切需要开发一种SARS-CoV-2疫苗。在临床前研究和临床试验这两个阶段的疫苗开发中,安全性和有效性是至关重要的。虽然现在确定研究SARS-CoV-2感染的最佳动物模型还为时过早,但在SARS-CoV-2感染后出现COVID-19样症状的恒河猴似乎是研究这种疾病的有前景的动物模型。这些研究人员在这项新的研究中为PiCoVacc疫苗在恒河猴中的安全性提供了证据;并且在研究中没有观察到感染增强或免疫病理加重。这些数据还证明,在恒河猴中接种每剂量6μg的PiCoVacc疫苗对随后的SARS-CoV-2挑战有完全的保护作用。
总之,这些研究结果为SARS-CoV-2疫苗的临床开发提供了一条道路。PiCoVacc疫苗以及其他SARS-CoV-2候选疫苗的第I、II、III期临床试验预计将于今年晚些时候开始。
11.Science:新研究表明COVID症状追踪应用程序在应对病毒疫情中大有可为
doi:10.1126/science.abc0473
在一项新的研究中,一个在大数据研究和流行病学方面有专长的科学家联盟开发出一款COVID症状追踪应用程序(App),旨在快速收集信息,帮助应对正在发生的COVID-19大流行病。在美国和美国,有250万多人较早地使用了这款app,这为医生、科学家和政府官员提供 了关于COVID-19的宝贵数据,以便更好地抗击病毒疫情。相关研究结果于2020年5月5日在线发表在Science期刊上,论文标题为“Rapid implementation of mobile technology for real-time epidemiology of COVID-19”。

论文通讯作者、麻省总医院(MGH)癌症中心癌症流行病学主任Andrew T. Chan博士说,“这款App每天都会收集社区中的个人信息,包括他们是否感觉良好,如果不舒服,他们的具体症状是什么,以及他们是否接受过COVID-19检测。”这款app旨在深入了解关于COVID-19 的热点地区在哪里以及需要注意的新症状,它可能作为一种有用的规划工具,为自我隔离提供指导方针方面的信息,确定需要增加呼吸机和扩大医院容量的地区,并提供实时数据,为未来的疫情爆发做好准备。
这款称为COVID症状追踪应用程序(COVID Symptom Tracker)的app于3月24日在英国推出,3月29日在美国上市。自推出以来,已经有超过300万人使用过它。
12.Science:对SARS-CoV-2 S刺突蛋白进行位点特异性的聚糖分析
doi:10.1126/science.abb9983
β冠状病毒成员SARS-CoV-2---一种导致COVID-19的病原体---的出现对全球人类健康构成了重大威胁。疫苗开发的重点是体液免疫反应的主要靶点--介导细胞进入和膜融合的刺突(S)糖蛋白。SARS-CoV-2 S基因编码每个原体上的22个N连接聚糖序列子(N-linked glycan sequon),这些聚糖序列子可能在蛋白质折叠和免疫逃避中发挥作用。在一项新的研究中,通过使用一种位点特异性的质谱方法,Yasunori Watanabe等人揭示了重组SARS-CoV-2 S免疫原上的聚糖结构。这种分析使得能够绘制这种病毒的三聚体S蛋白的聚糖加工状态图。这些作者展示了SARS-CoV-2 S聚糖与典型的宿主聚糖加工的不同,这可能对病毒病理生物学和疫苗设计有影响。
13.全文编译!我国科学家从结构上揭示瑞德西韦抑制新冠病毒RNA依赖性RNA聚合酶机制
doi:10.1126/science.abc1560
SARS-CoV-2是一种正链RNA病毒。它的复制是由病毒非结构蛋白(nsp)的多亚基复制/转录复合物介导的。这种复合物的核心成分是RNA依赖性RNA聚合酶(RdRp)的催化亚基(nsp12)。nsp12本身几乎没有什么活性,其功能需要包括nsp7和nsp8在内的辅助因子,这些辅助因子可以增加RdRp的模板结合和持续合成能力。RdRp也被提出是一类称为核苷酸类似物的抗病毒药物---包括瑞德西韦(remdesivir, 也称为GS-5734)---的靶点,其中瑞德西韦是一种前体药物,在细胞内可转化为三磷酸形式的活性药物。因此,RdRp一直是结构生物学研究的重点。科学家们已解析出nsp7、nsp8以及nsp12-nsp7-nsp8复合物的结构,并提供了RdRp复合物的整体结构。然而,由于没有SARS-CoV-2 RdRp与RNA模板或核苷酸抑制剂所形成的复合物的结构,药物发现工作受到阻碍。
在一项新的研究中,来自中国科学院、浙江大学、清华大学、北京协和医院、无锡佰翱得生物科学有限公司、上海交通大学和浙江省免疫与炎症疾病重点实验室的研究人员解析出SARS-CoV-2 RdRp复合物在apo形式(apo form)下以及与模板-引物RNA和抗病毒药物瑞德西韦(Remdesivir)结合在一起时的两种低温电镜结构。相关研究结果近期发表在Science期刊上,论文标题为“Structural basis for inhibition of the RNA-dependent RNA polymerase from SARS-CoV-2 by remdesivir”。
COVID-19大流行已经在全球范围内造成了情感上的痛苦和经济负担。对病毒生命周期至关重要的酶,因其与宿主蛋白不同,是很好的抗病毒药物靶点。在病毒酶中,RdRp是现有许多核苷酸类药物的主要靶点。在这篇论文中,这些研究人员报道了SARS-CoV-2 RdRp复合物的apo形式以及与模板-引物RNA和活性形式的雷德西韦结合在一起时的结构。这些结构揭示了模板-引物RNA是如何被这种酶识别的,以及瑞德西韦如何抑制链的延伸。结构比较和序列比对表明,RdRp识别底物RNA和瑞德西韦抑制RdRp的模式在不同的RNA病毒中高度保守,这为设计基于核苷酸类似物的广谱抗病毒药物提供了基础。此外,这些结构为现有的核苷酸类药物(包括强效的EIDD-2801)的建模和修饰提供了一个坚实的模板。总之,这些观察结果为设计更强效的抑制剂来对抗SARS-CoV-2的恶性感染提供了合理的基础。
14.Science:新发现!SARS-CoV-2或会感染宿主肠道细胞并进行繁殖!
doi:10.1126/science.abc1669
近日,一项刊登在国际杂志Science上的研究报告中,来自胡布勒支研究所等机构的科学家们通过研究发现,新型冠状病毒SARS-CoV-2或会感染肠道细胞并在肠道细胞中复制。文章中,研究人员利用先进的人类肠道培养模型进行研究,在体外成功实现了SARS-CoV-2病毒的繁殖,同时监测了细胞对病毒的反应,这或许就能提供一种研究COVID-19的新型细胞培养模型,相关研究发现或能解释研究者观察到的结果,即大约三分之一的COVID-19患者会经历腹泻等胃肠道症状,以及研究人员能在粪便样本中检测到病毒这一现象。
尽管呼吸道和胃肠道器官有着很大的差别,但也有一些关键相似之处,一个特别有趣的相似之处就是ACE2受体的存在,该受体是病毒进入宿主细胞的关键,肠道中布满了ACE2受体,然而直到现在为止,研究人员并不清楚是否肠道细胞真的会被感染并且产生病毒颗粒。
这项研究中,研究人员向通过研究确定是否SARS-CoV-2能够直接感染肠道中的细胞,如果的确是这样的话,其就能够在肠道细胞中复制,随后研究者利用人类肠道类器官进行研究,即能在实验室中生长的人类肠道微小版本;这些类器官中包含人类肠道内壁细胞,这就使其能够成为调查SARS-CoV-2感染的非常有竞争力的模型之一。
当研究者将病毒添加到类器官中时,SARS-CoV-2就能够快速感染类器官,病毒会进入到肠道类器官的亚群细胞中,而且随着时间延续,被感染的细胞的数量也会不断增加,利用一种名为电子显微镜的技术(能观察并对细胞中的不同组分进行成像),研究人员发现,类器官细胞内外都存在病毒颗粒,由于疫情封锁的原因,研究人员均在家中远程研究并分析了受感染的类器官的虚拟切片。
随后研究者利用RNA测序技术调查了肠道细胞对病毒的反应,研究结果表明,所谓的干扰素刺激基因会被激活,这些基因已知能够对抗病毒感染,后期研究中研究人员重点分析了这些基因,他们想通过相关研究结果来开发新型疗法。此外,研究者还在不同状况下培养了类器官,这些状况会导致细胞中ACE2受体处于较高和较低的水平,让研究人员惊讶的是,他们发现,在ACE2较高和较低水平下,病毒均能够感染肠道细胞,相关研究结果或能帮助开发新方法来阻断病毒进入宿主细胞。
15.Science:接触方式的变化决定了中国COVID-19疫情的动态
doi:10.1126/science.abb8001
为了阻止2019年新型冠状病毒病(COVID-19)的传播,中国采取了密集的非药物干预措施。随着这种疾病的传播在其他国家加剧,年龄、接触模式、社会隔离、感染易感性和COVID-19动态之间的相互作用仍不清楚。为了回答这些问题,来自中国复旦大学等研究机构的研究人员分析了武汉和上海在疫情发生前和疫情发生期间的接触者调查数据以及湖南省的接触者追踪信息。在COVID-19的社会隔离期间,日常接触减少了7~8倍,大部分互动仅限于家庭。这些作者发现,0~14岁儿童比15~64岁成年人更不容易感染SARS-CoV-2病毒(优势比0.34,95%置信区间0.24~0.49),而65岁以上的人更容易感染(优势比1.47,95%置信区间1.12~1.92)。基于这些数据,这些作者建立了一个传播模型来研究社会隔离和学校关闭对疾病传播的影响。这些作者发现,中国在疫情爆发期间实施的社会隔离就足以控制COVID-19。虽然主动关闭学校本身不能阻断传播,但可以将发病高峰降低40%~60%,从而延缓疫情的发生。(生物谷 Bioon.com)
2020年2月11日,世卫组织将这种疾病病重命名为2019年冠状病毒病(COVID-19)。同一天,负责分类和命名病毒的的国际病毒分类学委员会的冠状病毒研究小组在bioRxiv上发表了一篇文章,指出该研究小组已经决定,新型冠状病毒2019-nCoV是导致2002-2003年爆发严重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)的变种。因此,将这种新病原体重新命名为严重急性呼吸综合征冠状病毒2号(severe acute respiratory syndrome coronavirus 2),或SARS-CoV-2。值得注意的一点是,尽管国际病毒分类委员会冠状病毒研究小组将病毒命名为SARS-CoV-2,但该研究小组主席John Ziebuhr认为这个名字(SARS-CoV-2)和SARS(严重急性呼吸综合征,也称非典型肺炎)没有关联。不过,这种病毒的重新命名引起了不少争议。据《科学》网站报道,世界卫生组织不满意SARS-CoV-2这个名字,而且不打算采用此名称。
冠状病毒可引起多种动物的多系统感染。在此之前已有6种冠状病毒可以感染人类,它们主要引起人类的呼吸道感染:两种高度致命性的冠状病毒,即严重急性呼吸道综合征(SARS)冠状病毒(SARS-CoV)和中东呼吸综合征(MERS)冠状病毒(MERS-CoV);4种可导致温和的上呼吸道疾病的冠状病毒,即HCoV-OC43、HCoV-229E、HCoV-NL63和HCoV-HKU1。
基于此次疫情给中国和全世界带来严重的危害,小编针对Science期刊上发表的2019-nCoV/COVID-19研究进行一番梳理,以飨读者。
1.两篇Science论文指出在恒河猴中,DNA疫苗可预防SARS-CoV-2感染,而且之前的感染可预防再次感染
doi:10.1126/science.abc6284; doi:10.1126/science.abc4776
全球有近500万例确诊病例,有30多万人死于COVID-19,但对导致这种疾病的SARS-CoV-2病毒仍有许多未知数。两个关键问题是疫苗是否能够预防新型冠状病毒SARS-CoV-2感染,以及已经从COVID-19中恢复过来的人是否能够避免再次感染。由美国贝斯以色列女执事医疗中心(BIDMC)的研究人员领导的两项新的研究为解答这些问题提供了新的启示。相关研究结果于2020年5月20日在线发表在Science期刊上,论文标题分别为“DNA vaccine protection against SARS-CoV-2 in rhesus macaques”和“SARS-CoV-2 infection protects against rechallenge in rhesus macaques”。

为了评估这些疫苗的疗效,这些研究人员对25只成年恒河猴进行了研究性DNA疫苗免疫接种,另外10只恒河猴接受了模拟对照(sham control)接种。接种过疫苗的恒河猴产生了抗病毒的中和抗体。在加强疫苗接种三周后,所有35只恒河猴都暴露于病毒中。随访测试显示,与对照组相比,接种疫苗的恒河猴的病毒载量显著降低。在25只接种疫苗的恒河猴中,有8只恒河猴在暴露于病毒中后的任何一个时间点上都没有表现出可检测到的病毒,剩下的17只具有较低的病毒水平。此外,较高的抗体水平与较低的病毒载量有关,这表明中和抗体可能作为保护的一个相关因素,并可能被证明是临床测试SARS-CoV-2疫苗的一个基准。
在第二项研究中,这些研究人员证实,从COVID-19中恢复的恒河猴会产生天然的保护性免疫力,防止再次感染。Barouch说,“从许多病毒感染中恢复过来的个体通常会产生抗体,这些抗体可以防止再次感染,但并不是所有的病毒感染都会产生这种天然的保护性免疫力。”
这些研究人员将9只成年恒河猴暴露于SARS-CoV-2病毒中后,随着这些恒河猴的恢复,对它们的病毒水平进行了监测。这9只动物都恢复了,并产生了抗病毒的抗体。在初次感染后一个多月后,他们让这些恒河猴再次暴露在病毒中。在第二次暴露后,它们近乎完全预防这种病毒的再次感染。这些数据表明这种动物模型在初次感染后对COVID-19具有天然的保护性免疫力。
2.Science:气候的局部变化不太可能导致早期的COVID-19大流行
doi:10.1126/science.abc2535
在一项新的研究中,来自美国普林斯顿大学的研究人员发现气候的局部变化不太可能主导COVID-19的第一波疫情。他们发现大量的人仍然容易受到导致COVID-19疫情的新型冠状病毒SARS-CoV-2毒株的影响,而且这种病原体的传播速度意味着气候条件只可能对目前的感染率产生影响。相关研究结果于2020年5月18日在线发表在Science期刊上,论文标题为“Susceptible supply limits the role of climate in the early SARS-CoV-2 pandemic”。
论文第一作者兼论文通讯作者、普林斯顿大学普林斯顿环境研究所博士后研究助理Rachel Baker说,“我们预测更温暖或更潮湿的气候不会在COVID-19疫情的早期阶段减缓这种病毒的传播速度。我们确实观察到气候对COVID-19疫情的规模和时间有一定的影响,但是总地来说,由于人群中有如此多人存在易感性,无论气候条件如何,这种病毒都会迅速传播。”
Baker说,这种病毒在巴西、厄瓜多尔、澳大利亚和其他热带和南半球国家的迅速传播---这种病毒在夏季开始流行的地方---表明较暖的环境确实无助于阻止COVID-19疫情。
3.Science:定量确定不同的干预措施对COVID-19病例数量的影响
doi:10.1126/science.abb789
在一项新的研究中,来自德国马克斯-普朗克动力学与自组织研究所和哥廷根大学的研究人员如今成功地分析了与过去的遏制措施有关的德国COVID-19病例数量,并得出了未来几周的情况。他们的计算机模型还可以为其他国家采取干预措施的有效性提供新的见解。相关研究结果于2020年5月15日在线发表在Science期刊上,论文标题为“Inferring change points in the spread of COVID-19 reveals the effectiveness of interventions”。

图片来自Science, 2020, doi:10.1126/science.abb789。
目前,许多人都在关注最近几周内遏制疫情的干预措施效果如何,以及未来几周事态将如何发展。马克斯-普朗克动力学与自组织研究所的科学家们一直在研究这些问题。他们从3月中旬开始,就与哥廷根大学的科学家们一起,对德国的新冠病毒疫情过程进行了模拟。在他们的模型计算中,这些研究人员将3月份逐渐增加的公共生活限制与COVID-19病例数的发展联系起来。特别是,他们研究了3月份的三套干预措施的影响:3月8日左右取消大型公共活动,3月16日关闭教育机构和许多商店,3月22日大范围的禁止接触。
为此,这些研究人员将COVID-19新感染的时间过程数据与流行病学动力学模型相结合,分析了迄今为止的疫情发展过程,并对未来的情景进行了研究。根据计算机模型,一揽子遏制措施最初减缓了COVID-19的传播速度,最终阻止了可怕的指数式增长。论文通讯作者、马克斯-普朗克动力学与自组织研究所小组负责人Viola Priesemann说,“我们的分析清楚地显示了各种干预措施的效果,这些干预措施最终共同导致了强烈的趋势逆转。因此,我们的模型计算向我们展示了与干预措施密切相关的人们行为变化的整体影响。”
在这项新的研究中,这些研究人员并不只考虑到德国。论文共同第一作者Jonas Dehning说,“从一开始,我们就设计出了我们的计算机模型,以便它可以适用于其他国家和地区。我们的分析工具可以在GitHub上免费提供,并且已经被世界各地的研究人员使用和进一步开发。”目前,这些研究人员正在努力将这种模型应用到欧洲国家。特别重要的是,找出不同国家采取的干预措施的不同时间点,这可以让我们对各种干预措施的有效性得出结论。
4.Science:法国仅有4.4%的人感染了SARS-CoV-2病毒,远低于群体免疫所需达到的水平
doi:10.1126/science.abc3517
在一项新的研究中,来自法国、英国和美国的研究人员发现法国仅有4.4%的人感染了SARS-CoV-2病毒,这一比例远远低于群体免疫(herd immunity)所需的比例。相关研究结果于2020年5月13日在线发表在Science期刊上,论文标题为“Estimating the burden of SARS-CoV-2 in France”。在这篇论文中,他们描述了他们对法国医院和监测数据的研究以及由此取得的研究结果。
随着COVID-19大流行病继续在全球范围内蔓延,许多国家已经开始努力解决何时放松为了减缓COVID-19传播而采取的封锁限制的问题。实施这类限制措施是为了“拉平疫情增长曲线”,以防止医院和其他医疗机构超负荷运转。但是这类限制措施导致了经济问题--企业倒闭、裁员和销售放缓,从而让许多国家陷入了经济衰退。鉴于医学家们提醒道,疫苗甚至有效治疗这种疾病的药物可能要等一年或更久的时间,因此世界各国领导人面临着要求现在就取消限制的压力,而且许多领导人已经软化了态度。5月11日,法国取消了许多限制,允许人们重返工作岗位,尽管采取了新的规定,比如社交距离(social distancing)等。
在包括法国在内的国家开始取消限制的同时,医学科学家们也开始发声,指出如果过快取消限制可能带来的问题。他们指出,在没有疫苗的情况下,摆脱大流行的唯一途径是通过群体免疫,即有足够多的人携带抗体,病毒就会自行销毁(假设携带抗体的人确实具有免疫能力)。大多数科学家都认为,当大约65%到75%的人群被感染时,就会出现群体免疫。在这项新的研究中,这些研究人员发现,法国离群体免疫还差得很远,因此,随着限制措施的放松,很可能面临着第二波感染。
5.全文编译!我国科学家发表Science论文,发现两种非竞争性人类中和抗体可阻断SARS-CoV-2病毒结合人ACE2受体
doi:10.1126/science.abc2241
SARS-CoV-2病毒属于β冠状病毒属,β冠状病毒属包括5种能够感染人类的病原体。在这5种病原体中,SARS-CoV和中东呼吸综合征冠状病毒(MERS-CoV)是两种高致病性冠状病毒。与其他冠状病毒一样,位于SARS-CoV-2病毒表面上的刺突糖蛋白(S蛋白)同源三聚体在受体结合和病毒进入中起着至关重要的作用。S蛋白是一种I类融合蛋白---每个S蛋白原体由S1和S2结构域组成,受体结合结构域(RBD)位于S1结构域上。先前的研究显示,与SARS-CoV类似的是,SARS-CoV-2也利用人ACE2(hACE2)受体进入细胞。科学家们已经发现了许多靶向SARS-CoV或MERS-CoV RBD的中和抗体。因此,筛选出靶向SARS-CoV-2 RBD的中和抗体是当务之急。

对SARS-CoV-2病毒特异性中和抗体进行表征。
在一项新的研究中,来自中国科学院、中国科学院大学、首都医科大学、中国科学技术大学、深圳市第三人民医院、中国农业大学、山西高等创新研究院、中国疾病预防控制中心和中国食品药品检定研究院的研究人员表达了SARS-CoV-2 RBD蛋白作为诱饵,从COVID-19患者外周血单核细胞(PBMC)中分离出特异性的记忆B细胞。编码抗体重链和轻链的可变区分别从不同的B细胞中扩增出来,然后与抗体恒定区一起被克隆到pCAGGS质粒载体中,以产生IgG1抗体。相关研究结果于2020年5月13日在线发表在Science期刊上,论文标题为“A noncompeting pair of human neutralizing antibodies block COVID-19 virus binding to its receptor ACE2”。
6.Science:专家们概述了SARS-CoV-2疫苗研发计划
doi:10.1126/science.abc5312
近日,Science杂志发表了一篇观点文章,作者提出将需要前所未有的合作和资源来研究和开发安全有效的COVID-19疫苗,以数十亿剂的规模生产和交付给全球人民。
疫苗开发通常需要数年时间。为了加快这一进程,福瑞德•哈金森癌症研究中心(Fred Hutchinson Cancer Research Center)的Larry Corey博士和美国国立卫生研究院的专家们提出了一种设想,即创建一种协调和有效的方法来生产COVID-19疫苗。
在这篇观点文章中,Corey和合着者Anthony Fauci博士、John Mascola博士以及Francis Collins博士分享了他们将产业界、政府和学术界联合起来以满足这一迫切需求的计划。Fauci博士是美国国立卫生研究院(NIH)下属的美国国家过敏症和传染病研究所的所长。
Mascola博士是NIAID疫苗研究中心的主任,Collins博士是NIH的主任。 "我们正在经历一系列前所未有的事件,这种疾病已经在全球范围内传播,在短时间内感染的人数比现代任何其他感染都要多,"Fred Hutch的前任总裁兼主任、疫苗和传染病部门的教授Corey说。"为了克服我们面前的挑战,我们每个人都需要做到最好。新型冠状病毒疫苗的研发需要创造力、合作和承诺,以尽快拯救尽可能多的生命。"
7.Science展望:如何快速开发COVID-19疫苗?应该注意什么?
doi:10.1126/science.abb8923
快速开发预防COVID-19的疫苗是一项全球当务之急,确定利害关系和潜在障碍至关重要,因为监管和医疗决策是基于利益制定的:也就是风险计算。通过建立群体免疫可以降低大流行性传播病毒的能力,而一个关键的问题在于通过开发有效的疫苗或者接下来几年反复感染达到60%~70%的人被感染是否可以防止SARS-CoV-2的传播。由于人类还是首次接触SARS-CoV-2,所以重复流行的后果将是高得令人无法接受的死亡率、严重的经济破坏和对我们生活方式的重大调整。因此,开发一种有效疫苗的好处是非常大的,如果能够及时部署以防止重复或持续的流行,好处就更大。
疫苗开发通常以数十年为单位,因此在2020年底甚至2021年之前获得可大规模分发的批准疫苗将是前所未有的。然而,新的制造平台、基于结构的抗原设计、计算生物学、蛋白质工程和基因合成为现在快速和精确地制造疫苗提供了工具。抗病毒疫苗可分为两大类。基于基因的疫苗传递编码宿主细胞产生的蛋白质抗原的基因序列。这些疫苗包括活病毒疫苗、重组疫苗载体或核酸疫苗。以蛋白质为基础的疫苗包括全灭活病毒、单个病毒蛋白质或子域,或以颗粒形式组装的病毒蛋白质,所有这些都是在体外制造的。重组疫苗载体和核酸疫苗最适合快速生产,因为它们更容易适应平台生产技术,其中上游供应链和下游流程对于每个产品都是相同的。通过了解疫苗抗原的原子结构和疫苗中保存的目标抗原表位,可以达到精确抗原递送。
对于任何打算产生抗体介导免疫的疫苗来说,提供构象正确的蛋白质都是至关重要的。CoV刺突蛋白展示在病毒表面并帮助病毒进行入侵。它通过进行大规模重组来完成这一过程,这种重组将病毒和细胞膜拉在一起并融合它们。因此,刺突蛋白是一种动态亚稳态蛋白,主要有两种构象状态:融合前和融合后构象。展示这种抗原,使其保持原始的原生融合前刺突蛋白的表面轮廓和化学性质,将保留高质量中和抗体反应所需的抗原表位。疫苗的配方和递送也可以影响T细胞的功能和反应模式。基于基因的疫苗可诱导CD8+ T细胞,同时产生CD4+ T辅助性1型细胞免疫应答,具有良好的抗病毒特性。佐剂不仅可用于提高蛋白质疫苗引起的抗体反应的强度和持久性,还可影响T细胞来源的细胞因子模式,从而调节免疫反应。
安全性是为健康人群接种疫苗的首要目标,接种疫苗有可能使随后的SARS-CoV-2感染更加严重。这种情况以前也发生过。以前有两种不同的综合症与接种疫苗增强的疾病有关。一个是抗体依赖的增强反应(ADE),另一种是疫苗增强的呼吸道疾病(VAERD), ADE是一个Fc(抗体的尾端)介导增强反应,通常与虫媒病毒感染相关,如登革热病毒(3)。ADE的机制设计病毒抗体复合物对表达FcR的细胞的结合能力增强,这会促进病毒进入细胞。当疫苗诱导的抗体由于浓度或亲和力不足或特异性错误而不能有效中和病毒时,更有可能发生这种情况。
8.Science展望:COVID-19药物的快速再利用
doi:10.1126/science.abb9332
冠状病毒生命周期涉及大量的潜在通路的步骤,包括进入宿主细胞的内吞作用(涉及血管紧张素转换酶2 (ACE2)和跨膜蛋白酶丝氨酸(TMPRSS2)]、RNA复制和转录(涉及解旋酶和依赖RNA的RNA聚合酶(RdRp)]、翻译和蛋白水解处理过程(涉及胰凝乳蛋白酶样和木瓜蛋白酶样蛋白酶)、病毒粒子的组装以及新病毒的释放过程等。除了病毒编码的靶点外,许多宿主靶点对于病毒复制和疾病进展都是必不可少的。
SARS-CoV-2的细胞受体是ACE2。重组人ACE2 (rhACE2,或APN01)目前正在开发中,用于治疗急性肺损伤和肺动脉高压,并在健康志愿者的一期试验中证明了良好的耐受性。rhACE2已被证明可以显着减少病毒进入人类细胞衍生的器官,可能是作为病毒结合的诱饵。这为正在调查用APN01阻断病毒进入COVID-19患者的临床试验提供了支持。成功的病毒进入需要蛋白水解处理病毒的刺突糖蛋白(S蛋白),可由TMPRSS2进行。TMPRSS2抑制剂卡莫司他(camostat)在日本被批准用于治疗慢性胰腺炎术后胃返流,一般耐受性良好,偶见罕见的严重副作用。卡莫司他和相关的萘莫司他(nafamostat)都可以阻止在表达TMPRSS2的人类细胞中SARS-CoV-2的复制。卡莫司他已被证明可以在小鼠模型中阻断SARS-CoV-2感染。因此,有充分的理由支持这些药物用于COVID-19的临床试验,这些试验已经在荷兰和德国启动。
冠状病毒利用内溶酶体途径在脱壳前进入细胞。氯喹(CQ)和羟基氯喹(HCQ)是影响体内功能和阻断自噬体-溶酶体融合的抗疟药物。这两种药物已被证明可以在细胞模型中抑制SARS-CoV-2复制。阿奇霉素(Azithromycin, AZ)是一种广泛使用的广谱抗生素,它还能阻止自噬小体在人类细胞中的清除以及寨卡病毒和流感病毒在体外在人类细胞中的复制。COVID-19患者HCQ小范围随机试验的初步结果显示,病人恢复的时间缩短了。一项小型的开放标签试验表明,与单独接受HCQ和AZ联合治疗的COVID-19患者相比,HCQ和AZ联合治疗的患者的病毒载量降低了,尽管这项研究由于从研究分析中剔除了几个受试者而受到严厉批评。这些产生假设的研究已经证明,在美国紧急批准使用它们治疗COVID-19是合理的,这两种药物在美国都被广泛使用。
然而,HCQ和AZ都有潜在的心脏毒性(QT延长,可导致致命的心律失常),而且HCQ对眼睛也有潜在的负面影响。如果这些药物要成为治疗COVID-19的标准,了解风险-效益比是至关重要的。在美国和欧洲进行的几项事后分析表明,对COVID-19患者进行HCQ单药治疗最多只能获得有限的益处;一项针对美国退伍军人的大型事后分析显示,HCQ对病人有伤害。鉴于这一机制的基本原理,但缺乏设计良好的临床研究和药物诱导毒性的潜力,有必要进行对照、随机试验,以测试这些药物对COVID-19患者的疗效和安全性。
9.Science:如今可依照合乎伦理的方式开展COVID-19疫苗人体试验
doi:10.1126/science.abc1076
在美国西北大学生物伦理学家Seema Shah的领导下,一个专家小组在Science期刊上发表了一篇标题为“Ethics of controlled human infection to study COVID-19”的政策论坛论文,他们认为可以以合乎伦理的方式在人类志愿者身上测试可能的COVID-19疫苗。这类测试将涉及在疫苗接种后让志愿者接触病毒,以观察是疫苗否能预防感染。

SARS-CoV-2(之前称为2019-nCoV)的透射电镜图,图片来自NIAID RML。
数百年来,医学科学家一直在进行受控人类感染(controlled human infection, CHI)研究,也被称为人类挑战试验(human challenge trials),作为减缓或阻止疾病传播的努力的一部分。然而,在大多数情况下,人们对对之前病原体威胁的了解比对SARS-CoV-2的了解还要多,这表明此时启动针对COVID-19的CHI研究可能涉及到伦理问题。在他们的论文中,Shah和她的同事们认为,现在可以以合乎伦理的方式进行CHI研究,而且由于疫情的严重性,这样做是合理的。他们提出的框架首先承认这样的研究可能带来的社会价值,这将大大加快COVID-19疫苗的开发。他们指出,如果没有疫苗,未来数月和数年内将有数十万人死亡---如果有疫苗的话,这些人本来是可以得到拯救的。这个专家小组还建议,以伦理的方式进行此类研究,需要由世界卫生组织等受人尊敬的机构进行协调和监督。
这个专家小组还建议,志愿者应从不会出现较严重的疾病症状的低风险群体中挑选,没有基础疾病的年轻、健康的成年人是很好的候选者。他们还建议对此类测试的地点进行仔细选择。如果志愿者出现更严重的症状,这些地点不仅需要为他们提供最好的护理,而且还应该有能力通过建立一个不被其他患者挤占的环境来保护卫生工作者。
10.Science全文编译:全球首个!中国团队发布新冠疫苗动物实验研究结果
doi:10.1126/science.abc1932
为了构建用于SARS-CoV-2候选疫苗开发的临床前体外中和模型和挑战模型,在一项新的研究中,来自中国医学科学院医学实验动物研究所、浙江省疾病预防控制中心、科兴控股生物技术有限公司、中国科学院生物物理研究所、中国食品药品检定研究院和中国疾病预防控制中心传染病预防控制所等研究机构的研究人员从11名住院患者(包括5名重症监护患者)---5名来自中国、3名来自意大利、1名来自瑞士、1名来自英国和1名来自西班牙---的支气管肺泡灌洗液(BALF)样本中分离出SARS-CoV-2毒株。这些患者在最近的疫情爆发期间感染了SARS-CoV-2。这11份样本含有的SARS-CoV-2毒株在利用所有可用序列构建的系统发育树上广泛分布,在一定程度上代表了传播的SARS-CoV-2毒株。
相关研究结果于2020年5月6日在线发表在Science期刊上,论文标题为“Rapid development of an inactivated vaccine candidate for SARS-CoV-2”。
目前COVID19的严重流行,以及全球死亡人数急剧增加,使得迫切需要开发一种SARS-CoV-2疫苗。在临床前研究和临床试验这两个阶段的疫苗开发中,安全性和有效性是至关重要的。虽然现在确定研究SARS-CoV-2感染的最佳动物模型还为时过早,但在SARS-CoV-2感染后出现COVID-19样症状的恒河猴似乎是研究这种疾病的有前景的动物模型。这些研究人员在这项新的研究中为PiCoVacc疫苗在恒河猴中的安全性提供了证据;并且在研究中没有观察到感染增强或免疫病理加重。这些数据还证明,在恒河猴中接种每剂量6μg的PiCoVacc疫苗对随后的SARS-CoV-2挑战有完全的保护作用。
总之,这些研究结果为SARS-CoV-2疫苗的临床开发提供了一条道路。PiCoVacc疫苗以及其他SARS-CoV-2候选疫苗的第I、II、III期临床试验预计将于今年晚些时候开始。
11.Science:新研究表明COVID症状追踪应用程序在应对病毒疫情中大有可为
doi:10.1126/science.abc0473
在一项新的研究中,一个在大数据研究和流行病学方面有专长的科学家联盟开发出一款COVID症状追踪应用程序(App),旨在快速收集信息,帮助应对正在发生的COVID-19大流行病。在美国和美国,有250万多人较早地使用了这款app,这为医生、科学家和政府官员提供 了关于COVID-19的宝贵数据,以便更好地抗击病毒疫情。相关研究结果于2020年5月5日在线发表在Science期刊上,论文标题为“Rapid implementation of mobile technology for real-time epidemiology of COVID-19”。

图片来自Science, 2020, doi:10.1126/science.abc0473。
论文通讯作者、麻省总医院(MGH)癌症中心癌症流行病学主任Andrew T. Chan博士说,“这款App每天都会收集社区中的个人信息,包括他们是否感觉良好,如果不舒服,他们的具体症状是什么,以及他们是否接受过COVID-19检测。”这款app旨在深入了解关于COVID-19 的热点地区在哪里以及需要注意的新症状,它可能作为一种有用的规划工具,为自我隔离提供指导方针方面的信息,确定需要增加呼吸机和扩大医院容量的地区,并提供实时数据,为未来的疫情爆发做好准备。
这款称为COVID症状追踪应用程序(COVID Symptom Tracker)的app于3月24日在英国推出,3月29日在美国上市。自推出以来,已经有超过300万人使用过它。
12.Science:对SARS-CoV-2 S刺突蛋白进行位点特异性的聚糖分析
doi:10.1126/science.abb9983
β冠状病毒成员SARS-CoV-2---一种导致COVID-19的病原体---的出现对全球人类健康构成了重大威胁。疫苗开发的重点是体液免疫反应的主要靶点--介导细胞进入和膜融合的刺突(S)糖蛋白。SARS-CoV-2 S基因编码每个原体上的22个N连接聚糖序列子(N-linked glycan sequon),这些聚糖序列子可能在蛋白质折叠和免疫逃避中发挥作用。在一项新的研究中,通过使用一种位点特异性的质谱方法,Yasunori Watanabe等人揭示了重组SARS-CoV-2 S免疫原上的聚糖结构。这种分析使得能够绘制这种病毒的三聚体S蛋白的聚糖加工状态图。这些作者展示了SARS-CoV-2 S聚糖与典型的宿主聚糖加工的不同,这可能对病毒病理生物学和疫苗设计有影响。
13.全文编译!我国科学家从结构上揭示瑞德西韦抑制新冠病毒RNA依赖性RNA聚合酶机制
doi:10.1126/science.abc1560
SARS-CoV-2是一种正链RNA病毒。它的复制是由病毒非结构蛋白(nsp)的多亚基复制/转录复合物介导的。这种复合物的核心成分是RNA依赖性RNA聚合酶(RdRp)的催化亚基(nsp12)。nsp12本身几乎没有什么活性,其功能需要包括nsp7和nsp8在内的辅助因子,这些辅助因子可以增加RdRp的模板结合和持续合成能力。RdRp也被提出是一类称为核苷酸类似物的抗病毒药物---包括瑞德西韦(remdesivir, 也称为GS-5734)---的靶点,其中瑞德西韦是一种前体药物,在细胞内可转化为三磷酸形式的活性药物。因此,RdRp一直是结构生物学研究的重点。科学家们已解析出nsp7、nsp8以及nsp12-nsp7-nsp8复合物的结构,并提供了RdRp复合物的整体结构。然而,由于没有SARS-CoV-2 RdRp与RNA模板或核苷酸抑制剂所形成的复合物的结构,药物发现工作受到阻碍。
在一项新的研究中,来自中国科学院、浙江大学、清华大学、北京协和医院、无锡佰翱得生物科学有限公司、上海交通大学和浙江省免疫与炎症疾病重点实验室的研究人员解析出SARS-CoV-2 RdRp复合物在apo形式(apo form)下以及与模板-引物RNA和抗病毒药物瑞德西韦(Remdesivir)结合在一起时的两种低温电镜结构。相关研究结果近期发表在Science期刊上,论文标题为“Structural basis for inhibition of the RNA-dependent RNA polymerase from SARS-CoV-2 by remdesivir”。
COVID-19大流行已经在全球范围内造成了情感上的痛苦和经济负担。对病毒生命周期至关重要的酶,因其与宿主蛋白不同,是很好的抗病毒药物靶点。在病毒酶中,RdRp是现有许多核苷酸类药物的主要靶点。在这篇论文中,这些研究人员报道了SARS-CoV-2 RdRp复合物的apo形式以及与模板-引物RNA和活性形式的雷德西韦结合在一起时的结构。这些结构揭示了模板-引物RNA是如何被这种酶识别的,以及瑞德西韦如何抑制链的延伸。结构比较和序列比对表明,RdRp识别底物RNA和瑞德西韦抑制RdRp的模式在不同的RNA病毒中高度保守,这为设计基于核苷酸类似物的广谱抗病毒药物提供了基础。此外,这些结构为现有的核苷酸类药物(包括强效的EIDD-2801)的建模和修饰提供了一个坚实的模板。总之,这些观察结果为设计更强效的抑制剂来对抗SARS-CoV-2的恶性感染提供了合理的基础。
14.Science:新发现!SARS-CoV-2或会感染宿主肠道细胞并进行繁殖!
doi:10.1126/science.abc1669
近日,一项刊登在国际杂志Science上的研究报告中,来自胡布勒支研究所等机构的科学家们通过研究发现,新型冠状病毒SARS-CoV-2或会感染肠道细胞并在肠道细胞中复制。文章中,研究人员利用先进的人类肠道培养模型进行研究,在体外成功实现了SARS-CoV-2病毒的繁殖,同时监测了细胞对病毒的反应,这或许就能提供一种研究COVID-19的新型细胞培养模型,相关研究发现或能解释研究者观察到的结果,即大约三分之一的COVID-19患者会经历腹泻等胃肠道症状,以及研究人员能在粪便样本中检测到病毒这一现象。
尽管呼吸道和胃肠道器官有着很大的差别,但也有一些关键相似之处,一个特别有趣的相似之处就是ACE2受体的存在,该受体是病毒进入宿主细胞的关键,肠道中布满了ACE2受体,然而直到现在为止,研究人员并不清楚是否肠道细胞真的会被感染并且产生病毒颗粒。
这项研究中,研究人员向通过研究确定是否SARS-CoV-2能够直接感染肠道中的细胞,如果的确是这样的话,其就能够在肠道细胞中复制,随后研究者利用人类肠道类器官进行研究,即能在实验室中生长的人类肠道微小版本;这些类器官中包含人类肠道内壁细胞,这就使其能够成为调查SARS-CoV-2感染的非常有竞争力的模型之一。
当研究者将病毒添加到类器官中时,SARS-CoV-2就能够快速感染类器官,病毒会进入到肠道类器官的亚群细胞中,而且随着时间延续,被感染的细胞的数量也会不断增加,利用一种名为电子显微镜的技术(能观察并对细胞中的不同组分进行成像),研究人员发现,类器官细胞内外都存在病毒颗粒,由于疫情封锁的原因,研究人员均在家中远程研究并分析了受感染的类器官的虚拟切片。
随后研究者利用RNA测序技术调查了肠道细胞对病毒的反应,研究结果表明,所谓的干扰素刺激基因会被激活,这些基因已知能够对抗病毒感染,后期研究中研究人员重点分析了这些基因,他们想通过相关研究结果来开发新型疗法。此外,研究者还在不同状况下培养了类器官,这些状况会导致细胞中ACE2受体处于较高和较低的水平,让研究人员惊讶的是,他们发现,在ACE2较高和较低水平下,病毒均能够感染肠道细胞,相关研究结果或能帮助开发新方法来阻断病毒进入宿主细胞。
15.Science:接触方式的变化决定了中国COVID-19疫情的动态
doi:10.1126/science.abb8001
为了阻止2019年新型冠状病毒病(COVID-19)的传播,中国采取了密集的非药物干预措施。随着这种疾病的传播在其他国家加剧,年龄、接触模式、社会隔离、感染易感性和COVID-19动态之间的相互作用仍不清楚。为了回答这些问题,来自中国复旦大学等研究机构的研究人员分析了武汉和上海在疫情发生前和疫情发生期间的接触者调查数据以及湖南省的接触者追踪信息。在COVID-19的社会隔离期间,日常接触减少了7~8倍,大部分互动仅限于家庭。这些作者发现,0~14岁儿童比15~64岁成年人更不容易感染SARS-CoV-2病毒(优势比0.34,95%置信区间0.24~0.49),而65岁以上的人更容易感染(优势比1.47,95%置信区间1.12~1.92)。基于这些数据,这些作者建立了一个传播模型来研究社会隔离和学校关闭对疾病传播的影响。这些作者发现,中国在疫情爆发期间实施的社会隔离就足以控制COVID-19。虽然主动关闭学校本身不能阻断传播,但可以将发病高峰降低40%~60%,从而延缓疫情的发生。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


