乳腺癌新药!礼来公布Verzenio(唯择®)新数据:治疗HR+/HER2-高危早期乳腺癌的CDK4/6抑制剂!
来源:本站原创 2021-10-24 03:11
今年3月8日(三八妇女节),Verzenio(唯择®)在中国正式上市!

2021年10月23日讯 /生物谷BIOON/ --礼来(Eli Lilly)近日公布了3期monarchE试验的更新数据。该试验正在评估靶向抗癌药Verzenio(中文商品名:唯择®,通用名:abemaciclib,阿贝西利片)联合标准辅助内分泌疗法(ET)治疗HR+/HER2-、淋巴结阳性、高危早期乳腺癌(EBC)患者。更新数据已在ESMO虚拟全体会议上公布,同时发表在《肿瘤学年鉴》(Annals of Oncology)上。详见:Adjuvant abemaciclib combined with endocrine therapy for high-risk early breast cancer: updated efficacy and Ki-67 analysis from the monarchE study。
正如之前在《临床肿瘤学杂志》(JCO)上发表的数据,monarchE试验达到了主要终点:在意向性治疗(ITT)人群中,与ET治疗组相比,Verzenio+ET治疗组无侵袭性疾病生存期(IDFS)有统计学意义的显著改善。
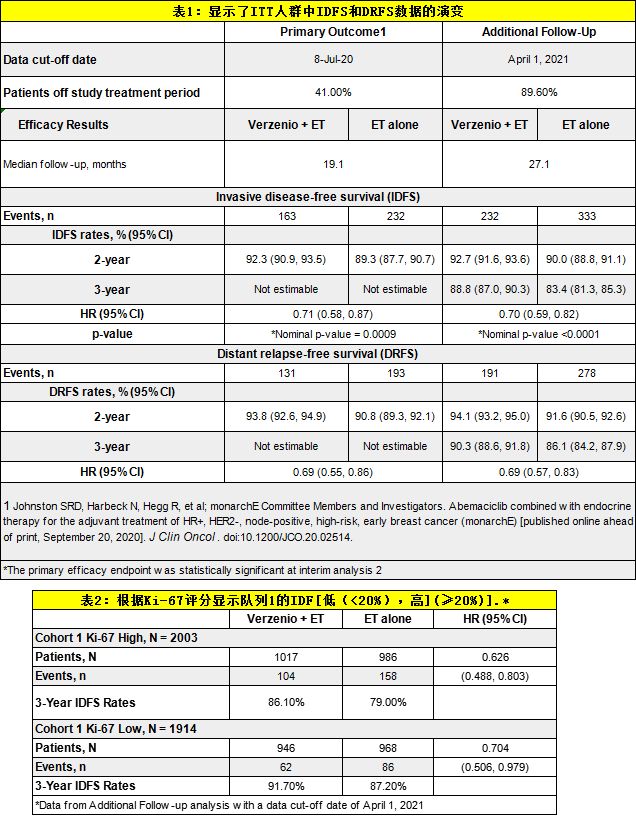
该试验包括HR+/HER2-淋巴结阳性EBC女性和男性,这些患者根据临床和病理特征有很高的疾病复发风险(N=5637)。试验中,患者被分配到2个队列中的一个。队列1入组的患者≥4个腋窝淋巴结(ALN)阳性,或1-3个阳性ALN且要么为3级疾病或要么肿瘤大小≥5厘米。队列2入组的患者1-3个阳性ALN且中心确定的Ki-67评分≥20%(在研究中定义为“Ki-67高”)。Ki-67是一种细胞增殖的标志物。Ki-67评分也在具有合适样本的队列1患者中进行中心测定,但该队列的入组不需要测定Ki-67。ITT人群包括队列1和队列2。
此次公布的更新数据,包括反映中位随访27个月的最新结果。在最新的分析中,Verzenio对IDFS和远端无复发生存期(DRFS)的益处继续维持(下表1)。3年后,IDFS和DRFS的绝对改善率分别为5.4%、4.2%。此外,还对每年的IDFS和DRFS危险比(HR)估计值进行了探索性分段分析,结果表明,IDFS影响的大小随着时间的推移而增加:从第一年(0-1年HR=0.80,95%CI:0.59,1.03)到第二年(1-2年HR=0.68,95%CI:0.52,0.87),并在2年研究治疗期后继续加强(2年以上HR=0.60,95%CI:0.40,0.86)。同样,DRFS的HR估计值从第一年(0-1年HR=0.73,95%CI:0.52,0.99)到第二年(1-2年HR=0.68,95%CI:0.51,0.88)也增强,并在超过2年研究治疗期后持续(2年以上HR=0.69,95%CI:0.45,1.03)。
此外,最新结果还分析了Ki-67评分对预后和Verzenio获益可能性的影响。正如所料,在具有高危临床和病理特征的患者中,Ki-67评分≥20%是复发风险增加的预后因素。然而,在具有高危临床和病理特征的患者中,无论Ki-67评分是低(<20%)或高(≥20%),Verzenio在降低复发风险方面都具有一致的益处。现在90%的患者已经完成了2年治疗期或提前停止治疗,安全性数据被认为是成熟的,并与已知的Verzenio概况保持一致。monarchE试验的所有患者将继续接受随访,以评估总生存期(OS)和其他终点。目前,OS数据尚不成熟。
monarchE试验调查员、贝勒大学医学中心乳腺癌研究主席Joyce A.O'Shaughnessy医学博士表示:“monarchE试验的结果令人印象深刻,我们对治疗效益的一致性以及随着时间的推移在降低复发和转移性疾病发生风险方面观察到的日益显著的效果感到鼓舞。这些数据表明,在高危早期乳腺癌患者的内分泌治疗中添加辅助性Verzenio治疗有潜力改变我们治疗这些患者的方式,并可能解决那些具有临床和病理风险特征、需要新治疗方案的患者群体中的重大未满足需求。”
monarchE试验结果(点击图片,查看大图)
2021年10月,美国FDA批准Verzenio联合内分泌疗法(他莫昔芬或芳香化酶抑制剂),辅助治疗HR+/HER2-高危早期乳腺癌(EBC)成人患者。具体为:淋巴结阳性、复发风险高、经FDA批准的检测方法确定为Ki-67评分≥20%的HR+/HER2- EBC患者。Ki-67是一种细胞增殖的标志物。
值得一提的是,Verzenio是第一个也是唯一一个被批准用于上述患者群体的CKD4/6抑制剂。此外,在治疗HR+/HER2- EBC方面,Verzenio是近二十年来FDA批准添加至辅助内分泌治疗的首个药物。来自3期monarchE研究的数据显示,在淋巴结阳性、有高复发风险的HR+/HER2- EBC患者中,与标准辅助内分泌疗法(ET)相比,Verzenio联合ET治疗使疾病复发风险显示出统计学意义和临床意义的降低。
此次FDA批准建立在Verzenio现有证据的基础上,该药先前已被批准用于治疗某些类型的HR+/HER2-晚期或转移性乳腺癌。在此次批准的同时,FDA还扩大了Verzenio在所有适应症中的使用,当与内分泌疗法(ET)联合使用时,纳入男性患者。Verzenio片剂规格有200mg、150mg、100mg、50mg。
此次批准基于对monarchE试验亚组的疗效分析结果,以及事后进行的额外随访。在这项分析中,Verzenio联合ET继续显示出临床意义的益处:对于有高危临床和病理特征且Ki-67评分≥20%的患者,与标准辅助ET相比,Verzenio+ET将乳腺癌复发或死亡风险降低了37%(HR=0.626;95%CI:0.49-0.80),3年内IDFS事件率的绝对受益率为7.1%。在本次分析中,Verzenio+ET组的IDFS事件数量为104起,而ET组为158起。总生存期(OS)数据尚不成熟,正在进行进一步的随访。该试验中,不良反应与Verzenio已知的安全性特征一致。

乳腺癌是全世界女性中最常见的癌症。估计90%的乳腺癌是在早期诊断的。大约70%的乳腺癌是HR+/HER2-,这是最常见的亚型。即使在HR+/HER2-亚型中,乳腺癌也是一种复杂的疾病,而且很多因素——例如癌症是否已经扩散到淋巴结、肿瘤的生物学特性——都会影响复发的风险。
Verzenio的活性药物成分为abemaciclib,这是一种口服靶向性CDK4/6抑制剂,能够选择性抑制细胞周期蛋白依赖性激酶4/6(CDK4/6),恢复细胞周期控制,阻断肿瘤细胞增殖。细胞周期失控是癌症的一个标志性特征,CDK4/6在许多癌症中均过度活跃,导致细胞增殖失控。CDK4/6是细胞周期的关键调节因子,能够触发细胞周期从生长期(G1期)向DNA复制期(S1期)转变。在雌激素受体阳性(ER+)乳腺癌中,CDK4/6的过度活跃非常频繁,而CDK4/6是ER信号的关键下游靶标。临床前数据表明,CDK4/6和ER信号双重抑制具有协同作用,并能够抑制G1期ER+乳腺癌细胞的生长。临床证据也表明,abemaciclib穿过了血脑屏障。晚期癌症患者,包括乳腺癌患者,脑脊液中abemaciclib及其活性代谢物(M2和M20)的浓度与未结合血浆浓度相当。
Verzenio于2017年10月批准上市,用于治疗HR+/HER2-晚期或转移性乳腺癌患者,该药适用于:(1)联合一种芳香酶抑制剂(AI)作为初始内分泌疗法治疗绝经后女性;(2)联合氟维司群用于接受内分泌疗法病情进展的女性;(3)作为一种单药疗法,用于接受内分泌疗法和化疗控制转移性疾病但病情进展的成人患者。
目前,已有多款CDK4/6抑制剂上市,除了礼来的Verzenio之外,还有辉瑞的Ibrance(palbociclib)以及诺华的Kisqali(ribociclib)。在中国,辉瑞Ibrance(中文商品名:爱博新,通用名:palbociclib,帕博西尼)于2018年8月获得批准,成为国内获批的首款CDK4/6抑制剂,该药适应症为:联合芳香酶抑制剂,作为一种初始内分泌疗法,用于HR+/HER2-局部晚期或转移性乳腺癌绝经后女性患者的治疗。
2020年12月,礼来Verzenio(中文商品名:唯择®,通用名:abemaciclib,阿贝西利)获得批准,成为国内获批的第二款CDK4/6抑制剂,该药用于治疗HR+/HER2-局部晚期或转移性乳腺癌:(1)与芳香化酶抑制剂联合使用作为绝经后女性患者的初始内分泌治疗;(2)与氟维司群联合用于既往曾接受内分泌治疗后出现疾病进展的患者。
2021年3月8日,礼来同时在北京和上海举行上市新闻发布会:CDK4/6抑制剂Verzenio(唯择®,阿贝西利片)在中国成功上市。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


