Nat Commun:利用CRISPR/Cas9介导的A2AR基因缺失可显著增强CAR-T细胞抵抗一系列癌症的疗效
来源:本站原创 2021-05-31 23:07
2021年5月31日讯/生物谷BIOON/---一种称为嵌合抗原受体(CAR)T细胞(CAR-T)疗法的癌症免疫疗法是革命性的,因为它已经产生了非常有效和持久的临床反应。CAR是一种工程化的合成受体,其功能是重新引导淋巴细胞(最常见的是T细胞)识别和消除表达特定靶抗原的细胞。CAR与细胞表面上表达的靶抗原的结合不依赖于MHC 受体,从而导致强有力的T细胞活化
2021年5月31日讯/生物谷BIOON/---一种称为嵌合抗原受体(CAR)T细胞(CAR-T)疗法的癌症免疫疗法是革命性的,因为它已经产生了非常有效和持久的临床反应。CAR是一种工程化的合成受体,其功能是重新引导淋巴细胞(最常见的是T细胞)识别和消除表达特定靶抗原的细胞。CAR与细胞表面上表达的靶抗原的结合不依赖于MHC 受体,从而导致强有力的T细胞活化和强大的抗肿瘤反应。抗CD19 CAR-T细胞疗法治疗B细胞恶性肿瘤的空前成功导致它在2017年被美国食品药品管理局(FDA)批准上市。然而,CAR-T细胞疗法仍有重大的局限性必须解决,包括危及生命的CAR-T细胞相关毒性,对实体瘤的疗效有限,B细胞恶性肿瘤中的抑制和抵抗性,抗原逃逸,有限的持久性,较差的迁移和肿瘤浸润,以及免疫抑制性微环境。
在CAR-T细胞疗法中,先收集患者自身的免疫细胞,并对它们进行基因改造,然后将它们输注回患者体内以对抗他们体内的癌症。世界各地的科学家们正在开发一种潜在的新方法,使得CAR-T细胞疗法对乳腺癌和其他实体癌更加有效。
腺苷(adenosine)是一种限制抗肿瘤免疫反应的免疫抑制因子,通过激活腺苷A2A受体(adenosine A2A receptor, A2AR)来抑制包括T细胞在内的多种免疫细胞亚群。在一项新的研究中,澳大利亚研究人员通过使用小鼠和人类CAR-T细胞,发现利用临床相关的CRISPR/Cas9策略靶向A2AR,可显著提高这些细胞的体内疗效,从而改善小鼠的生存。相关研究结果于2021年5月28日发表在Nature Communications期刊上,论文标题为“CRISPR/Cas9 mediated deletion of the adenosine A2A receptor enhances CAR T cell efficacy”。

这些作者发现利用CRISPR/Cas9敲除A2AR基因,CAR-T细胞在对抗乳腺癌方面明显更有效。虽然到目前为止,这项研究只在小鼠模型中使用小鼠和人类CAR-T细胞,但是他们相信它有可能进展到临床试验。
这项研究的一个关键观察结果是,虽然利用药物拮抗A2AR导致CAR-T细胞功能增强,但当CAR-T细胞产生于A2AR受体功能完全丧失的A2AR-/-供体小鼠时,它们的效果更为显著。这导致了一个假设,即设计一种基因编辑策略来沉默A2AR信号(而不是由药物拮抗剂介导的部分和/或临时抑制)在CAR-T细胞治疗中是有利的。因此,他们试图研究使用CRISPR/Cas9或shRNA介导的A2AR靶向治疗是否能增强CAR-T细胞的功能。这些技术很适合与CAR-T细胞生产相结合,因为基因编辑程序可以与CAR转导平行引入。特别地,CRISPR/Cas9介导的PD-1、TGFβ受体II或磷酸酶PTPN2缺失之前已被证实可以增强CAR-T细胞功能,促进T细胞增殖和增加促炎性细胞因子的产生。
在这项新的研究中,这些作者发现,在CAR刺激后,通过shRNA敲降A2AR可以促进小鼠CAR-T细胞的效应功能,并增强CAR-T细胞在体内的效应功能,但这也与持久性降低有关。相反,在小鼠和人类衍生的CAR-T细胞中,CRISPR/Cas9介导的A2AR缺失可以破坏腺苷的免疫抑制作用并增强效应功能,同时对CAR-T细胞的记忆表型或持久性没有有害影响。此外,由经过基因编辑的人类CAR-T细胞诱发的体内抗肿瘤功效的增强与肝脏毒性的酶学读数和组织切片分析所定义的毒性无关。
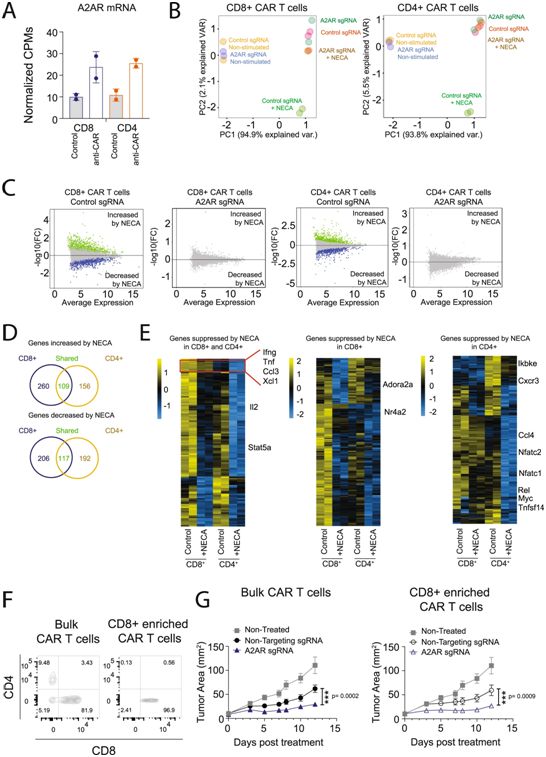
CRISPR/Cas9靶向A2AR可增强CD8+和CD4+CAR-T细胞的作用。图片来自Nature Communications, 2021, doi:10.1038/s41467-021-23331-5。
这些结果表明,与shRNA介导的A2AR敲降或与A2AR药物拮抗剂相结合相比,使用CRISPR/Cas9诱导A2AR的完全敲除是一种增强CAR-T细胞功能的卓越治疗方法。鉴于经过CRISPR/Cas9基因编辑的CAR-T细胞正在用于临床试验,这种方法很容易转化为临床应用。此外,通过CRISPR/Cas9介导的基因编辑靶向A2AR适用于CAR-T细胞治疗包括乳腺癌、卵巢癌、肺癌、急性髓系白血病、多发性骨髓瘤和非霍奇金淋巴瘤在内的多种肿瘤类型,在这些肿瘤类型中,人们已发现腺苷信号可抑制抗肿瘤免疫反应。
综上所述,这些作者发现由CRISPR/Cas9介导的A2AR基因缺失所引起的效果优于短发夹RNA(shRNA)介导的A2AR基因敲降或药物阻断A2AR。从机制上讲,经过A2AR基因编辑的人类CAR-T细胞对腺苷介导的转录变化有明显的抵抗力,导致包括IFNγ和TNF在内的细胞因子产生增强,JAK-STAT信号通路相关基因的表达增加。A2AR缺乏的CAR-T细胞耐受性良好,不会诱发小鼠出现明显病症,这支持使用CRISPR/Cas9靶向A2AR来改善临床上的CAR-T细胞功能。(生物谷 Bioon.com)
参考资料:
Lauren Giuffrida et al. CRISPR/Cas9 mediated deletion of the adenosine A2A receptor enhances CAR T cell efficacy. Nature Communications, 2021, doi:10.1038/s41467-021-23331-5.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


