CAR-T细胞疗法研究进展(第27期)
来源:本站原创 2022-03-31 23:59
2022年3月31日讯/生物谷BIOON/---CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被 认为是最有前景的肿瘤治疗方式之一。正如所有的技术一
2022年3月31日讯/生物谷BIOON/---CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被 认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实 验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产 生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Nature:重磅!对免疫系统进行重编程,有望设计出新一代更高效抵抗血癌和实体瘤的CAR-T细胞疗法
doi:10.1038/s41586-022-04494-7
美国食品药品管理局(FDA)批准上市的第一批细胞疗法是活的药物:从癌症患者身上提取出来、然后经过经基因改造后靶向攻击肿瘤细胞的免疫细胞。然而,对于许多患者来说,这些先进的疗法并没有带来持久的缓解。如今,在一项新的研究中,来自美国纽约基因组中心和纽约大学的研究人员开发出一种基因筛选平台,以确定能够增强免疫细胞的基因,使它们在体内能够更加持久存在,并提高它们根除肿瘤细胞的能力。相关研究结构于2022年3月16日在线发表在Nature期刊上,论文标题为“A genome-scale screen for synthetic drivers of T cell proliferation”。
在这篇论文中,这些作者描述了合成基因程序的发现,这些基因程序深刻地重塑了一类特定的称为T细胞的免疫细胞,使它们更有效地寻找和对抗癌细胞。在论文通讯作者、纽约基因组中心核心成员、纽约大学生物学助理教授Neville Sanjana博士的领导下,他们剖析了来自人类供者的多个T细胞亚群中近12000个不同基因的影响。这一大规模基因筛选的目的是准确识别那些使T细胞增殖的基因,并了解这些基因如何影响与抗癌有关的免疫细胞功能的其他方面。

在原代T细胞中进行人ORF文库筛选,图片来自Nature, 2022, doi:10.1038/s41586-022-04494-7。
通过将筛选中发现的修饰基因与现有的CAR相结合,这些作出能够设计出更有效地消除肿瘤细胞的T细胞。一个特殊的修饰基因,即LTBR(lymphotoxin beta receptor),起着分子青春之泉的作用:有了LTBR,T细胞就会增殖,拥有更大比例的更年轻、更类似干细胞的细胞,并抵制随着时间推移而变得功能衰竭。添加LTBR还使T细胞分泌更多的细胞因子,这对T细胞的抗肿瘤活性至关重要。细胞因子在使T细胞更好地与体内其他免疫细胞沟通并对癌症发起协调攻击方面发挥着重要作用。有趣的是,LTBR在T细胞中通常不表达,这凸显了基因组规模筛选在找到激活全新细胞程序的基因方面的力量。
2.Cancer Res:重磅研究!CD70靶向同种异体CAR T细胞治疗肾癌的临床前研究进展
doi:10.1158/0008-5472.CAN-21-2931
近日,美国加利福尼亚州同种异体基因治疗公司研究者们在Cancer Research杂志上发表了题为“Preclinical Development and Evaluation of Allogeneic CAR T Cells Targeting CD70 for the Treatment of Renal Cell Carcinoma”的文章,该研究提供了有效性和安全性数据支持对CD70 CAR T细胞治疗肾癌的评估,并导致同种异体CD70 CAR T候选进入I期临床试验。
在本研究中,研究者首先产生并鉴定了一组基于抗CD70单链抗体的CAR T细胞。尽管CD70在T细胞上表达,但仍能从体外具有较强活性的单链抗体亚群中产生CAR T。CD70 CAR的表达在顺式中屏蔽了CD70的检测,并提供了对CD70 CAR-T介导的自相残杀的保护。两种不同类型的CAR T细胞具有不同的记忆表型、激活状态和细胞毒活性。
总之,研究者发现CD70在肾细胞癌中有较高比例的同源表达,这表明它可能是一个有吸引力的CAR T靶点。与以前的报告一致,研究者还发现活化的T淋巴细胞上有表达。这种表达可能会导致CAR - T细胞自相残杀,正如已经报道的在T细胞上表达的其他肿瘤靶点,如CD38和CD7。尽管有潜在的自杀性,大量基于单链抗体的CD70 CAR被成功地转导并产生了CAR T细胞。
3.Front Immunol:改进的CAR-T细胞为癌症免疫疗法提供了新的希望
doi:10.3389/fimmu.2022.836549
在一项新的研究中,英国伦敦国王学院癌症与制药科学学院的John Maher博士及其研究团队与Leucid Bio公司和生物技术公司LUMICKS合作,描述了一种新的嵌合抗原受体(CAR)T细胞(CAR-T)疗法:它增加了第二个受体,增强了CAR-T细胞在临床前模型中靶向和摧毁特定癌细胞的能力。它开展的基因编辑在提高它作为癌症免疫疗法的有效性方面提供了新的希望。相关研究结果于2022年2月9日发表在Frontiers in Immunology期刊上,论文标题为“Engineering of an Avidity-Optimized CD19-Specific Parallel Chimeric Antigen Receptor That Delivers Dual CD28 and 4-1BB Co-Stimulation”。

设计一组CD19特异性的CAR,图片来自Frontiers in Immunology, 2022, doi:10.3389/fimmu.2022.836549。
4.Science子刊:一种正交IL-2/IL-2Rβ系统促进CAR-T细胞的持久存在并增强肿瘤清除效果
doi:10.1126/scitranslmed.abg7565
嵌合抗原受体(CAR)T细胞(CAR-T)在难治性血液病肿瘤患者中诱发持久的反应。然而,较低的CAR T细胞活性,不良的定植,或住院期间的短暂持久性,都可能导致肿瘤进展或复发。此外,过度的CAR-T细胞扩增和激活可导致危及生命的细胞因子释放综合征(CRS)。因此,对CAR-T细胞群体的住院控制是至关重要的。白细胞介素-2(IL-2)是一种激活T细胞的重要细胞因子,被认为是治疗癌症的一种方法。然而,IL-2的全身给药往往会导致严重的毒副作用,因此它的临床应用一直受到限制。
在一项新的研究中,来自美国Synthekine公司的研究人员报告了一种能够特异性地在体内控制CAR-T细胞的增殖和激活的正交IL-2受体/配体系统,在这种系统中,一种正交人IL-2(STK-009)选择性地与CAR-T细胞表面上表达的正交人IL-2Rβ(hoRb)配对。STK-009在存在和不存在肿瘤抗原的情况下让表达hoRb的CAR-T细胞增殖,并维持干细胞记忆T细胞(stem cell memory T cell, TSCM)和效应T细胞的存在。
对T细胞进行基因改造使之表达受体hoRb,这种受体只能被STK-009激活。hoRb被引入到靶向CD19的CAR-T细胞中,并将这些表达hoRb的CAR-T细胞转移到患有淋巴瘤的小鼠身上。在这种临床前模型中,向接受表达hoRb的CAR-T细胞移植的小鼠受者给送STK-009促进了CAR-T细胞的激活、增殖和抗肿瘤功效,具有有限的全身毒副作用。因此,成对的正交细胞因子-正交细胞因子受体对可能提供一种更安全的方法来加强过继性细胞治疗。
在人类CAR难治性淋巴瘤的临床前模型中,STK-009治疗导致了表达hoRb的抗CD19-CD28ζ的CAR-T细胞(SYNCAR)的全身和瘤内增殖和激活。这种正交IL-2受体/配体系统通过在体内选择性地增殖和激活CAR-T细胞,在大型皮下淋巴瘤中提供完全的反应,即使CAR-T细胞的剂量大幅减少,也是如此。停用STK-009允许正常的CAR-T细胞减少,从而限制了肿瘤抗原特异性T细胞激活所诱发的细胞因子释放综合征。这些数据表明,这种正交IL-2受体/配体系统提供了使CAR-T细胞疗法疗效最大化所需的体内控制。
5.Science子刊:人正交IL-2/IL-2Rβ系统可增强CAR-T细胞的增殖和抗肿瘤效果
doi:10.1126/scitranslmed.abg6986
白细胞介素-2(IL-2)是一种至关重要的T细胞细胞因子,可促进T细胞增殖和效应功能,被认为是治疗癌症的一种方法;然而,由于IL-2的全身给药往往会导致严重的毒副作用,这限制了它在增强CAR-T细胞免疫疗法中的应用。以前,小鼠IL-2及其同源受体被设计成一对正交(ortho)细胞因子-正交细胞因子受体,能够递送IL-2信号而没有毒副作用。
在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院和斯坦福大学医学院的研究人员设计出一对人正交IL-2(orthogonal IL-2, ortho-hIL-2)和人正交IL-2Rβ(ortho-hIL-2Rβ)对,含有人类特异性突变。ortho-hIL-2对表达ortho-hIL-2Rβ的细胞具有选择性,对野生型T细胞没有明显的信号传导作用。ortho-hIL-2诱导IL-2受体信号传导,支持IL-2依赖性细胞系和经转导后表达ortho-hIL-2Rβ的原代T细胞的增殖。
对T细胞进行基因改造使之表达受体ortho-hIL-2Rβ,这种受体只能被ortho-hIL-2激活。ortho-hIL-2Rβ被引入到靶向CD19的CAR-T细胞中,并将这些表达ortho-hIL-2Rβ的CAR-T细胞转移到患有白血病的小鼠身上。在这种临床前模型中,向接受表达ortho-hIL-2Rβ的CAR-T细胞移植的小鼠受者给送ortho-hIL-2促进了CAR-T细胞的激活、增殖和抗肿瘤功效,具有有限的全身毒副作用。因此,成对的正交细胞因子-正交细胞因子受体对可能提供一种更安全的方法来加强过继性细胞治疗。通过使用特异性靶向CD19的CAR-T细胞,这些作者发现在过继转移到携带CD19+Nalm6白血病异种移植的免疫缺陷小鼠2周后,ortho-hIL-2诱导ortho-hIL-2Rβ阳性CAR-T细胞在体内增殖的剂量依赖性增加多达1000倍。
6.Nat Commun:临床前研究成功开发和验证用于治疗B细胞癌症的三合一BAFF CAR-T细胞
doi:10.1038/s41467-021-27853-w
在一项新的研究中,来自美国凯斯西储大学和大学附属医院塞德曼癌症中心(University Hospital Seidman Cancer Center)等研究机构的研究人员开发出一种新的嵌合抗原受体(CAR)T细胞疗法(CAR-T)用于治疗B细胞癌症,该方法可使癌细胞表面上的靶抗原增加三倍,从而有望极大地减少目前仅靶向CD19的CAR-T细胞疗法(下称CD19 CAR-T)中出现抗原逃逸的可能性。相关研究结果近期发表在Nature Communications期刊上,论文标题为“A BAFF ligand-based CAR-T cell targeting three receptors and multiple B cell cancers”。
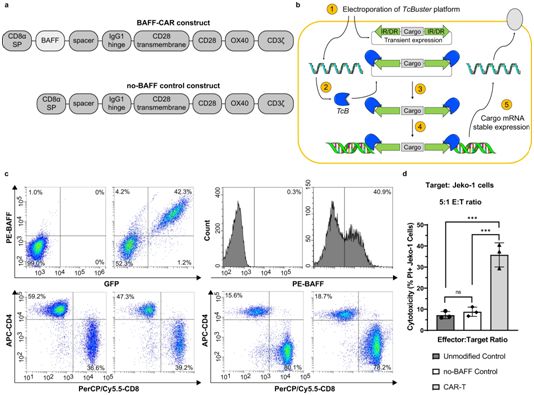
通过不同的表达方法使用BAFF-CAR构建出CAR-T细胞。图片来自Nature Communications, 2022, doi:10.1038/s41467-021-27853-w。
7.Cell Metab:科学家有望给抵御癌症的T细胞进行“超级充电”从而实现清除癌细胞的目标
doi:10.1016/j.cmet.2022.02.009
基于嵌合抗原受体(CAR)T细胞的免疫疗法在治疗癌症和免疫学疾病上取得了长足的进展,但如今研究人员仍然面临着多种障碍。因此找到正确的分子靶点来工程化改造T细胞来实现所需的功能对于开发以T细胞为中心的治疗性手段具有非常重要的意义。近日,一篇发表在国际杂志Cell Metabolism上题为“A genome-scale gain-of-function CRISPR screen in CD8 T cells identifies proline metabolism as a means to enhance CAR-T therapy”的研究报告中,来自耶鲁大学等机构的科学家们通过研究识别出了一种未攻击肿瘤的T细胞“充电”的新方法,这一研究发现不仅能改善一种有前途的基于细胞的癌症免疫疗法的有效性,还能扩展其所治疗的癌症的种类。
这项研究中,研究人员设计了一种巧妙的方法来有效扫描CD8 T细胞的基因组,从而寻找或能增强T细胞攻击癌细胞能力的特殊基因。研究者Chen说道,我们开发了一种新型的全基因组功能增益性筛选技术,旨在寻找到一种特殊分子酶类,其或许能像踩油门一样增加T细胞的代谢活性。
随后研究人员发现了多个基因的高水平活性,包括一种参与细胞代谢的基因PRODH2,其能刺激小鼠模型中的CAR-T细胞活性增加从而被用来研究三种不同类型的癌症,包括实体瘤乳腺癌等,这一研究发现表明,研究人员或许有望开发出能优于当前细胞疗法的超高水平代谢的CAR-T细胞。
8.Cancer Discov:抑制细胞内检查点PTP1B可增强T细胞的抗肿瘤作用
doi:10.1158/2159-8290.CD-21-0694
在一项新的研究中,来自澳大利亚莫纳什大学、墨尔本大学和美国冷泉港实验室的研究人员发现了一种新的免疫检查点:酪氨酸磷酸酶PTP1B,可能被用于癌症治疗。它们表明,通过抑制T细胞中的PTP1B,可以调动身体对癌症的免疫反应,从而有助于抑制肿瘤生长。相关研究结果发表在2022年3月的Cancer Discovery期刊上,论文标题为“PTP1B Is an Intracellular Checkpoint that Limits T-cell and CAR T-cell Antitumor Immunity”。
T细胞是人体免疫系统的一个重要组成部分,不仅有助于杀死入侵的病原体,如病毒,也有助于杀死癌细胞。然而,这项新的研究表明作为一种新的候选药物,浸润肿瘤的T细胞中PTP1B的丰度会增加,从而抑制T细胞攻击肿瘤细胞和对抗癌症的能力。这些发现确定了PTP1B是一种细胞内的免疫检查点。这让人联想到细胞表面上的免疫检查点PD-1,对PD-1的阻断已引发了癌症治疗变革。
在这项新的研究中,这些作者以小鼠为研究对象,发现通过使用一种处于早期开发阶段的可注射候选药物(此前已被证明在人类中安全且耐受性良好)抑制PTP1B,T细胞的抗癌能力得到增强,抑制了肿瘤的生长。值得注意的是,他们指出对这种细胞内检查点(PTP1B)的抑制也能增强对一种广泛使用的阻断T细胞表面上免疫检查点PD-1的癌症疗法的反应。
此外,除了增强对PD-1阻断的反应外,这些作者还发现对PTP1B的抑制也明显增强了使用嵌合抗原受体(CAR)T细胞(CAR-T)的细胞疗法的有效性。
CAR-T细胞的制造方法为提取患者血液的T细胞,在实验室中对它们进行基因改造,使之表达一种帮助它们更好地识别肿瘤细胞的人工受体,然后再将它们注射回相同患者的体内。CAR-T细胞对一些血癌非常有效;然而,这种成功还没有在实体瘤中得到复制。这些作者证实剔除或抑制PTP1B可以极大地提高CAR-T细胞攻击小鼠实体瘤的能力,包括乳腺癌。
9.Science子刊:新突破!向癌细胞发射“糖衣炮弹” 小鼠生存期延长
doi:10.1126/scitranslmed. abg3072
嵌合抗原受体(CAR)T细胞免疫治疗在难治性B细胞恶性肿瘤患者中显示出非凡的成功。然而,首次对实体肿瘤进行的人体研究揭示了导致该疗效不佳的独特障碍。理解CAR-T细胞识别肿瘤的决定因素应该转化为能够克服耐药性的策略的设计。近日,意大利的IRCCS San Raffaele科学研究所在Sci. Transl. Med.发表题为“Disrupting N-glycan expression on tumor cells boosts chimeric antigen receptor T cell efficacy against solid malignancies”的研究,在这项研究中,作者证明了N-聚糖对实体瘤提供多方面的保护,使其免受CAR-T细胞的杀伤。此外,作者提供的证据表明,用葡萄糖/甘露糖类似物 2-脱氧-d-葡萄糖 (2DG) 安全地抑制 N-聚糖合成,恢复了对CAR-T细胞靶向几种实体恶性肿瘤的易感性。

去除MGAT5 N-多糖产物可提高免疫突触质量并改善CAR信号,图片来源: https://pubmed.ncbi.nlm.nih.gov/35044789。
N-葡聚糖屏蔽适用于几种类型的癌症和CAR抗原特异性,不仅揭示了靶标表达的评估不足以推断杀伤力,而且还发现N-葡聚糖是药理干预的一个可操作的靶标。因此,作者观察到N-聚糖表达与CAR T细胞杀伤效力之间存在明显的负相关,证明N-聚糖表达有可能作为筛选可能抵抗CAR T细胞治疗并可能受益于去糖基化策略的患者的预测生物标志物。
综上所述,作者已经证明了细胞外N-聚糖通过提高CAR T细胞激活阈值和促进CAR T细胞耗竭而提供了一种有效的肿瘤抵抗机制。作者的发现指出了CAR - T细胞与2DG联合治疗肿瘤的潜力,以抵消多层肿瘤抵抗,包括肿瘤接触不足和抑制通路的破坏效应。这一认识为实体肿瘤的转化提供了直接的机遇,也为合理设计改进的治疗方法提供了新的方向。
10.Science子刊:科学家成功对T细胞进行改造使其携带两种能寻找癌细胞的受体 有望帮助开发新型个体化抗癌疗法
doi:10.1126/scitranslmed.abh1962
尽管T细胞疗法能给很多癌症患者带来较高的疾病缓解率,但仍然有很多患者会出现疾病复发;据估计,CAR-T细胞疗法给患者带来的持久缓解的成功率为30%-40%,这意味着相当大一些患者或许并不是那么幸运,而为了提高患者接受疗法后的疾病缓解率,全球的科学家们都在寻找新方法,来让CAR-T细胞癌症疗法更加有效地发挥作用。近日,一篇发表在国际杂志Science Translational Medicine上题为“Combining a CAR and a chimeric costimulatory receptor enhances T cell sensitivity to low antigen density and promotes persistence”的研究报告中,来自阿姆斯特丹自由大学等机构的科学家们通过研究给T细胞人工赋予了两个能寻找癌症的受体,旨在使其成为癌症杀手精英,这或有望帮助开发治疗癌症的新型疗法。
这篇研究报告中,研究人员给予T细胞吸附上了两个工程化受体,他们旨在解决CAR-T细胞癌症疗法中所面临的最大的问题,即该疗法并不适合每个人,研究者认为,有相当一部分癌症患者的疾病会反复,而这种双受体策略或许就能增加这种形式免疫疗法的有效性并降低疗法的失败率。研究者认为,“挥舞”着两种受体的T细胞能使得CAR-T细胞的抗癌能力翻倍,而使用这种双重策略还能额外增强血液中CAR-T细胞的持久性,因此,科学家们希望这种新型CAR-T细胞能够追踪经常躲避单受体CAR-T细胞的隐蔽恶性细胞,拥有这两种受体或许能够减少癌细胞播种的可能性,从而就能进一步降低癌症患者的发病率。
能提供组合性激活和共刺激信号的第二代CARs或能诱发令人印象深刻的临床反应;研究者Katsarou及其同事在实验室培养皿和动物模型中测试了这种双受体T细胞,通过对这些细胞的表现分析,研究者发现,这种类型的修饰或许能够解决CAR-T细胞寿命短和低抗原密度无效的双重挑战,这或许就能使得改变后的细胞对很多患者不起作用,这一研究的关键在于向T细胞中引入了两类受体,一种是传统的前和抗原受体,另外一种则是嵌合共刺激受体(CCR, chimeric costimulatory receptor)。
与传统的CAR-T细胞相比,这种CAR-CCR T细胞组合对培养液中的低抗原多发性骨髓瘤和白血病细胞会更加敏感,新型双重受体T细胞还能在多发性骨髓瘤和低抗原白血病中不断扩大并持续更长时间,这同时也延长了患者的生存时间并推迟了其癌症的进展。这种新型疗法是针对患者的个体化癌症疗法,因为患者自身的细胞就是关键组分;临床医生会将癌症患者的血液样本送到药物制造商的实验室中,在那里T细胞就能被修饰来识别癌症靶点CD19。
11.Nat Biotechnol:科学家发现治疗白血病的新型免疫疗法
doi:10.1038/s41587-021-01089-x
与嵌合抗原受体不同的是,T细胞受体(TCRs)能够识别人类白细胞抗原(HLA)分子上呈递的细胞内靶点;近日,一篇发表在国际杂志Nature Biotechnology上题为“T cells targeted to TdT kill leukemic lymphoblasts while sparing normal lymphocytes”的研究报告中,来自瑞典卡罗琳学院等机构的科学家们通过研究开发了一种治疗白血病的新型疗法,研究者表示,这种疗法或能杀灭急性淋巴细胞白血病(CLL)患者机体的癌细胞,同时研究人员还想进行一项临床研究测试这种新型疗法治疗其它类型癌症的可行性。
如今科学家们发现了另一种重编程T细胞的方法,以便T细胞能结合到癌细胞而并非细胞表面所表达的一种靶点上,这种新型免疫来哦发重点关注名为TdT(末端脱氧核苷酰转移酶,terminal deoxynucleotidyl transferase)的酶类,其在T细胞和B细胞白血病中都会表达,但只是在健康T细胞和B细胞的早期发育过程中会瞬间表达,这就意味着该疗法可能在消除B细胞和T细胞白血病细胞的同时还会保留健康的T细胞和B细胞。
迄今为止,研究者所开发的新方法已经在B细胞白血病小鼠和两种细胞类型的急性淋巴细胞白血病患者的细胞样本中进行了测试;测试结果表明,装备有TdT特异性受体的遗传修饰后的T细胞能寻找并消除分布在B细胞白血病小鼠不同器官和来自B细胞和T细胞白血病患者机体细胞样本中的白血病细胞,同时研究者还在移植了来自患者白血病细胞的小鼠机体中测试了该方法的有效性和安全性。研究者Petter S. Woll补充道,我们还发现了健康B细胞和T细胞对新血细胞发展并没有负面影响,这就表明这种疗法或许是安全的。
12.Nature子刊:在临床研究中CAR-T细胞或能有效抑制胃肠道实体瘤同时还不会对健康组织产生毒性效应
doi:10.1038/s43018-022-00344-7
嵌合抗原受体(CAR)T细胞在治疗白血病和淋巴瘤方面非常有效,但对于神经内分泌肿瘤(NETs)和胃肠道癌症(GICs)目前并没有成功的免疫疗法,近日,一篇发表在国际杂志Nature Cancer上题为“Potent suppression of neuroendocrine tumors and gastrointestinal cancers by CDH17CAR T cells without toxicity to normal tissues”的研究报告中,来自宾夕法尼亚大学医学院等机构的科学家们通过研究发现,针对肿瘤抗原CDH17的CAR-T细胞或能在多个临床前模型中消除GICs,同时还不会对多个小鼠器官(包括小肠和结肠)和正常组织产生毒性作用,CDH17是在NETs和GICs中所表达的细胞表面标志物,同时其还会在健康组织中表达。

CDH17 CARTs会攻击肿瘤但却并不会损伤机体的正常组织。图片来源:Penn Medicine。
研究者Xianxin Hua博士说道,本文研究结果阐明,CDH17 CAR-T细胞或能消除诸如NETs和GICs等实体瘤,但却并不会损伤能表达CDH17的健康正常组织,因为CDH17会被屏蔽并在正常细胞之间被隐藏;这或许就为深入研究在正常细胞中表达但在CAR-T细胞攻击下被保护的肿瘤抗原提供了新的思路,同时这也是开发治疗实体瘤的安全免疫疗法的重要步骤。(生物谷 Bioon.com) 相关新闻:
CAR-T细胞疗法最新研究进展(第26期)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


