盘点:关爱罕见病:2020年1月和2月美国FDA批准的孤儿药适应症!
来源:本站原创 2020-02-29 23:59
2020年02月29日讯 /生物谷BIOON/ --孤儿药(Ophan Drug)是指用于诊断、治疗和预防罕见病的药品,而罕见病是一类发病率极低的疾病的总称,又被称为“孤儿病”。根据世界卫生组织(WHO)的定义,患病人数占总人口0.65‰~1‰的疾病即可被定义为罕见病。不过,世界各国根据自己国家的具体情况,对罕见病的认定标准存在一定差异。目前,国际上已经明确

2020年02月29日讯 /生物谷BIOON/ --孤儿药(Ophan Drug)是指用于诊断、治疗和预防罕见病的药品,而罕见病是一类发病率极低的疾病的总称,又被称为“孤儿病”。根据世界卫生组织(WHO)的定义,患病人数占总人口0.65‰~1‰的疾病即可被定义为罕见病。不过,世界各国根据自己国家的具体情况,对罕见病的认定标准存在一定差异。
目前,国际上已经明确的罕见病超过7000种,虽然每种罕见病的患病人数较少,但整个罕见病患者群体却十分庞大,全球预计有超过3亿名罕见病患者,中国有超过1680万罕见病患者。然而,与之形成鲜明对比的是,全球已上市的孤儿药只有600多种。
孤儿药具有研发难度大、成本高、目标市场小、获利能力差等特征,因此最初很多药企并不愿涉足该领域。美国最早于1983年1月4日颁布《孤儿药法案》(ODA),之后又推出了孤儿药审评的特殊待遇,再加上临床研究和测试费用享受50%税收抵免、处方药用户收费减免以及药物获准后享有7年市场独占期等一系列支持政策,使得孤儿药的社会认知度不断提高,制药企业对孤儿药的开发热情也持续升温。近些年来,很多跨国制药巨头都纷纷加入了孤儿药研发行列,并已收获了重磅回报。
目前,孤儿药已成为医药行业最盈利的板块之一。根据医药市场调研机构Evaluate Pharma发布的《2019-2024年孤儿药报告》,科学的进步将助推孤儿药市场在未来6年(2019-2024)快速增长。报告指出,2018年全球孤儿药市场为1310亿美元,在未来6年(2019-2024),该市场将以12.3%的年度复合增长率快速增长,增速是同时期非孤儿药市场增速(6%)的2倍,到2024年达到2420亿美元(约合人民币16297.49亿元),其在处方药市场中的占比将首次突破20%,达到20.3%。
在孤儿药开发激励和审批方面,美国始终走在世界最前列。根据FDA孤儿药产品开发办公室(OOPD)公共数据库,自1983年《孤儿药法案》(ODA)实施以来,FDA授予的孤儿药资格数量和批准的孤儿药适应症数量逐年递增。截至2020年2月29日,FDA已授予5276个孤儿药资格,批准853个孤儿药适应症。其中,2020年1月和2月,FDA已授予51个孤儿药资格、批准5个孤儿药适应症。
特别值得一提的是,总共5276个孤儿药资格中,只有68个授予了来自中国制药公司的药物(包括中国大陆、香港、澳门、台湾),这68个孤儿药资格中,主要集中在最近5年(2016-2020年,共50个),2016年、2017年、2018年、2019年、2020年分别为7、7、14、15、7个,数字的逐年递增从侧面反映了中国药企的国际化步伐正在加快。另外值得注意的是,总共853个孤儿药适应症中,授予中国制药公司的数量为1。
2018年5月22日,国家卫生健康委员会、科技部、工信部、国家药监局、国家中医药管理局等五部委联合制定的《第一批罕见病目录》正式发布,共收录121种疾病。其中,仅40多个病种有相关药物在全球上市,在中国上市的不到一半。随着中国药品审评审批制度的改革,未来国外已上市孤儿药将会加快进入中国市场。
以下是生物谷医药版块小编根据OOPD公共数据库对2020年1月和20月(截止2月29日)美国FDA批准的5个孤儿药适应症的信息汇总,希望相关药物能尽快在中国上市,造福国内的罕见病患者群体。
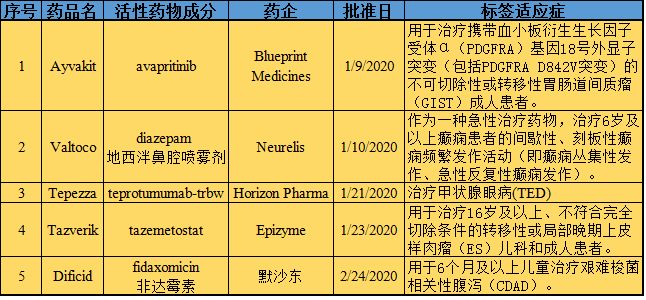
1月9日,FDA批准Blueprint Medicines公司靶向抗癌药Ayvakit(avapritinib),用于治疗携带血小板衍生生长因子受体α(PDGFRA)基因18号外显子突变(包括PDGFRA D842V突变)的不可切除性或转移性胃肠道间质瘤(GIST)成人患者。值得一提的是,Ayvakit是第一个被批准用于GIST的精准疗法,也是唯一一个对PDGFRA基因18号外显子突变型GIST具有高活性的药物。基石药业用于Ayvakit在大中华区的开发与商业化权利。
临床数据显示,在PDGFRA基因18号外显子突变的GIST患者中,Ayvakit治疗的总缓解率(ORR)高达86%(95%CI:69%,93%),且中位缓解持续时间(DOR)尚未达到。GIST是一种罕见的由基因组驱动的胃肠道肉瘤。约6%的新诊断GIST患者具有PDGFRA外显子18突变。最常见的PDGFRA外显子18突变是D842V突变,它对所有其他已批准的疗法都是耐药的。
Ayvakit的活性药物成分为avapritinib,可选择性和强效地抑制KIT和PDGFRA突变激酶。该药是一种I型抑制剂,旨在靶向活性激酶构象;所有致癌激酶都通过这种构象进行信号传导。avapritinib已被证实对胃肠道间质瘤(GIST)相关的KIT和PDGFRA突变具有广泛的抑制作用,包括针对与当前批准疗法耐药相关的激活loop突变的强劲活性。与已批准的多激酶抑制剂相比,avapritinib对KIT和PDGFRA的选择性明显高于其他激酶。
1月10日,FDA批准Neurelis公司药物Valtoco(地西泮鼻腔喷雾剂),作为一种急性治疗药物,治疗6岁及以上癫痫患者的间歇性、刻板性癫痫频繁发作活动(即癫痫丛集性发作、急性反复性癫痫发作),这种发作不同于患者通常的癫痫发作模式。Valtoco的独特配方融入了Intravail技术,可实现始终如一的可靠吸收,已被证明具有普遍的安全性和良好的耐受性。
值得一提的是,Valtoco是FDA批准用于6岁及以上癫痫患者用作急性治疗药物的第一种鼻腔喷雾剂。Valtoco还被FDA孤儿产品开发办公室授予了为期7年的孤儿药专营权。直到最近,在医疗机构之外的批准方案只能作为直肠给药。因此,FDA批准Valtoco鼻腔喷雾剂,对癫痫社区来说是一个重大的进步。
Valtoco是一种专利配方的diazepam(地西泮),融入了一种基于维生素E的溶液和Intravail®吸收增强技术的独特组合。之前,FDA已授予Valtoco孤儿药地位和快速通道地位。Intravail®经粘膜吸收增强技术可以无创性地输送多种蛋白质、肽和小分子药物。
据估计,在美国大约有340多万癫痫患者,每年大约确诊20万新病例。尽管有慢性的每日口服药物控制癫痫,但仍有相当一部分的患者继续经历癫痫发作。在这些不受控的患者中,约有17万的患者有频繁发作的风险,也被称为丛集性或急性反复癫痫发作,这类发作在癫痫患者的生活中既危险又极具破坏性。Valtoco将为这类患者提供一种安全可靠、耐受性良好、简单即用的鼻腔喷雾剂,可使照料者在任何时间、任何地点可靠地治疗癫痫发作,这是一个重大进步。Valtoco的上市,将会对成千上万的经历丛集性或急性反复性癫痫发作的癫痫患者及其护理伙伴的生活产生积极影响。
1月21日,FDA批准Horizon Pharma公司单抗药物Tepezza(teprotumumab-trbw),用于治疗甲状腺眼病(TED)。值得一提的是,Tepezza是FDA批准的第一种也是唯一一种治疗TED的药物。
TED是一种严重的、进行性的、威胁视力的罕见自身免疫性疾病,与突眼(眼球膨出)、复视、视力模糊、疼痛、炎症和面部缺陷相关。Tepezza是一种全人单克隆抗体和胰岛素样生长因子-1受体(IGF-1R)靶向制剂,每三周注射一次,共注射8次。
在III期OPTIC研究中,与安慰剂组相比,teprotumumab治疗组患者眼球突出或鼓胀表现出显著改善,达到了主要终点:teprotumumab治疗组有82.9%的患者达到眼球突出或鼓胀减少2mm或更多的主要终点,而安慰剂组仅为9.5%,数据具有统计学显著差异(p<0.001)。眼球突出(proptosis)是TED患者发病的主要原因。此外,该研究也达到了全部次要终点,包括复视减少、生活质量改善、临床活动评分降低。该研究中,teprotumumab的耐受性良好,大多数不良事件是轻度或中度,在治疗期间或治疗后可以控制和解决。来自II期研究的数据显示,teprotumumab治疗使眼球突出和活动性TED症状(疼痛、肿胀、红肿、炎症)取得临床意义和高度统计学意义的减少。
1月23日,FDA批准Epizyme公司表观遗传学药物Tazverik(tazemetostat),用于治疗16岁及以上、不符合完全切除条件的转移性或局部晚期上皮样肉瘤(ES)儿科和成人患者。值得一提的是,Tazverik是获美国FDA批准的第一个也是唯一一个EZH2抑制剂,也是该机构批准专门针对ES患者的第一个也是唯一一个疗法。
Tazverik的活性药物成分tazemetostat是一种口服、强效、首创(first-in-class)、EZH2抑制剂。EZH2是一种组蛋白甲基转移酶,如被异常激活,将导致控制细胞增殖的基因失调,从而可引起非霍奇金淋巴瘤(NHL)及其他多种实体瘤细胞的无限制迅速生长。tazemetostat可通过抑制EZH2酶活性而发挥抗肿瘤作用。在临床研究中,tazemetostat在治疗早期就表现出了安全有效地缩小甚至消除肿瘤的能力。
目前,Tazverik还有一份新药申请(NDA)正在接受FDA的优先审查,用于治疗先前已接受过至少2种系统疗法的复发或难治性滤泡性淋巴瘤(R/R FL)患者。II期研究数据显示,在EZH2突变FL患者、野生型EZH2 FL患者中,Tazverik治疗的总缓解率(ORR)分别为69%、35%。当前,滤泡性淋巴瘤(FL)仍然是一种毁灭性的不治之症。如果获批准,Tazverik将为携带或不携带EZH2激活突变的FL患者群体带来一种新的治疗选择。
1月24日,FDA批准默沙东(Merck & Co)公司Daficid(fidaxomicin,非达霉素)口服混悬剂以及Dificid片剂,用于6个月及以上儿童治疗艰难梭菌相关性腹泻(CDAD)。在2010年,Dificid被授予了儿科适应症的孤儿药资格。
艰难梭菌(C.diffi,CD)是美国医院最常见的健康相关感染的原因之一。最近的估计表明,CD在美国每年导致近50万人感染,并与最初诊断后30天内约2.9万人的死亡相关。根据美国疾病控制和预防中心(CDC)发布的《2019年美国抗生素耐药性威胁(Antibiotic Resistance Threats in the United States, 2019)》报告,CD被归类为紧急威胁,并被列为需要紧急和积极行动的公共健康威胁。
Dificid是一种大环内脂类抗生素,具有一种新的作用机制和一个选择性抗菌谱,该药主要是通过抑制细菌的RNA聚合酶而产生迅速的抗难治梭状芽孢杆菌感染(CDI)作用。Dificid适用于6个月及以上儿童和成人治疗艰难梭菌相关性腹泻(CDAD)。
为减少耐药菌的形成以及维持Dificid和其他抗菌药物的有效性,Dificid应仅用于治疗已被证实或强烈怀疑由艰难梭菌引起的感染。Dificid禁用于对fidaxomicin(非达霉素)或Dificid中任何其他成分过敏的患者。Dificid应仅用于治疗艰难梭菌相关性腹泻(CDAD)。由于fidaxomicin的系统性吸收很少,Dificid不能有效治疗其他类型的感染。(生物谷Bioon.com)
原文出处:美国FDA孤儿药公共数据库、生物谷
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


