2020年Q4十余款新药有望获批上市
美国著名医疗健康资讯网站Xconomy近日发表文章指出,预计在年底前,将有一批新产品获得监管批准进入市场,包括赛诺菲、辉瑞、百时美施贵宝的新药项目,这些药物上市后,将开辟新的商业领域或动摇各自的治疗领域。以下是文章盘点的《2020年第四季度最值得关注的12个新药监管审批》。其中一个药物Inmazeb已提前于10月15日获得美国FDA批准,该药是再
荣昌生物招股获热捧 两款创新药物上市在即
10月28日,已通过港交所聆讯的荣昌生物制药(烟台)股份有限公司(以下简称“荣昌生物”)启动公开招股,拟全球发行7653.7万股H股,发行价区间为50.30至52.10港元,股票代码为9995.HK。荣昌生物公开招股第一天,获得热烈追捧,显示了专业投资机构对这家创新生物药公司发展前景的强劲信心。荣昌生物渊源于内地知名药企荣昌制药,联手国家知名生物药物专家、同
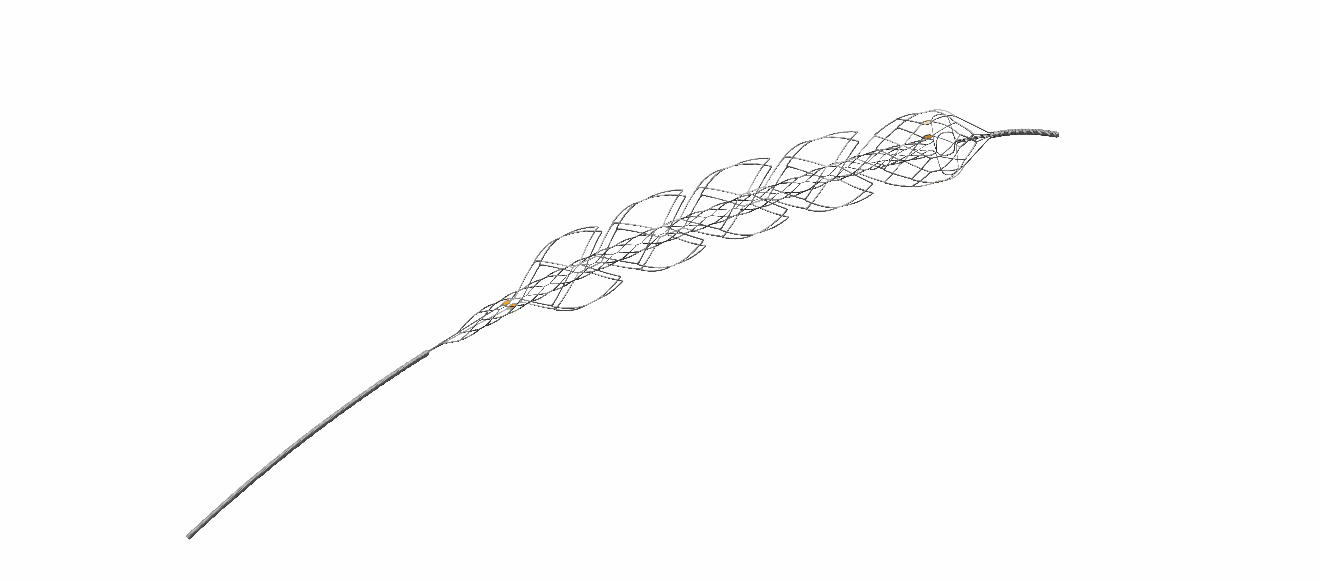
强生医疗宣布急性缺血性脑卒中机械取栓创新产品上市
适逢第15个世界卒中日,强生(上海)医疗器材有限公司于今日宣布旗下急性缺血性脑卒中机械取栓创新产品——远端闭合双层网篮取栓器(EmboTrap II)正式上市。该产品提高了不同类型血栓的一把再通率[ Clinical Trial Registration—URL: http://www.clinicaltrials.gov. Unique identifie
嘉和生物提交英夫利昔单抗生物类似药上市申请
10月27日,嘉和生物宣布已向中国国家药品监督管理局(NMPA)提交英夫利昔单抗生物类似药GB242的上市申请,这也是继PD-1抗体杰诺单抗后嘉和生物提交的第二个上市申请。查询NMPA官网信息,除了强生(Johnson & Johnson)公司的原研药类克(英夫利西单抗)外,目前中国尚无英夫利西单抗生物类似药获批上市。英夫利西单抗是一种抗
CDE发布《境外已上市境内未上市药品临床技术要求》
境外已上市药品境内上市或仿制,是解决我国患者对临床迫切需求领域药品的可获得性和可及性的重要手段。为加快此类药品研发上市进程,加强科学监管,依据《药品注册管理办法》(总局令第27号)及其配套文件,药审中心组织制定了《境外已上市境内未上市药品临床技术要求》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020
预防性免疫治疗单抗teplizumab将2021年上市:疾病风险降低50%,发病推迟≥2年
teplizumab将成为第一种可预防/延缓高危人群发展为临床1型糖尿病(T1D)的疗法。