TB联盟与复星医药达成合作,在中国商业化高度耐药结核新疗法pretomanid!
2020年01月21日讯 /生物谷BIOON/ --近日,非盈利药物研发组织TB Alliance(结核病联盟)授予上海复星医药(集团)股份有限公司(以下简称“复星医药”)全资子公司沈阳红旗制药有限公司(以下简称“红旗制药”)在中华人民共和国境内销售结核病药物pretomanid的许可。该药与贝达喹啉(bedaquilin)和利奈唑胺 (linezolid)
FDA批准创新抗生素pretomanid上市 治疗高度耐药肺结核
美国FDA宣布,批准由非盈利组织全球结核病药物开发联盟(TB Alliance)开发的pretomanid上市,与贝达喹啉(bedaquiline)和利奈唑胺(linezolid)联用,治疗特定高度耐药肺结核(TB)患者。这是近40年来FDA批准的第三款抗肺结核新药,也是第一款由非盈利组织开发并且上市的肺结核新药。由于细菌耐药性的不断增加,多药耐药TB(multidrug-resist
美国FDA批准40多年来第三款抗结核新药pretomanid
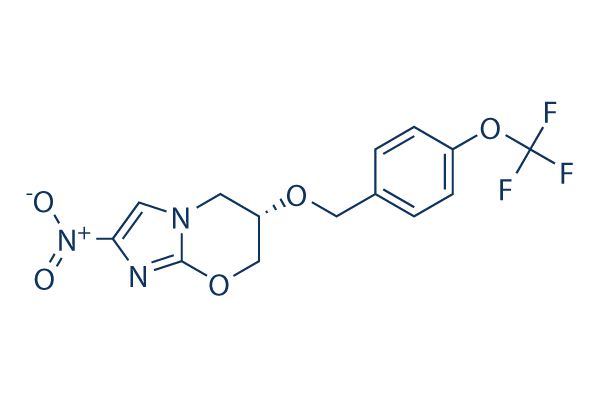
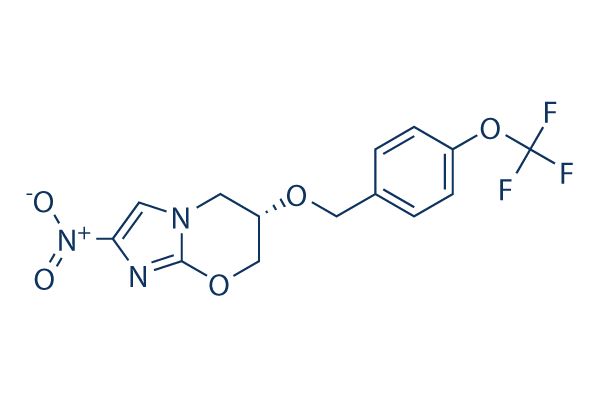
2019年08月20日讯 /生物谷BIOON/ --非盈利组织TB Alliance(结核病联盟)近日宣布,美国食品和药物管理局(FDA)已批准新型化合物pretomanid,作为三药、六个月全口服方案BPaL(由贝达喹啉、pretomanid、利奈唑胺组成)的一部分,用于药物不耐受或无应答的广泛耐药结核病(XDR-TB)或耐多药结核病(MDR-TB)患者(统称为“高度耐药结核病”)的治疗。值得一
TB联盟口服新药pretomanid获美国FDA专家委员会推荐批准
2019年06月10日讯 /生物谷BIOON/ --非盈利药物开发商TB Alliance(结核病联盟)近日宣布,美国食品和药物管理局(FDA)抗菌药物咨询委员会已投票表决(14票赞成,4票反对,0票弃权),认为有大量证据表明,pretomanid作为与贝达喹啉(bedaquiline)和利奈唑胺(linezolid)联合治疗方案的一部分,用于治疗广泛耐药(XDR)或药物不耐受或无反应性多药耐药(