信达生物新型LAG-3/PD-L1双抗获批临床
今日,中国国家药监局药品审评中心(CDE)最新公示,信达生物申报的1类生物新药IBI323获得临床试验默示许可,拟开发用于治疗晚期恶性肿瘤。根据公开资料,IBI323是一款新型LAG-3/PD-L1双特异性抗体,具有成为“first-in-class”新药的潜力。双特异性抗体疗法是利用患者免疫系统中的T细胞杀伤肿瘤的另一种方法。不同于单抗药的单一靶向性,双特
基石药业宣布PD-L1抗体获FDA孤儿药资格
10月19日,基石药业宣布,美国FDA授予其PD-L1抗体舒格利单抗(CS1001)孤儿药资格,用于治疗T细胞淋巴瘤。这是继今年7月美国FDA授予其抗PD-1单抗CS1003用于治疗肝细胞癌的孤儿药资格后,基石药业免疫疗法产品线获得FDA授予的第二个孤儿药资格。值得一提的是,基石药业还计划近期向中国国家药品监督管理局(NMPA)递交舒格利单抗治疗
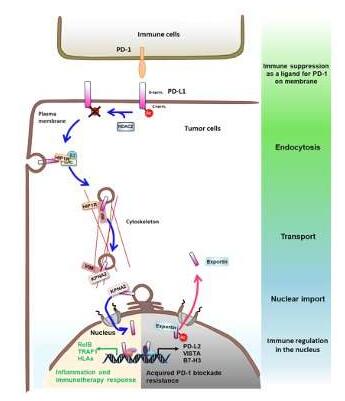
Nat Cell Biol:如何增强抗PD-L1癌症免疫疗法的治疗效率?
2020年10月6日 讯 /生物谷BIOON/ --对于大多数人而言,没有什么比患癌更可怕的了,包括化疗和放疗等疗法分别开始在20世纪40年代和19世纪晚期时候开始使用,而免疫疗法作为一种可行且成功的治疗手段近些年来才开始使用,的确,躲避宿主免疫系统是肿瘤发生的一个基本特征,而阐明癌细胞如何做到这一点,以及如何促进患者机体自身的免疫系统来消灭癌细胞或许就显得
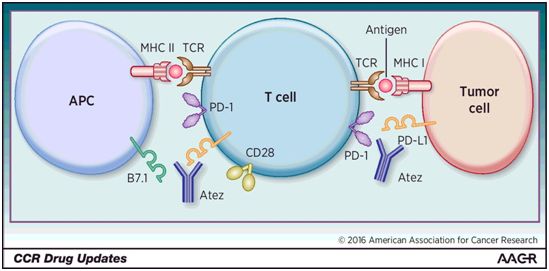
NEJM:III期临床试验表明阿特朱单抗可显著延长表达PD-L1的非小细胞肺癌患者的生存期
2020年10月6日讯/生物谷BIOON/---根据一项新的临床试验,对表达PD-L1的非小细胞肺癌(NSCLC)患者而言,阿特朱单抗(atezolizumab)治疗可导致比化疗更长的总生存期。相关研究结果发表在2020年10月1日的NEJM期刊上,论文标题为“Atezolizumab for First-Line Treatment of PD-L1–Se
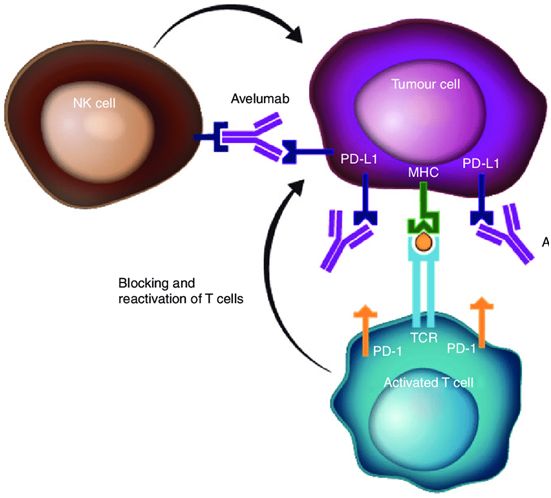
NEJM:III期临床试验表明抗PD-L1抗体avelumab可显著提高晚期尿路上皮癌患者的生存率,死亡风险下降31%
2020年10月5日讯/生物谷BIOON/---根据英国伦敦大学玛丽女王学院和巴茨癌症中心领导的一项III期临床试验,一种名为“avelumab”的免疫治疗药物被证明可以显著提高患上最常见类型膀胱癌(即尿路上皮癌)的患者的生存率。这是免疫疗法首次在膀胱癌患者中带来生存优势,每年将有可能使成千上万的患者受益。相关研究结果发表在2020年9月24日的NEJM
2020 CSCO:基石药业公布抗PD-L1单抗舒格利单抗两项重要研究数据
2020年9月24日,基石药业(苏州)有限公司(以下简称“基石药业”,香港联交所代码:2616)在2020年中国临床肿瘤协会(CSCO)学术年会上公布了抗PD-L1单抗舒格利单抗(CS1001)的两项重要研究数据,分别为舒格利单抗单药治疗复发或难治性结外自然杀伤细胞/T细胞淋巴瘤(CS1001-201研究)和舒格利单抗联合化疗治疗胃腺癌或胃食管交界处腺癌(C
数款PD-1/PD-L1可皮下注射 疗效不输静脉注射
免疫治疗,特别是PD-1/PD-L1抗体近年来已成为抗肿瘤治疗热点中的热点,目前已上市的PD-1/PD-L1抗体已被批准用于治疗多种肿瘤,但全部都是静脉注射给药,也就是打点滴的方式给药。静脉使用免疫药物存在很多临床风险,可能会导致体温迅速下降、血液中的电解质失衡,更有可能形成血栓等。因此静脉注射必须在医疗机构专业护士的帮助下接受治疗。患者需要每次去医院输液,
靶向PD-1和LAG-3!岸迈生物双免疫检查点抑制剂在美获批临床
今日,岸迈生物宣布,其EMB-02的新药临床申请(IND)得到了美国食品药品监督管理局(FDA)“临床研究可以启动”的确认信函。根据新闻稿,EMB-02同时靶向免疫检查点蛋白PD-1和LAG-3,它是岸迈生物第二个自主开发的针对实体瘤治疗的新型双特异性抗体候选药物。到2021年,岸迈生物将会有三个双抗项目处在全球临床开发阶段。EMB-02是基于岸
罗氏PD-L1抑制剂在华斩获针对非小细胞肺癌等4项临床批准
今日,根据CDE官网最新公示,罗氏(Roche)旗下PD-L1抑制剂Tecentriq(atezolizumab,阿替利珠单抗)再次获批4项临床。据悉,本次获批拟开发适应症为:阿替利珠单抗联合tiragolumab,用于含铂方案放化疗后未进展的局部晚期、不可切除的III期非小细胞肺癌患者;阿替利珠单抗联合贝伐珠单抗,用于不可切除的肝细胞癌患者经导