Nature子刊:清华大学江鹏团队揭示巨噬细胞代谢重编程提高抗病毒免疫能力
来源:生物世界 2025-04-20 16:31
研究团队发现,病毒感染引发的炎症刺激会导致巨噬细胞中的尿素循环和三羧酸循环代谢发生协同重编程,从而形成一个被称为天冬氨酸–精氨基代琥珀酸旁路的闭环代谢通路。
清华大学江鹏团队在 Nature Microbiology 期刊发表了题为:Metabolic remodelling produces fumarate via the aspartate–argininosuccinate shunt in macrophages as an antiviral defence 的研究论文。

巨噬细胞在应对各种刺激时发挥效应功能的基础是代谢重塑,但其中涉及的机制尚不清楚。
在这项最新研究中,研究团队发现,病毒感染引发的炎症刺激会导致巨噬细胞中的尿素循环和三羧酸循环代谢发生协同重编程,从而形成一个被称为天冬氨酸–精氨基代琥珀酸(Aspartate–Argininosuccinate,AAS)旁路的闭环代谢通路。
通过 RNA 测序、无偏代谢组学和稳定同位素示踪,研究团队发现,该旁路由胞质中的精氨基代琥珀酸合成酶(ASS1)驱动,进而促进延胡索酸(fumarate)生成,并增强炎症信号传导。进一步功能实验表明,敲除 ASS1 会显著降低细胞内延胡索酸水平,抑制干扰素-β(IFN-β)的表达,并削弱线粒体呼吸功能。
值得注意的是,病毒感染或外源性补充延胡索酸酯可通过促进线粒体抗病毒信号蛋白(MAVS)琥珀酸化,激活视黄酸诱导基因-I样受体(RIG-I-like receptor)信号通路,从而增强 IFN-β 的生成。除了水疱性口炎病毒(VSV)外,仙台病毒和甲型流感病毒也能产生这些作用。此外,感染埃博拉病毒的患者体内 ASS1 表达增加,而 ASS1 缺陷型小鼠在感染水疱性口炎病毒时,其巨噬细胞的干扰素反应受到抑制。
总的来说,该研究揭示了早期病毒感染诱导的由 ASS1 驱动的 AAS 旁路是巨噬细胞中延胡索酸的重要来源,明确了其在调控抗病毒先天免疫中的关键作用,为代谢干预调节免疫功能提供了潜在靶点。
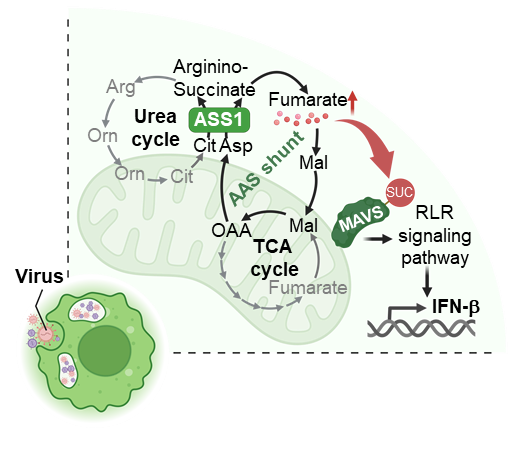
病毒感染诱导的代谢重编程合成延胡索酸提高抗病毒天然免疫反应
清华大学生命学院博士后夏文君、毛优翔和2023级博士研究生夏子言为论文共同第一作者,江鹏副教授为通讯作者。此外,该研究还得到了王海峰副教授(清华大学)、程功教授(清华大学)、张从刚副教授(清华大学)、游富平研究员(北京大学)的大力支持。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


