Small:国家纳米科学中心基于天然纳米材料构建个性化多功能肿瘤原位疫苗
来源:生物世界 2022-04-24 14:03
该研究开发的具有抗原捕获和免疫调节功能的基于OMV的原位疫苗为局部治疗和免疫治疗的结合提供了一种有前景的策略。
通过物理方法(如光热治疗、放射治疗、冷冻消融、射频消融等)将肿瘤组织破坏后,肿瘤细胞会释放肿瘤抗原,激活特异性免疫反应,对消除残留病灶和肿瘤转移至关重要。但是免疫系统和免疫抑制微环境对释放的肿瘤抗原识别效率有限,导致抗肿瘤免疫无效。那么如何才能提高肿瘤抗原的识别效率呢?原位疫苗(in situ vaccines)的概念应运而生。
肿瘤疫苗已经成为人类抗击癌症的热门领域。理想的肿瘤疫苗可以将抗原和佐剂共同传递给抗原递呈细胞(如树突状细胞),诱导特异性免疫反应杀伤肿瘤细胞。原位疫苗联合佐剂加强树突状细胞的抗原递呈,促进机体产生肿瘤特异性T细胞,从而诱发系统性抗肿瘤免疫应答。因此,如何将疫苗抗原高效地呈递给免疫系统成为疫苗研发的关键。
针对以上肿瘤疫苗研究关键问题,国家纳米科学中心的赵潇研究团队在Wiley旗下的纳米材料领域旗舰期刊 Small(IF=13.281)发表了题为:Antigen Capture and Immune Modulation by Bacterial Outer Membrane Vesicles as In Situ Vaccine for Cancer Immunotherapy Post-Photothermal Therapy 的研究论文,开发了一种基于细菌外膜囊泡的原位多功能疫苗——1-MT@OMV-Mal。

该疫苗体系不仅能增强抗原的识别和处理效率,还能实现免疫抑制微环境的重新激活,可增强光热疗法(PTT)后免疫介导的肿瘤清除,为个性化肿瘤疫苗发展提供新的技术支撑。
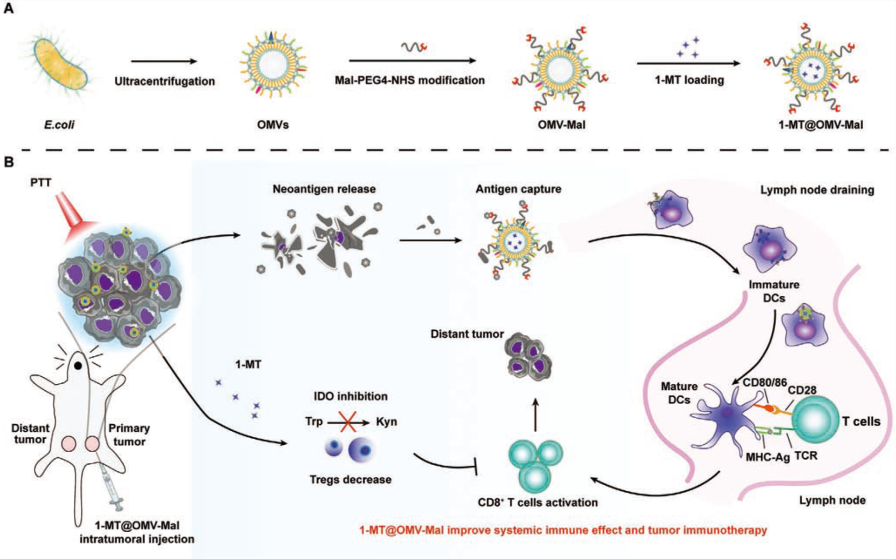
疫苗设计思路及PTT后作用机制
鉴于光热疗法(PTT)消融后抗原释放需要时间,研究团队采用两步治疗策略改善PTT后的协同免疫治疗。首先用马来酰亚胺基团(Mal)修饰天然细菌外膜囊泡(OMV)表面,使其能够结合蛋白质。PTT后,局部注射OMV-Mal可以捕获大量肿瘤释放的蛋白质,包括肿瘤抗原,并改善DC对肿瘤抗原的摄取,有助于抗原呈递到T细胞和抗肿瘤免疫反应。其次将1-MT(吲哚胺2,3-双加氧酶IDO抑制剂)加载到疫苗中,同时克服IDO对肿瘤浸润效应T细胞的免疫抑制,对原发性和转移肿瘤有显著抑制作用,可促进肿瘤的免疫清除。
总的来说,该研究开发的具有抗原捕获和免疫调节功能的基于OMV的原位疫苗为局部治疗和免疫治疗的结合提供了一种有前景的策略。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


