2023年HIV研究进展第3期
来源:生物谷原创 2023-08-30 11:47
人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发
人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
生物谷小编梳理了一下近期生物谷报道的HIV研究方面的新闻,供大家阅读。
1.Nat Biotechnol:肠道微生物组可增加HIV和EBV的感染风险和疾病严重程度
doi:10.1038/s41587-023-01906-5
在过去的十年中,肠道微生物组引起了人们的极大兴趣。近期的研究已表明,肠道中的细菌和其他微生物在免疫、新陈代谢、消化以及抵御试图入侵我们身体的“坏细菌”方面发挥着辅助作用。然而,在一项新的研究中,来自美国北卡罗来纳大学医学院的Angela Wahl博士、Balfour Sartor博士和J. Victor Garcia博士及其同事们肠道微生物组可能并不总是抵御人类病原体。他们首次使用了一种没有肠道微生物组(无菌)的精密动物模型,结果表明肠道微生物组对爱泼斯坦-巴尔病毒(Epstein-Barr virus, EBV)和人类免疫缺陷病毒1型(HIV)感染有重大影响,并在疾病过程中发挥作用。相关研究结果于2023年8月10日在线发表在Nature Biotechnology期刊上,论文标题为“A germ-free humanized mouse model shows the contribution of resident microbiota to human-specific pathogen infection”。
Wahl说,“这些发现首次提供了直接证据,表明常驻肠道菌群对两种不同的人类特异性病原体感染的建立和病理过程有重大影响。”

CV-BLT小鼠粪便细菌微生物组。图片来自Nature Biotechnology, 2023, doi:10.1038/s41587-023-01906-5。
为了实现这一发现,Wahl和Garcia需要创建一种模拟人类免疫系统的“人源化(humanized)”的小鼠模型来进行他们的研究。一旦暴露于病毒中,这种人源化模型就能像人类一样复制病毒,并可用于研究。但是他们需要更进一步。Wahl和Garcia需要将传统的人源化小鼠模型与没有肠道微生物组(无菌)的小鼠模型进行比较。这就意味着,他们需要在世界上首次构建一种人源化、无菌的小鼠模型。
2.Nat Commun:科学家揭示HIV-1感染和机体神经变性之间的神秘关联
doi:10.1038/s41467-023-40000-x
巨噬细胞和小胶质细胞中HIV-1的复制往往涉及在细胞内组装并出芽形成修饰后的多泡体 (MVBs,multivesicular bodies)亚群,其能支持病毒的持续存在和扩散;然而,目前研究人员对调节HIV-1囊泡复制背后的细胞因子知之甚少,最近,研究人员识别出淀粉样前体蛋白(APP, amyloid precursor protein)或能作为巨噬细胞和小胶质细胞HIV-1复制的一种抑制剂,但其背后的分子机制,研究人员并不清楚。
近日,一篇发表在国际杂志Nature Communications上题为“HIV-1 promotes ubiquitination of the amyloidogenic C-terminal fragment of APP to support viral replication”的研究报告中,来自美国西北大学Feinberg医学院等机构的科学家们通过研究揭示了HIV如何劫持细胞内过程从而来进行增殖并促进神经变性发生的。

科学家揭示HIV-1感染和机体神经变性之间的神秘关联。图片来源:Nature Communications (2023). DOI:10.1038/s41467-023-40000-x
此前研究结果表明,淀粉样前体蛋白(APP)会在巨噬细胞和小胶质细胞中高水平表达,并会限制HIV-1的复制,为了抵消这种限制,HIV-1会促进APP的加工,最终导致促进HAND发生的毒性β淀粉样蛋白的产生。β淀粉样蛋白的积累被认为是多种痴呆症相关疾病中神经变性的主要诱因,包括阿尔兹海默病等,但β淀粉样蛋白如何以及为何会在HIV感染的患者机体中产生,以及其如何促进HAND,一直是一个谜题。在当前研究中,研究者Naghavi及其同事开始着手识别出APP抗病毒功能背后的分子机制,他说道,我们解决了这些问题,并通过深入揭示HIV-1在特定免疫细胞类型中复制的独特一面,这或许就连接了疾病生物学的第二个基本问题。
研究者Naghavi及其同事发现,APP的加工处理过程发生在多泡体亚群中,而多泡体亚群是HIV-1复制所必需的。在正常情况下,淀粉样蛋白产生过程会将这些多泡体进行分拣到溶酶体中,溶酶体是细胞中废弃物处理的一种细胞器,其能清除淀粉样蛋白并抑制HIV-1的复制,为了应对这种情况,HIV-1就必须将多泡体从溶酶体中分拣到支持其复制的细胞外途径中,但同时也增加了β-淀粉样蛋白的分泌。基于这一研究发现,研究人员利用一种临床获批的APP加工通路的抑制剂来处理培养的细胞,结果发现,其能成功阻断HIV-1进入多泡体中,从而抑制小胶质细胞和巨噬细胞中的病毒复制过程。研究结果表明,这一途径或许能作为HIV相关的神经认知障碍的潜在治疗性靶点。
3.Nat Commun:新研究揭示HIV侵入T细胞的细胞核的新途径
doi:10.1038/s41467-023-40227-8
在一项新的研究中,来自美国托罗大学和德国德累斯顿工业大学等研究机构的研究人员发现了人类免疫缺陷病毒(HIV)进入健康T细胞的细胞核的新途径,这种病毒可以在那里复制并继续入侵其他细胞。他们还确定了这种病毒进行入侵细胞核所需的三种蛋白:外核膜蛋白VAP-A、高度磷酸化的ORP3和Rab7,并进而合成了能够靶向其中一种蛋白的分子(潜在药物),从而有可能开发出治疗艾滋病的新疗法。相关研究结果于2023年8月10日发表在Nature Communications期刊上,论文标题为“HIV-1-induced nuclear invaginations mediated by VAP-A, ORP3, and Rab7 complex explain infection of activated T cells”。

由Rab7、VAP-A和ORP3组成的VOR复合物抑制HIV-1整合酶转运到核质网和生产性感染。图片来自Nature Communications, 2023, doi:10.1038/s41467-023-40227-8。
这种新发现的途径是,HIV 首先通过包裹在一种称为“内体(endosome)”的膜包内进入T细胞。然后,含有这种病毒的内体将保护性核膜向内推,形成一种称为核内陷(nuclear invagination)的凹痕。然后,内体在核内陷中移动到它的内侧顶端,在那里内体中的这种病毒随即滑入细胞核。
这项新的研究发现三种蛋白对HIV侵入细胞核中至关重要: 一种蛋白(Rab7)位于内体的膜上,第二种蛋白(VAP-A)位于发生核内陷的核膜上,第三种蛋白(ORP3)将前两种蛋白连接在一起。HIV成功侵入T细胞核需要这三种蛋白之间的相互作用,因此针对其中的任何一种蛋白都能阻止HIV感染。他们合成并测试了能中断这三蛋白之间相互作用的分子。他们观察到,在这类分子存在的情况下,HIV复制不会发生。
4.Cell子刊:发现治疗后控制者体内产生的广泛中和抗体可促进HIV-1感染长期缓解
doi:10.1016/j.chom.2023.06.006
一些 HIV-1 携带者在数年内接受了早期抗逆转录病毒药物(ART)治疗,在治疗中断后能够长期控制这种病毒。然而,这种治疗后控制的机制尚未完全阐明。
在一项新的研究中,来自法国巴斯德研究所(Institut Pasteur)、法国国家健康与医学研究院和巴黎公立医院网络的研究人员首次研究并揭示了中和抗体(包括广泛中和抗体)如何促进这种病毒控制。相关研究结果于2023年7月10日在线发表在Cell Host & Microbe期刊上,论文标题为“Anti-V1/V3-glycan broadly HIV-1 neutralizing antibodies in a post-treatment controller”。

图片来自Cell Host & Microbe, 2023, doi:10.1016/j.chom.2023.06.006。
通过研究血清中广泛中和抗体水平特别高的特定“治疗后控制者”病例中抗体的作用,这些作者发现病情缓解可能与这类抗体的活性有关。Hugo Mouquet描述了这一发现:“我们的研究首次在治疗后控制者身上描述了靶向HIV-1包膜蛋白的广泛中和抗体(bNAb)家族,其中抗体EPTC112是最活跃的成员之一。”抗体EPTC112能中和体外测试的200种HIV-1病毒变体中约三分之一的变体,并能在自然杀伤(NK)细胞(消灭体内异常细胞的免疫细胞)存在的情况下诱导消灭受感染的细胞。
因此,这项新的研究为了解中和抗体如何改变来自 VISCONTI 队列的这名产生EPTC112的患者体内的 HIV-1 感染过程提供了重要信息。虽然在该患者体内循环的 HIV-1 病毒由于该抗体靶向的区域中的突变而对 EPTC112 中和产生了抵抗力,但从该患者血液中分离出的其他抗体群体却能有效中和该病毒。因此,这项研究表明,来自EPTC112 家族的中和抗体对 HIV-1 病毒施加了选择性压力。
5.Science子刊:证实宿主限制因子ProTα可在体内抑制HIV感染
doi:10.1126/scitranslmed.adg0873
在一项新的研究中,来自美国沃尔特-里德陆军研究所等研究机构的研究人员证实了以前针对 HIV-1 的宿主限制因子的研究成果。他们详细介绍了组学(omics)如何在寻找治疗策略时揭示相关性。相关研究结果发表在2023年8月2日的Science Translational Medicine期刊上,论文标题为“Single-cell transcriptomics identifies prothymosin α restriction of HIV-1 in vivo”。
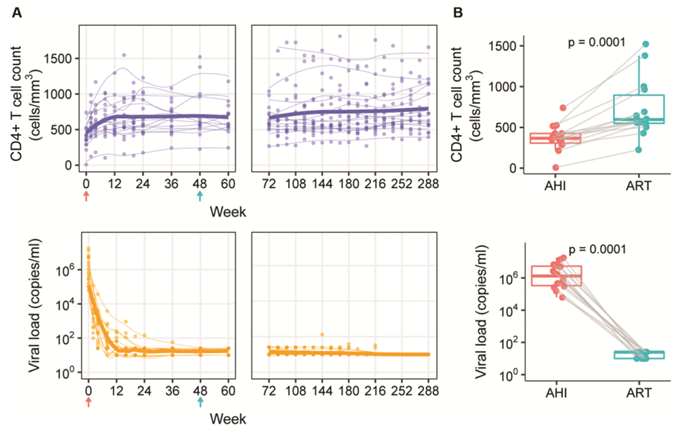
参与者CD4+ T细胞计数和病毒载量(VL)在抗逆转录病毒治疗(ART)和急性HIV感染(AHI)时间点不同。图片来自Science Translational Medicine, 2023, doi:10.1126/scitranslmed.adg0873。
这些作者利用单细胞转录组学(single-cell transcriptomics)确定了在14名HIV-1感染者的细胞中活跃的蛋白。他们通过将患者的基因表达与单个细胞内的HIV-1 RNA数量相关联,缩小了称为宿主限制因子(host restriction factor)的潜在抗病毒蛋白列表的范围。这些蛋白是人体先天免疫系统的一部分,能识别并干扰病毒复制周期的特定步骤,从而阻止感染。
这些作者还对血浆病毒载量最高的一名参与者进行了测序比较,结果发现HIV-1 RNA的转录与编码ProTα(prothymosin αlpha)的基因 PTMA 的表达成反比。这一关联随后在这项初始研究之外的另外28名参与者中得到了验证。体外过表达ProTα证实,这种细胞因子能抑制HIV-1的转录和传染性病毒的产生。
6.Lancet子刊:临床试验表明一种新的HIV治疗制剂有望安全有效地治疗HIV感染儿童
doi:10.1016/S2352-3018(23)00107-8
在一项新的研究中,来自美国科罗拉多大学安舒茨医学园区的研究人员帮助确认了一种用于治疗感染人类免疫缺陷病毒(HIV)儿童的药物制剂的剂量、安全性和有效性。他们揭示了一种新的分散制剂和一种含有三种药物---度鲁特韦(dolutegravir)、阿巴卡韦(abacavir)和拉米夫定(lamivudine)---的速释片剂,在单一固定剂量组合(fixed dose combination, FDC)制剂中,对治疗HIV感染儿童是安全、耐受性良好和有效的。根据血液中每种药物的浓度来给药也是合适的。相关研究结果发表在2023年8月的Lancet HIV期刊上,论文标题为“Pharmacokinetics, safety, and tolerability of dispersible and immediate-release abacavir, dolutegravir, and lamivudine tablets in children with HIV (IMPAACT 2019): week 24 results of an open-label, multicentre, phase 1–2 dose-confirmation study”。

论文通讯作者、科罗拉多大学安舒茨医学园区药学与制药科学学院助理教授Kristina Brooks博士说,“这是首款含有度鲁特韦的 FDC制剂,可用于体重在 13 到 88 磅之间的儿童。针对儿童的HIV治疗历来具有挑战性,因为它需要使用多种药片和液体,而这些药片和液体的味道并不总是最好的,而且给药也具有挑战性。”
度鲁特韦、阿巴卡韦和拉米夫定已在全球范围内被证明是安全有效的HIV治疗药物。Brooks和Jennifer Kiser药学博士通过国际母婴青少年艾滋病临床试验(International Maternal Pediatric Adolescent AIDS Clinical Trials, IMPAACT)网络与一组研究人员合作,研究现有的速释片剂和含有这三种药物的分散释放片剂的新配方,看是否会产生他们在成人和青少年身上看到的同样积极的结果。
7.Nature:揭示一种基因变异与一部分非洲血统人群中较低的HIV水平有关
doi:10.1038/s41586-023-06370-4
在一项新的研究中,一个国际研究小组发现了一种基因变异,它可能解释为什么一些非洲血统的人天生就有较低的HIV病毒载量,从而降低了他们传播这种病毒的风险并减缓了自身病情的发展。这是近30年来研究发现的首个与HIV感染有关的新基因变异。未来,它可能有助于指导为HIV感染者开发新的治疗方法。相关研究结果于2023年8月2日在线发表在Nature期刊上,论文标题为“Africa-specific human genetic variation near CHD1L associates with HIV-1 load”。
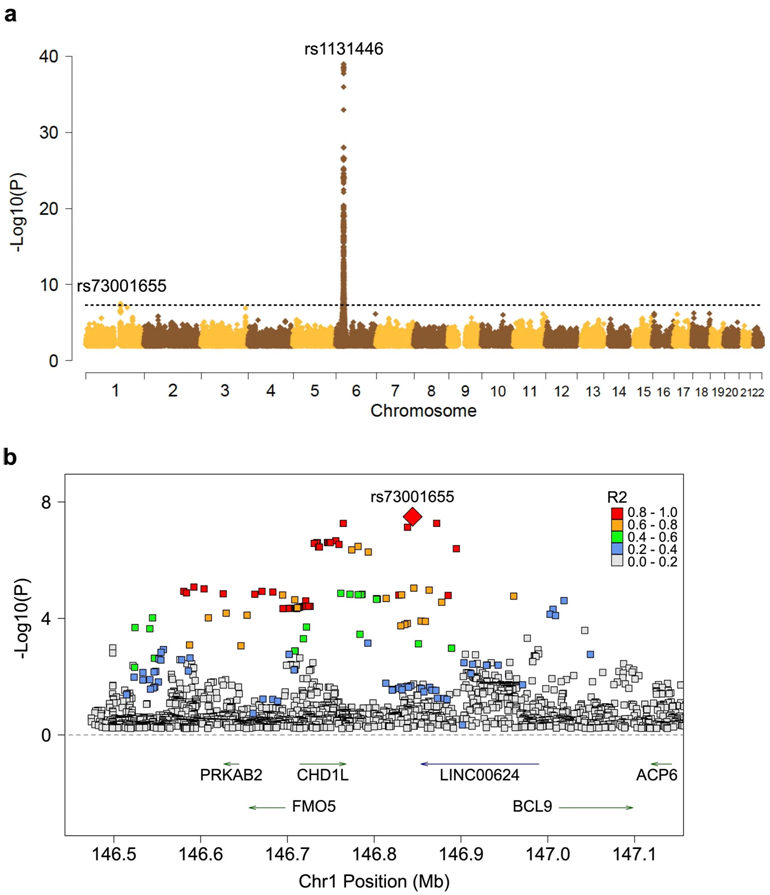
图片来自Nature, 2023, doi:10.1038/s41586-023-06370-4。
我们对 DNA 与 HIV 之间关系的了解大多来自对欧洲人群的研究。但鉴于HIV对非洲大陆的人群的影响尤为严重---超过 2500 万HIV呈阳性的人生活在非洲大陆,因此更好地了解遗传学在非洲人感染HIV中的作用非常重要。
为了研究这个问题,这些作者分析了近 4000 名非洲裔 HIV-1 感染者的 DNA。他们在 1 号染色体上含有 CHD1L 基因的区域内发现了一种基因变异,该基因变异携带者的病毒载量会降低。据认为,4% 到 13% 的非洲裔人携带这种特殊的基因变异。
8.JCI Insight:新研究揭示HIV感染者体内的记忆 CD4+ T细胞容易死亡机制
doi:10.1172/jci.insight.167329
在一项新的研究中,法国国家科学研究所的Simona Stäger教授及其研究团队在人类免疫缺陷病毒(HIV)研究领域取得了突破性进展。他们发现了记忆 CD4+ T细胞(在免疫反应中发挥重要作用的免疫细胞)在HIV感染者体内容易发生细胞死亡的机制。相关研究结果近期发表在JCI Insight期刊上,论文标题为“The TLR7/IRF-5 axis sensitizes memory CD4+ T cells to Fas-mediated apoptosis during HIV-1 infection”。
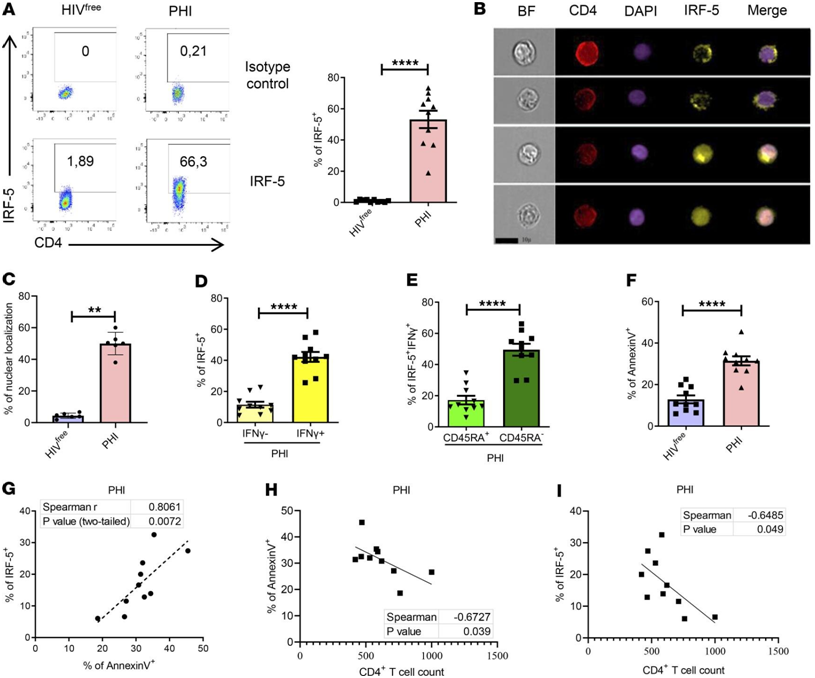
图片来自JCI Insight, 2023, doi:10.1172/jci.insight.167329。
这些作者发现,记忆CD4+ T细胞中的TLR7受体和IRF5转录因子的表达量较高,这代表了这些细胞中的分子印记使它们容易发生细胞死亡。他们的研究结果还表明,IRF-5抑制肽可以阻止这种细胞死亡倾向。他们观察到的分子印记是慢性炎症环境的结果。因此,这项研究的结果可能会对以严重炎症环境为特征的其他慢性传染病产生影响。
9.Science子刊:从结构上揭示HIV整合酶对度鲁特韦产生耐药性机制
doi:10.1126/sciadv.adg5953
度鲁特韦是临床上用于治疗人类免疫缺陷病毒(HIV)感染的最有效的抗病毒药物之一。在一项新的研究中,来自美国国家卫生研究院和索尔克研究所的研究人员发现了HIV对度鲁特韦产生耐药性的分子机制。具体而言,他们揭示了一种称为整合酶(integrase)的HIV蛋白的三维结构变化如何导致这种病毒对度鲁特韦产生耐药性,以及其他化合物如何可能能够克服这种耐药性。相关研究结果发表在2023年7月21日的Science Advances期刊上,论文标题为“Mechanisms of HIV-1 integrase resistance to dolutegravir and potent inhibition of drug-resistant variants”。
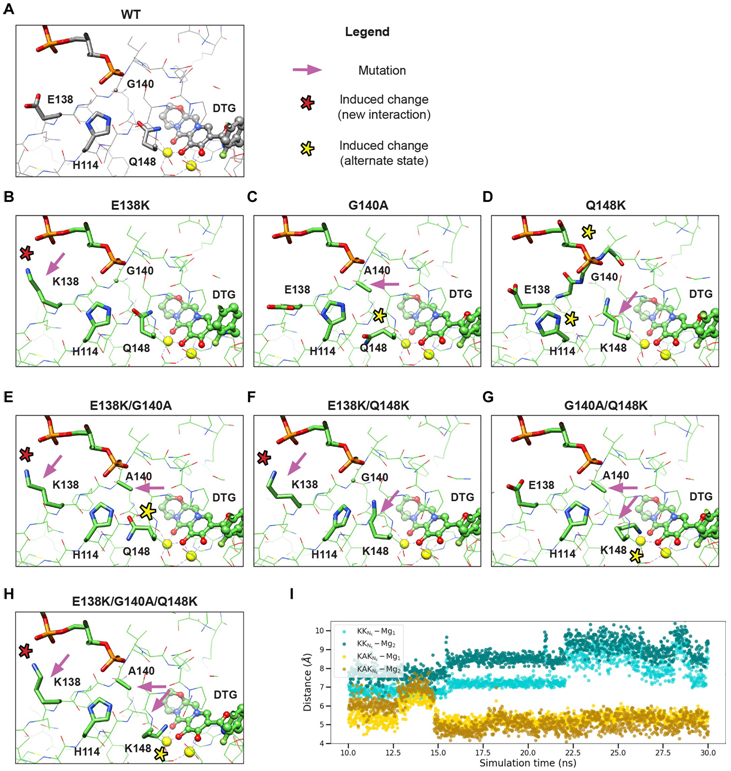
耐药突变E138K/G140A/Q148K诱导结合DTG配体周围活性位点的氨基酸残基构型改变。图片来自Science Advances, 2023, doi:10.1126/sciadv.adg5953。
在这项新的研究中,这些作者构建了一些整合酶蛋白的变异版本,已知这些变异会使HIV对度鲁特韦产生耐药性。然后,他们确定了每种突变整合酶的结构,揭示了为何度鲁特韦不再能结合并阻断每种整合酶突变版本。他们还评估了这种病毒的“适应性”(产生传染性后代的能力)和酶的活性,以更好地了解导致患者产生耐药性的原因。
这些作者还测试了一种实验性艾滋病药物 4d 在阻断度鲁特韦耐药性整合酶蛋白功能方面的疗效。4d是Lyumkis在美国国家卫生研究院的合作者开发的新一代整合酶靶向药物,目前正在进行临床前动物实验。他们发现,在所有HIV整合酶变体中,4d 仍能有效阻断 HIV 将它的基因整合到人类细胞中的能力。这表明4d 或这种化合物的变体可能有效地用于治疗对度鲁特韦产生耐药性的患者体内的HIV病毒。
10.Nat Commun:科学家揭示免疫逃逸HIV蛋白复合体的特殊结构
doi:10.1038/s41467-023-39796-5
如今,科学家们一直致力于揭开HIV中A3G-Vif相互作用的基础,其二者之间的相互作用是HIV逃避机体抗病毒先天性免疫反应的关键机制。HIV-1能通过与其它病毒感染因子(Vif,viral infectivity factor)的结合来中和宿主机体的细胞防御。
近日,一篇发表在国际杂志Nature Communications上题为“Structural insights into RNA bridging between HIV-1 Vif and antiviral factor APOBEC3G”的研究报告中,来自冲绳科学技术大学院大学等机构的科学家们通过研究利用冷冻电子显微镜技术揭示了APOBEC3G-Vif复合体的原子结构。
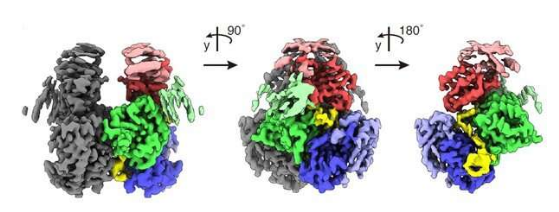
科学家揭示免疫逃逸HIV蛋白复合体的特殊结构。图片来源:Nature Communications (2023). DOI:10.1038/s41467-023-39796-5
研究者Matthias Wolf说道,APOBEC3G (A3G)是人类先天性免疫系统用来抵御入侵病毒的关键组分,其就好像特洛伊木马一样能进入出芽的病毒颗粒中,这样其就能在所感染的细胞中病毒进行逆转录后修饰并失活病毒的DNA。然而HIV-1已经进化出了一种以Vif蛋白形式存在的抵抗机制,其能通过与A3G结合并对其进行降解来抑制这一过程的发生,从而成功扩增感染性的病毒颗粒。
这项研究的一个独特之处在于,其首次揭示了这种复合体的形成或许是由特定的RNA序列所介导的,尽管单链DNA是A3G的降解底物,其蛋白结构能被优化为具有更高的溶解度,并且能在体外复制A3G泛素化的降解途径,A3G泛素化是一种能将泛素多泛素化转移到靶向蛋白的过程,其在多种生理学功能中都非常重要。
11.PNAS:科学家发现有望治疗HIV感染的新型潜在靶点
doi:10.1073/pnas.2219475120; doi:10.1073/pnas.2219543120
近日,两篇发表在国际杂志Proceedings of the National Academy of Sciences上题为“Neutral sphingomyelinase 2 is required for HIV-1 maturation”和“Inhibition of neutral sphingomyelinase 2 impairs HIV-1 envelope formation and substantially delays or eliminates viral rebound”的研究报告中,来自约翰霍普金斯大学医学院等机构的科学家们通过对携带人源化免疫系统的小鼠及人类细胞系进行研究后,识别出了一种特殊的酶类或在HIV复制的后期阶段中扮演着关键作用。

科学家发现有望治疗HIV感染的新型潜在靶点。图片来源:Proceedings of the National Academy of Sciences (2023). DOI:10.1073/pnas.2219543120
这种名为中性鞘磷脂酶2(nSMase2,neutral sphingomyelinase-2)的酶类在机体脂质(细胞中天然存在的脂肪)代谢过程中扮演着重要角色,当nSMase2被阻断或剔除后,所产生的HIV就会表现地形状怪异,且并不能成熟和具有感染性。最终,抑制HIV所感染细胞中的nSMase2的功能或会导致被感染的细胞发生死亡,如今研究人员开发出了一类能阻断nSMase2的新型抗逆转录病毒化合物,其不仅能抑制HIV的复制,还能杀死被感染的细胞,并有望提高其治疗HIV感染的潜力。
HIV-1是能攻击宿主机体免疫系统并导致AIDS发生的最常见HIV类型,该病毒能控制并破坏特定的白细胞,包括CD4+ T细胞,目前尚没有治愈HIV的疗法,但抗逆转录病毒疗法则能抑制病毒的复制并防止其进展为AIDS;但是如果患者停止服药的话,病毒就会再次开始复制,由于病毒需要一层保护膜才能感染其它细胞,这些研究就将注意力集中到了产生这种“病毒包膜”的生物学特性和活性上。研究者Norman Haughey教授说道,HIV的基因组非常小,因此为了进行自我复制,其就会拦截各类细胞机制,中性鞘磷脂酶2就是这种劫持机制中的一个重要环节,研究者发现其对于HIV进行正常的复制是非常必要的。
12.Science子刊:广泛中和抗体治疗可减少一些HIV-1感染儿童体内的HIV-1病毒库
doi:10.1126/scitranslmed.adh0004
在一项新的研究中,来自美国哈佛大学陈曾熙公共卫生学院、布莱根妇女医院和拉根研究所等研究机构的研究人员发现了一种潜在的更好的替代标准抗逆转录病毒药物(ART)治疗来控制HIV-1复制,并对控制HIV-1病毒库有额外的好处。相关研究结果发表在2023年7月5日的Science Translational Medicine期刊上,论文标题为“Broadly neutralizing antibody treatment maintained HIV suppression in children with favorable reservoir characteristics in Botswana”。在这篇论文中,他们详细介绍了一项针对非洲博茨瓦纳出生的HIV-1感染儿童的前瞻性临床试验。

图片来自Science Translational Medicine, 2023, doi:10.1126/scitranslmed.adh0004。
在这项新的研究中,两种广泛中和抗体(broadly neutralizing antibody, bNAb)--- VRC01LS和 10-1074---被给予自出生起就接受标准ART治疗并持续治疗至少96周的HIV-1感染儿童。这两种bNAb每四周静脉注射一次,与ART治疗重叠至少8周,然后继续治疗24周或直到在没有ART治疗的情形下HIV-1 RNA升至每毫升400拷贝以上。
这些作者发现,接受bNAb治疗的HIV-1感染儿童具有更有利的HIV-1病毒库特征。虽然不能治愈,但它确实表明该疗法能中和部分强化的病毒载量,从而降低这种病毒在未来的重新感染能力。
13.ACS Nano:科学家开发出一种能直接测定HIV病毒载量的新型数字检测技术
doi:10.1021/acsnano.3c01917
一毫升血液中包含大约15个单独的血滴,对于HIV感染者而言,每滴血液中可能含有的病毒数量从不到20个拷贝到超过50万个拷贝不等,其被称之为病毒载量,这一指标能被被临床医生用来理解AIDS患者对抗病毒药物如何产生反应及监测其疾病的潜在进展。在病人接受治疗的过程中,比较耗时的病毒载量检测常常需要重复多次,近日,一篇发表在国际杂志ACS Nano上题为“STAMP-Based Digital CRISPR-Cas13a for Amplification-Free Quantification of HIV-1 Plasma Viral Loads”的研究报告中,来自宾夕法尼亚州立大学等机构的科学家们通过研究开发出了一种时间和成本效益较高的数字检测手段,其或能直接测定患者一滴血液中是否存在HIV病毒。
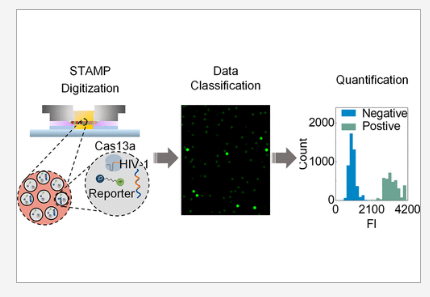
科学家开发出一种能直接测定HIV病毒载量的新型数字检测技术。图片来源:ACS Nano (2023). DOI:10.1021/acsnano.3c01917
据研究者介绍,这种新型的数字检测技术能为多种感染性疾病的临床诊断工具开发提供重要的基础,传统的HIV病毒载量检测往往涉及从样本中提取遗传物质,对其进行扩增并与参考样本进行比较;称之为RT-PCR的金标准测试手段能对实际的病毒载量进行接近地估计,但其并不是一种直接的测定,于是研究者Guan等人在他们进行的测试中采取了一种更为直接的手段,名为STAMP(通过自动膜分离的自我数字化技术,Self-digitization Through Automated Membrane-based Partitioning),该技术相比RT-PCR更便宜、快速且需要的血液量较少。
研究者Guan说道,该技术的工作原理是这样的,我们首先从患者的血液中提取少量样本,随后对病毒RNA进行抽提,再讲RNA与名为Cas13的特定蛋白相混合,而Cas13是CRISPR系统的关键部分。CRISPR-Cas13是一种革命性的工具,其能帮助研究人员靶向作用并操控RNA序列;这项研究中,研究人员利用这项技术并不仅仅因为其具有强大的编辑能力,而是其诊断潜能,他们利用CRISPR-Cas13来检测并发出HIV存在的信号。
一旦RNA与Cas13进行结合的话,研究人员就会在混合物中放置一种纳米孔聚碳酸酯膜,其是一种非常容易获得的较薄的过滤器,这或许就使其能成为一种具有成本效益的材料。这种膜的纳米孔如此之小以至于其能将混合物分割成为仅含有单个RNA分子的单一液滴,该分子上还附着有Cas13蛋白,如果HIV存在于RNA分子中的话,Cas13蛋白(能被HIV的RNA所激活)就会切割报告分子,从而产生研究人员能检测到的信号分子。研究者指出,通过计算显示这种信号的液滴的数量,我们就能确定个体血液中HIV的水平,即携带这种信号的液滴的数量越多,病毒载量水平就越高。(生物谷Bioon.com)
相关新闻:
2023年HIV研究进展第2期
https://news.bioon.com/article/a55fe7864936.html
2023年HIV研究进展第1期
https://news.bioon.com/article/65fee5748227.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


