《自然·神经科学》:南大团队首次发现,癫痫灶神经元“甩脂”殃及星形胶质细胞,促进癫痫发生
来源:奇点糕 2023-04-11 15:29
本研究证明了癫痫灶中存在一类与癫痫相关的星形胶质细胞群体LARA,并呈现出一种独特的、脂质积累的反应状态。LARA可能与癫痫的耐药性存在关系,其A2AR的上调或是神经元过度兴奋的一个促成因素。
说起癫痫,估计大部分人都不会陌生,它就是我们经常听到的“羊癫疯”。
这种病是大脑神经元突发异常放电导致的,患者常出现运动、感觉、自主神经、意识及精神障碍等症状(大约影响了1%的人)[1, 2]。
70%的癫痫患者经药物治疗后可得到有效控制,然而剩下30%的患者会发展为耐药性癫痫[3]。癫痫灶中神经元损伤后胶质瘢痕的形成,是造成耐药性癫痫的主要原因[4]。
科学家已经知道,构成胶质瘢痕的主要成分为反应性星形胶质细胞,然而,目前学界对于反应性星形胶质细胞与癫痫之间的关系并不清楚。
近日,南京大学生命科学学院的闫超、陈迪俊、陈张朋团队,与南京鼓楼医院神经外科刘翔宇团队合作,在《自然·神经科学》发表重要研究成果[5],揭示了脂质代谢失调在癫痫与反应性星形胶质细胞之间起到的作用。
研究团队发现,颞叶癫痫患者和癫痫模型小鼠中的致痫灶中均存在异常脂质堆积,而神经元长期过度兴奋产生的大量脂质,会被转移到“大冤种”星形胶质细胞,从而造就了一类表现出独特分子表型和功能的脂质堆积反应性星形胶质细胞(LARA)。LARA可能通过上调自身腺苷2A受体,降低谷氨酸再摄取,从而提高神经元兴奋性,进而促进癫痫的发生。
此研究结果提示,调控脂质代谢等靶向LARA的疗法,或将有助于耐药性癫痫患者的治疗[6]。

论文首页截图
早在30多年前,就有研究报道了癫痫患者大脑中异常的脂质堆积现象[7],但一直没有引起重视。
为了进一步研究癫痫患者脑部的脂质堆积现象,研究者首先对4例耐药性颞叶癫痫(TLE)患者进行了磁共振波谱检测,发现癫痫病灶处的脂质信号相比于大脑对侧明显更强(P=0.0013)。
这一现象得到了上述TLE患者病灶组织和“正常”(肿瘤患者或外伤患者脑组织)组织脂质染色结果的验证,病灶组织中神经元和星形胶质细胞内的脂质显著增加(P<0.01)。
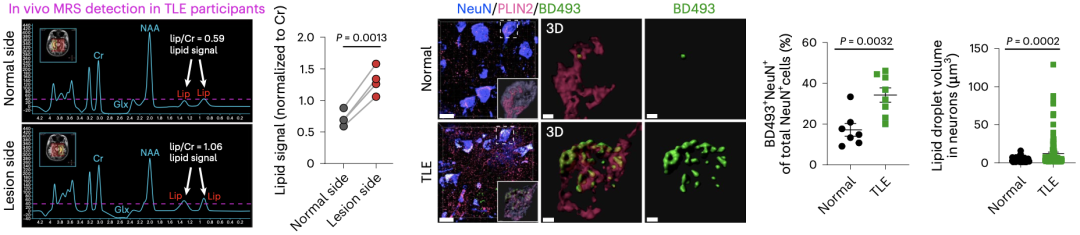
TLE患者病灶组织中神经元和星形胶质细胞内的脂质显著增加
这个从临床患者中观察到的现象,在小鼠癫痫模型中再一次得到了证实。
在红藻氨酸(KA,L-谷氨酸类似物,中枢神经系统兴奋剂)诱导的经典癫痫小鼠模型,和通过化学遗传学建立的癫痫小鼠模型中,癫痫灶处同样均出现脂质堆积,且同样是神经元和星形胶质细胞内出现脂质增多。
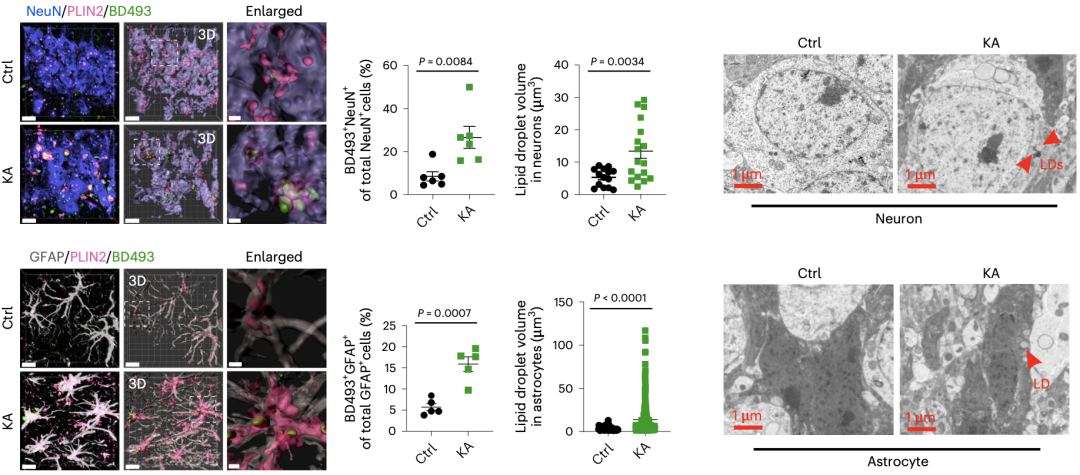
癫痫小鼠模型癫痫灶中神经元和星形胶质细胞内出现脂质堆积
这些结果均提示癫痫灶中出现了脂质代谢的失调。那这其中到底发生了什么呢?
为了进一步进行研究,研究人员对4例TLE患者和4例非TLE对照的脑组织,进行了单核RNA测序(snRNA-seq),共获得了66526个单核转录数据。在对细胞进行分群后,研究人员发现TLE患者和非TLE对照的细胞群体存在差异,TLE患者病灶中抑制性神经元数量减少,胶质细胞数量增多,符合癫痫的病理特征。
有趣的是,尽管在上述研究中观察到神经元和星形胶质细胞内均存在脂质堆积,但对相应细胞群体的信号通路分析却表明,与脂质转运和代谢相关的通路在星形胶质细胞中显著激活,在神经元中仅轻度激活。
通过对TLE患者和非TLE对照的星形胶质细胞进行进一步的分群,研究人员在TLE患者的星形胶质细胞中,发现了一群以高表达APOE为特征的细胞群体。这一发现也得到了TLE患者组织星形胶质细胞免疫染色结果的验证,相比于非TLE对照,TLE患者星形胶质细胞中的APOE表达更高(P=0.0067),而神经元以及其他胶质细胞则没有差异。
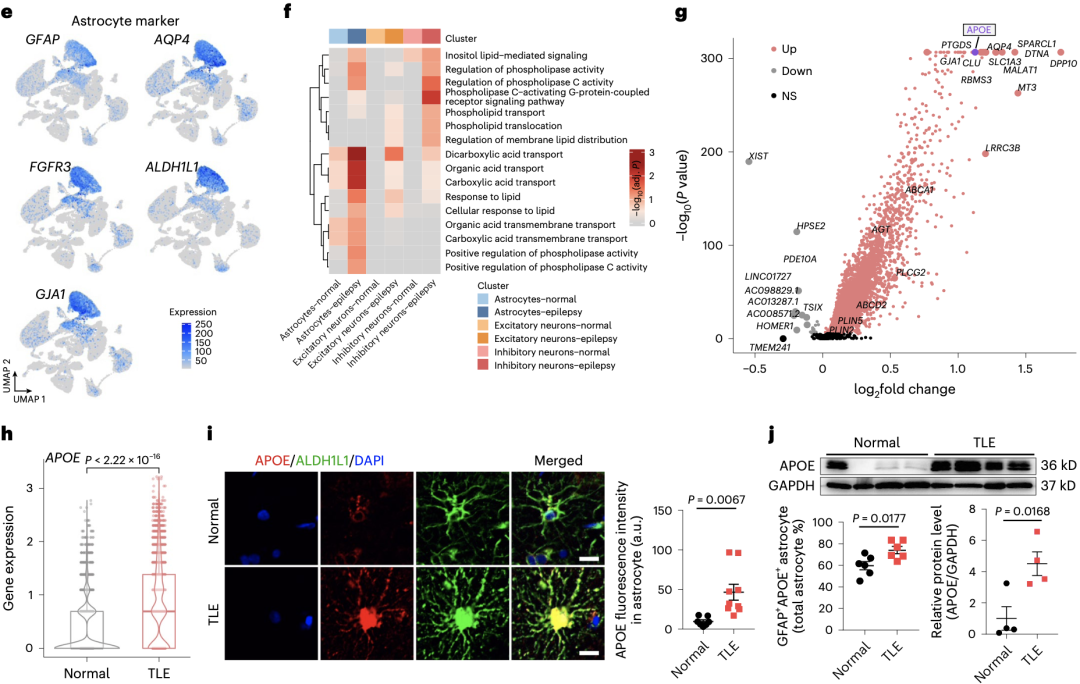
TLE患者的星形胶质细胞发现了一群以高表达脂质转运基因APOE为特征的细胞群体
任何现象的存在,都有它的道理!那么这一特殊的星形胶质细胞群体到底有何作用呢?
通过研究全身APOE敲除(KO)和星形胶质细胞特异性APOE敲除(cKO)的癫痫小鼠模型,研究人员发现APOE的敲除对神经元内的脂质堆积几乎没有影响,但显著影响星形胶质细胞内的脂质堆积(P<0.001),表明APOE是星形胶质细胞而非神经元中脂质积累所必需的。
因此,研究人员提出假说:神经元长期过度兴奋导致细胞内脂质积累,然后通过APOE依赖途径不断转移到星形胶质细胞。
为了验证这一假设,研究人员进行了一系列实验。
首先,他们发现通过红藻氨酸直接刺激从野生型小鼠提取的原代神经元,可诱导细胞内剂量依赖性脂滴的形成,但刺激星形胶质细胞无法促使细胞内脂滴形成。其次,用经红藻氨酸刺激的神经元培养基处理星形胶质细胞,可促使星形胶质细胞内脂质堆积。最后,通过对脂肪酸的标记追踪,他们发现在红藻氨酸刺激后,脂肪酸确实从神经元转移到了星形胶质细胞。
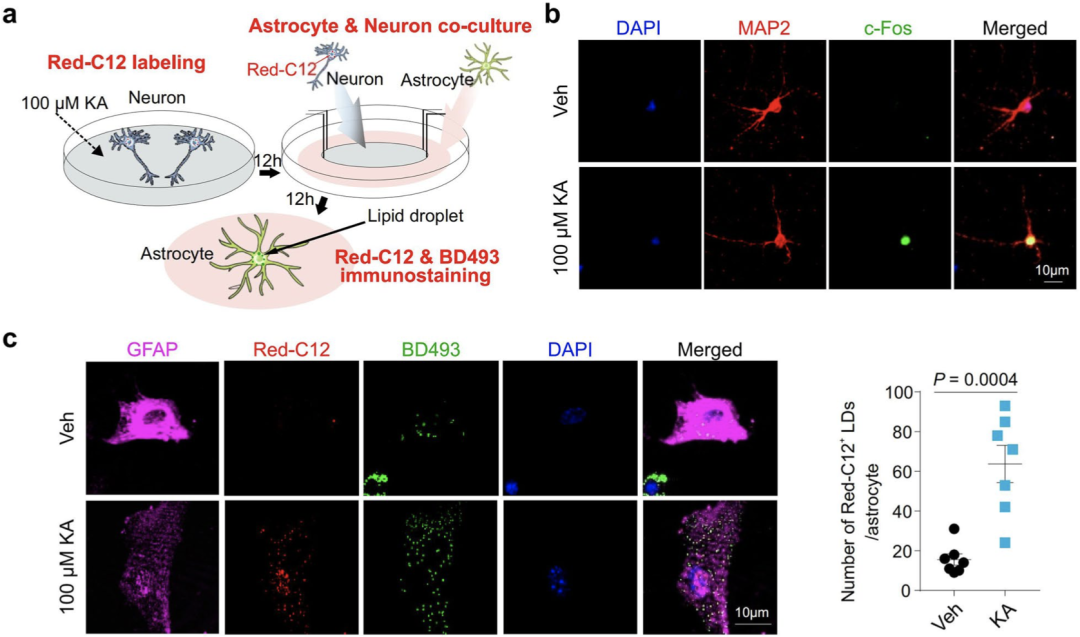
在KA刺激后脂肪酸从神经元内转移到了星形胶质细胞
这下实锤了,星形胶质细胞这个“背锅侠”吞下了神经元造的“孽”,终究是星形胶质细胞扛下了所有,研究人员将这群星形胶质细胞命名为脂质堆积的反应性星形胶质细胞(LARA)。
忍无可忍,无需再忍。被欺负的老实人——LARA也做出了自己的反击。
研究人员发现,LARA存在促进癫痫的能力。LARA会上调自身的腺苷2A受体(A2AR),降低谷氨酸再摄取,从而升高了神经元兴奋性导致癫痫的发生,而通过A2AR抑制剂和敲除A2AR,均可逆转LARA的促癫痫作用。
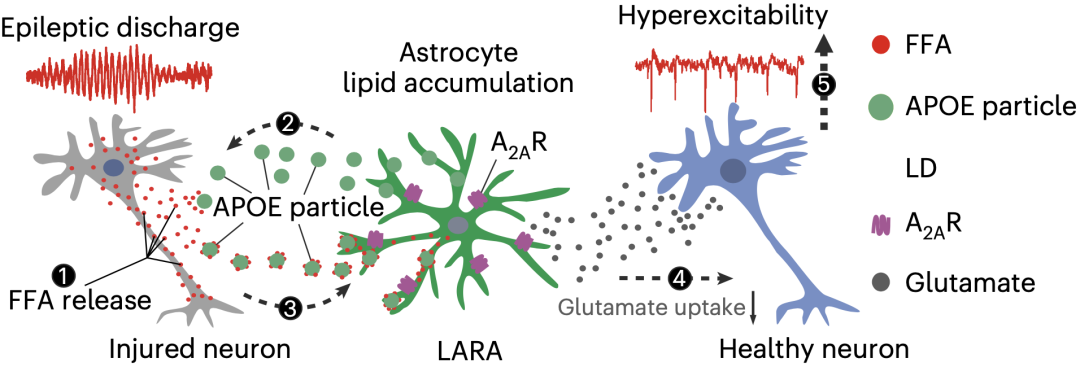
神经元和LARA在癫痫中的相互作用机制图
总的来说,本研究证明了癫痫灶中存在一类与癫痫相关的星形胶质细胞群体LARA,并呈现出一种独特的、脂质积累的反应状态。LARA可能与癫痫的耐药性存在关系,其A2AR的上调或是神经元过度兴奋的一个促成因素。今后靶向LARA的治疗或可为耐药性癫痫患者的治疗提供新策略。
参考文献
1.Patel DC, Tewari BP, Chaunsali L, Sontheimer H: Neuron-glia interactions in the pathophysiology of epilepsy. Nat Rev Neurosci 2019, 20(5):282-297.
2.Thijs RD, Surges R, O'Brien TJ, Sander JW: Epilepsy in adults. Lancet 2019, 393(10172):689-701.
3.Loscher W, Potschka H, Sisodiya SM, Vezzani A: Drug Resistance in Epilepsy: Clinical Impact, Potential Mechanisms, and New Innovative Treatment Options. Pharmacol Rev 2020, 72(3):606-638.
4.Vezzani A, Balosso S, Ravizza T: Neuroinflammatory pathways as treatment targets and biomarkers in epilepsy. Nat Rev Neurol 2019, 15(8):459-472.
5.Chen Z-P, Wang S, Zhao X, Fang W, Wang Z, Ye H, Wang M-J, Ke L, Huang T, Lv P et al: Lipid-accumulated reactive astrocytes promote disease progression in epilepsy. Nature Neuroscience 2023.
6.Abnormal lipid metabolism shapes astrocyte reactivity in patients with epilepsy. Nature Neuroscience 2023.
7.Woods BT, Chiu TM: In vivo 1H spectroscopy of the human brain following electroconvulsive therapy. Ann Neurol 1990, 28(6):745-749.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


