解读近期科学家们在人类肥胖研究领域取得的新成果!
来源:生物谷原创 2025-03-26 11:18
2025年年初,国家卫生健康委员会发布了《2025年全民健康体重管理行动计划》,明确提出将体重管理作为年度重点健康工作之一,通过政策引导、健康教育、社区支持等多方面措施,帮助民众实现科学减重,预防肥胖相关疾病;而且随着2025年“体重管理年”的正式启动,我国各地掀起了减肥热潮。
那么在肥胖研究领域,科学家们也一直在奋力研究,同时也取得了多项可喜的成果,本文中,小编就对相关研究成果进行整理,分享给大家!
【1】减肥界的“新星”!Nature:科学家识别出一种能抑制机体食欲并促进减肥的新型分子!
doi:10.1038/s41586-025-08683-y
在这个“以瘦为美”的时代,减肥似乎成了全球性的热门话题。健身房里挥汗如雨的人们、各种减肥药的广告,还有那些让人眼花缭乱的节食方案……但你知道吗?科学家们也在为这场“减肥大战”努力着。近日,一篇发表在国际杂志Nature上题为“Prohormone cleavage prediction uncovers a non-incretin anti-obesity peptide”的研究报告中,来自斯坦福大学医学院等机构的科学家们通过研究发现了一个可能改变游戏规则的新分子—BRP(BRINP2相关肽)。
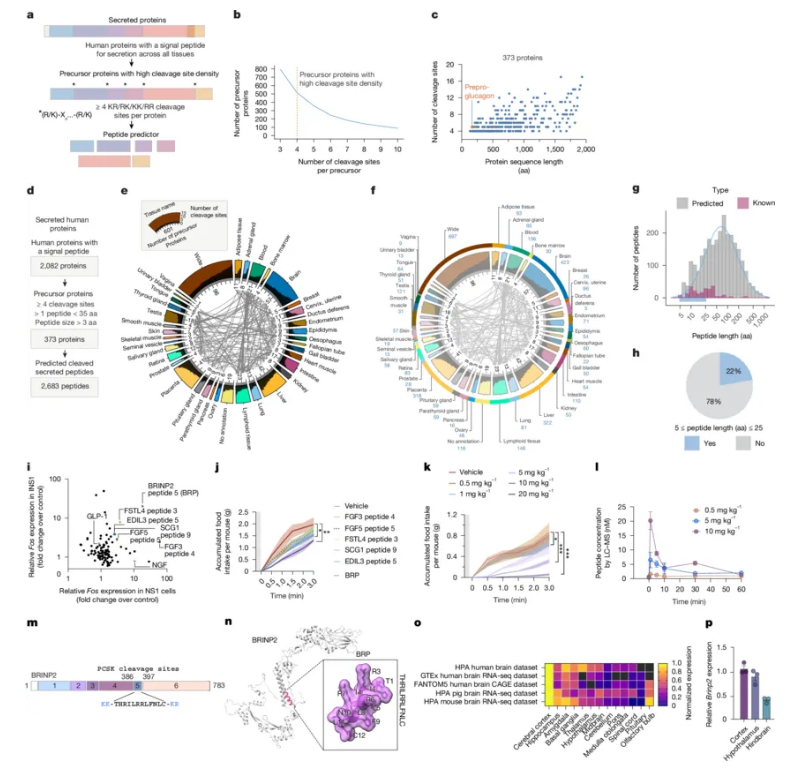
肽类预测器或能帮助预测新型肽类
提到减肥药,很多人可能听说过Ozempic(司美格鲁肽),其是一种通过模拟人体内GLP-1(胰高血糖素样肽-1)作用来抑制食欲、降低血糖的药物,而GLP-1是一种调节食欲和血糖的关键激素,Ozempic能通过模仿其效果来帮助人们减少食物摄入,从而达到减肥的目的。然而,Ozempic也有它的“小缺点”,比如可能会引起恶心、便秘,甚至导致肌肉量减少。
这项研究中,研究人员就找到了一个可能更好的替代品—天然分子BRP(BRINP2相关肽),其和Ozempic一样能有效抑制食欲和减少体重,但似乎没有那些让人不舒服的副作用。这简直就是减肥界的“新星”,BRP的发现过程堪称一场“大海捞针”的科学冒险。我们的身体中有成千上万种蛋白质,其中一种叫做“原激素”的蛋白质在经过特定酶的切割后,会变成具有生物活性的肽类激素,这些肽类激素在调节能量代谢、控制食欲等方面起着关键作用。GLP-1就是其中一个例子,但科学家们一直怀疑还有更多类似的肽类激素等待被发现。
【2】脂肪细胞的“减肥秘密武器”!Cell Metabol:通过遗传修饰机体的脂肪细胞或有望开发出新型减肥疗法
doi:10.1016/j.cmet.2024.11.003
肥胖,这个现代生活中的“隐形杀手”,不仅让人身材走样,还悄悄增加了胰岛素抵抗、2型糖尿病和心血管疾病的风险。近日,一篇发表在国际杂志Cell Metabolism上的研究报告“The GIP receptor activates futile calcium cycling in white adipose tissue to increase energy expenditure and drive weight loss in mice”,揭示了脂肪细胞中一个名为葡萄糖依赖性促胰岛素多肽受体(GIPR, glucose-dependent insulinotropic polypeptide receptor)的蛋白质如何成为减肥的关键角色。
来自德克萨斯大学西南医学中心的研究团队发现,当给肥胖小鼠的脂肪细胞进行遗传工程化修饰,使其产生更多GIPR时,这些小鼠竟然能在两周内减轻超过三分之一的体重!这一惊人发现让研究者Christine M. Kusminski博士兴奋不已:“我们的研究表明,GIPR或许可以作为治疗肥胖及其相关代谢性疾病的重要靶点。”根据世界卫生组织(WHO)的数据,全球有超过10亿人受到肥胖的影响,而肥胖与多种健康问题密切相关,如心血管疾病、2型糖尿病、阻塞性睡眠呼吸暂停、骨关节炎以及某些癌症等。
近年来,针对胰高血糖素样肽-1受体(GLP-1R, glucagon-like peptide-1 receptor)的药物已经被美国食品药品监督管理局(FDA)批准用于治疗肥胖,并且这些药物通过作用于大脑中调节食欲的区域来发挥有益效应。最近,FDA还批准了一种新型减肥药物,它同时靶向GLP-1R和GIPR,临床试验结果显示,这类药物对2型糖尿病和肥胖患者的减肥效果尤为显著。
【3】“两全其美”新型减肥药!Nature:新型减肥药物能减少机体食欲增加能量消耗,且不会产生恶心等常见副作用
doi:10.1038/s41586-024-08207-0
减肥和治疗2型糖尿病的关键在于减少食物摄入和增加能量消耗。然而,目前的药物通常需要结合多种受体激动剂才能达到这两种效果,而且还没有安全的能量消耗药物进入临床阶段。
近日,一篇发表在国际杂志Nature上题为“NK2R control of energy expenditure and feeding to treat metabolic diseases”的研究报告中,来自南丹麦大学等机构的科学家们发现了一种新型减肥药物,它不仅能减少食欲,还能增加能量消耗,并改善胰岛素敏感性,且不会引起恶心或肌肉量减少等副作用。这一发现可能会让数百万对现有疗法无响应的肥胖和2型糖尿病患者受益。
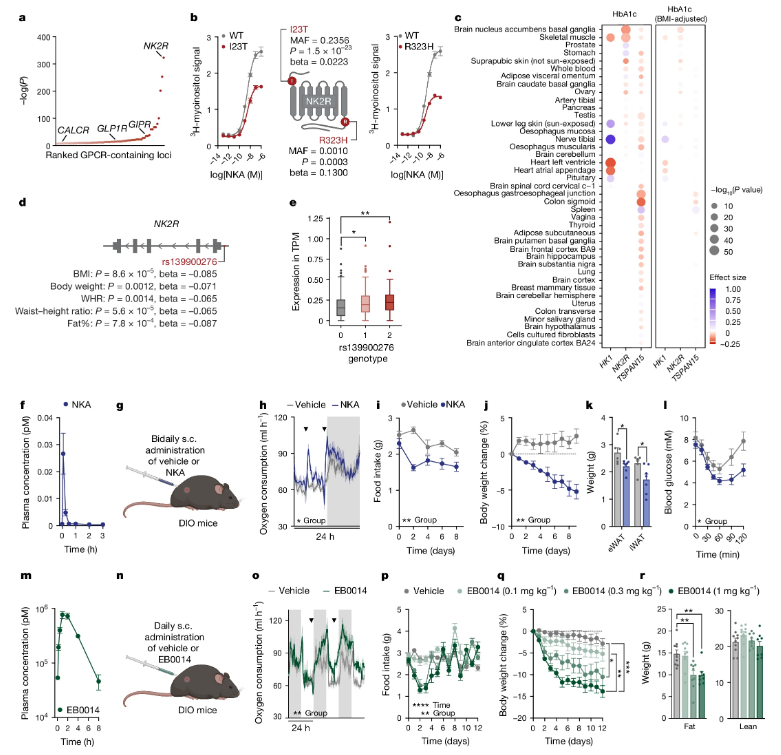
NK2R的激动作用在基因和功能上与心脏代谢保护有关
目前,基于肠促胰岛素(incretin,一种能刺激胰岛素分泌的激素)的药物,如GLP-1(Glucagon-like Peptide-1)类药物,已经帮助全球数百万人减肥,并改善了肾脏功能,降低了致命心脏疾病的风险,还与保护神经系统免受退化有关。然而,由于这些药物常常会引起恶心和呕吐等副作用,许多患者会中途放弃治疗。此外,对于同时患有肥胖和2型糖尿病的人群,这些药物的减肥效果并不理想。全球有超过3.8亿人面临这种健康问题。
【4】Nature:葛根素可以调节DMV神经元活性,使小肠绒毛长度缩短,减少脂肪吸收面积,实现减肥效果
doi:10.1038/s41586-024-07929-5
在这个“以瘦为美”的时代,减肥成了无数人茶余饭后的热门话题。从健身房的挥汗如雨到各种减肥茶的轮番上阵,人们为了追求那几斤的体重下降可谓是无所不用其极。然而,在这股减肥热潮中,一种古老的草药——葛根,却悄然走进了科学家的视野。你可能对它并不陌生,毕竟在中国传统医学中,葛根早已被用来清热解毒、生津止渴。但是,你有没有想过,这种看似普通的草药竟然有可能成为未来减肥的秘密武器呢?这并不是空穴来风,而是基于一项最新发表在《自然》杂志上的研究成果。
这项由上海交通大学、上海国家代谢疾病临床研究中心等合作完成的研究揭示了一个令人惊喜的事实:葛根中的异黄酮成分——葛根素,能够通过调节大脑与肠道之间的信号通路,有效减少肠道对脂肪的吸收,从而达到减肥的效果。这一发现不仅为肥胖症的治疗提供了新的思路,也让我们对传统中药有了更加深刻的认识。那么,葛根究竟是如何发挥其减肥作用的呢?接下来,就让我们一起来仔细说道说道~
研究人员首先选择了小鼠作为实验对象(因为小鼠的生理系统与人类相似,便于观察和分析)。小鼠被分成两组:对照组和实验组。对照组小鼠接受标准饮食,而实验组小鼠则接受高脂饮食(HFD),其中含有60%的热量来自脂肪。经过8周的喂养,实验组小鼠表现出明显的体重增加和脂肪积累,成功模拟了人类肥胖的病理状态。随后,研究团队利用光遗传学和化学遗传学技术,精确控制了小鼠大脑中的背侧迷走神经核(DMV)神经元活性。这些神经元是大脑与肠道之间的重要通信桥梁,负责调节肠道的功能。通过精确控制DMV神经元的活性,研究人员可以观察其对小鼠体重和脂肪吸收的影响。
【5】狗狗和人一样,有这个基因就容易胖!Science揭示狗与人类的“肥胖基因”
doi:10.1126/science.ads2145
近年来,肥胖不仅困扰着人类,也悄悄“传染”给了我们的宠物狗。据统计,大约40%~60%的宠物狗超重或肥胖,这可能导致一系列健康问题,如糖尿病、关节炎和心血管疾病。有趣的是,狗不仅是人类最好的朋友,还是研究肥胖的绝佳模型。它们和人类一样,在相似的环境影响下产生肥胖,而且由于特定品种的狗具有高度的遗传相似性,科学家们更容易将它们的基因与疾病联系起来。最近,剑桥大学的研究团队通过对英国拉布拉多猎犬的研究,发现了多个与狗肥胖相关的基因,并证明这些基因也与人类肥胖密切相关。其中,最引人注目的是DENND1B基因。这个基因不仅存在于狗体内,也在人类基因组中被发现,并且与人类的肥胖风险显著相关。
DENND1B基因直接影响大脑中的瘦素-黑皮质素通路(leptin-melanocortin pathway),这是调节能量平衡和食欲的关键通路。简单来说,这个通路就像身体的“能量调节器”,控制着我们何时感到饥饿,何时停止进食。当这个通路出现问题时,身体可能会“误判”能量需求,导致暴饮暴食和体重增加。除了DENND1B,研究团队还发现了另外四个与狗肥胖相关的基因,尽管它们的影响较小,但这些基因同样在人类基因组中找到了“对应版本”。这一发现进一步证明了狗和人类在肥胖机制上的相似性。
研究发现,遗传肥胖风险高的狗对食物表现出更强的兴趣。研究人员通过观察狗向主人讨要食物的频率以及它们的挑食行为,发现这些“高风险”狗更容易表现出暴饮暴食的倾向。类似的现象也在人类中被观察到:遗传肥胖风险高的人往往更难抵抗食物的诱惑。
【6】肥胖的“幕后黑手”!AJP:即使在高脂肪饮食喂养下,缺乏特殊蛋白的小鼠依然能保持“苗条身材”
doi:10.1016/j.ajpath.2024.10.005
CD44,这个听起来像某种神秘代码的名字,实际上是一种广泛存在于细胞表面的跨膜蛋白。它在细胞外信号传递中扮演着重要角色,尤其是在癌细胞中。然而,最近的研究发现,CD44的“业务范围”远不止于此——它还可能悄悄影响着我们的体重和代谢健康。
近日,一篇发表在国际杂志The American Journal of Pathology上题为“Ablation of CD44 Attenuates Adipogenesis in White Adipocytes via the Tryptophan 5-Hydroxylase 2/5-Hydroxytryptamine Axis to Protect Mice from High-Fat Diet-Induced Obesity”的研究报告中,南通大学等机构的科学家们揭开了CD44在肥胖中的关键作用。他们发现,缺乏CD44的小鼠即使在高脂肪饮食的“诱惑”下,依然能保持苗条身材,而正常小鼠则会“发福”。这一发现让研究人员大吃一惊,因为CD44似乎通过抑制白色脂肪组织(WAT)中的脂肪形成,成为了抵御肥胖的“隐形卫士”。研究的主要作者Cheng Sun博士解释道:“我们之前发现CD44的缺乏可以抑制神经炎症。考虑到炎症在肥胖及其相关疾病(如高血糖和胰岛素抵抗)中的重要作用,我们推测CD44可能在代谢调控中也有一席之地。”
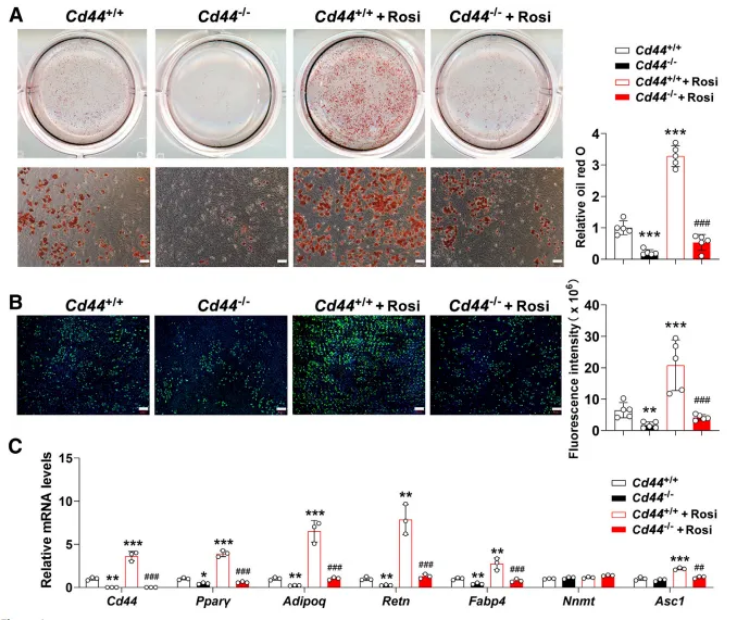
CD44的缺乏能减少培养的脂肪细胞中的脂质积累
为了验证这一假设,研究团队对小鼠进行了基因改造,使其缺乏CD44蛋白。结果令人惊讶:这些小鼠在高脂肪饮食的“轰炸”下,依然保持了苗条的体型,而对照组小鼠则迅速“膨胀”。进一步研究发现,CD44的缺乏会抑制白色脂肪组织中的脂肪形成,而这种效应与一种名为色氨酸羟化酶2(tryptophan hydroxylase 2, TPH2)的酶密切相关。CD44的缺失导致TPH2表达下降,进而减少了血清素(5-HT)的水平,最终抑制了脂肪的形成。
【7】Nat Genet:在人体中发现一种新的脂肪细胞亚型,有可能推进个性化的肥胖治疗
doi:10.1038/s41588-024-02048-3.
如今,由内盖夫本古里安大学的研究人员领导的一个新的国际研究团队在一项新的研究中表征了人体各种脂肪组织中的脂肪细胞群体。他们首次能够识别出具有比以前已知的更复杂的预测功能的独特脂肪细胞亚群,甚至识别出不同的人体脂肪组织在细胞间通讯方面的差异。这些发现为开展进一步研究推进肥胖的个性化医疗提供了基础。相关研究结果近期发表在Nature Genetics期刊上。
这项研究是人类细胞图谱项目国际努力的一部分,该项目旨在与世界各地的许多其他实验室合作,生成组成人体的所有类型和亚型细胞的综合图谱。这项研究使用了绘制RNA分子的创新技术。这种技术基于将独特的单细胞特异性“条形码”附着到源自每个细胞的RNA分子上。因此,同时对构成组织的数千个细胞进行条形码标记,使得能够检测到含有属于同一细胞类型的类似RNA分子亚集的细胞,以及含有属于不同细胞类型的不同RNA分子亚集的细胞。将该技术应用于从供体获得的脂肪组织样本,可以鉴定出构成该组织的已知类型的细胞,如脂肪细胞、血管细胞、免疫系统细胞,以及以前也没有鉴定过的细胞亚型。
在过去的三十年里,人们对脂肪组织和脂肪细胞的看法发生了转变。在过去,脂肪组织被认为是一种“无聊”的组织,其唯一目的是以脂肪(甘油三酯)的形式储存多余的能量,并将其分解为身体现成的能量来源。如今,人们知道脂肪组织产生并分泌数百种蛋白和其他物质到血液中,通过脂肪组织内以及与大脑、血管、肝脏和胰腺组织的细胞间通讯来调节各种过程。例如,一种称为瘦素(leptin)的激素几乎完全由脂肪细胞产生,是食欲、饮食和能量消耗率的中枢调节因子,通过血液到达大脑的控制中心。
【8】Nature:科学家成功绘制出人类下丘脑的详细细胞图谱,有望帮助开发抵御肥胖和糖尿病的新型药物
doi:10.1038/s41586-024-08504-8
下丘脑(hypothalamus)是一种在协调机体基本生物学功能方面扮演关键角色的大脑区域,然而直到最近,研究人员对于其潜在的细胞组分和神经回路的理解主要来自于对啮齿类动物的研究。近日,一篇发表在国际杂志Nature上题为“A comprehensive spatio-cellular map of the human hypothalamus”的研究报告中,来自剑桥大学等机构的科学家们通过研究绘制出了人类下丘脑的细胞图谱,有望支持开发人类抗肥胖药物。
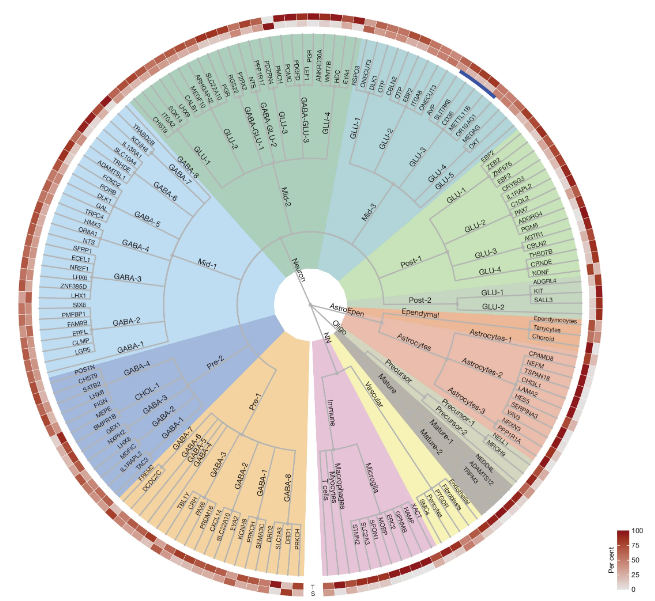
人类下丘脑的细胞类型分类
人类下丘脑的高分辨率空间图谱使得识别特定细胞,确定其确切位置并分析其邻近细胞成为可能,研究人员开发的名为Hypomap的细胞图谱目前正向科学界开放,有望帮助开发抵御人类肥胖和糖尿病的新型药物。下丘脑是人类大脑中的中心区域,其控制着诸如睡眠、体温、饥饿和口渴等重要的功能,由于人类大脑很难进行研究,关于下丘脑的很多知识都是基于对小鼠的研究,而这也是研究抗肥胖药物的基础。
研究者Lukas Steuernagel解释道,我们知道诸如司美格鲁肽(semaglutide)等所谓的GLP-1激动剂对人类有益,但想要确切了解其是如何发挥作用且可能减少副作用的,我们还需要更好地理解下丘脑的作用机理。为此,研究人员将自己的数据与来自人类细胞图谱(Human Cell Atlas)的信息相结合,共分析了11个人类大脑,随后他们绘制出了下丘脑的详细图谱,其显示了每个细胞的位置以及在单个细胞水平下哪些基因会在其中表达,利用Hypomap图谱,研究人员就能更多地了解调节食欲和食物摄取的神经元和神经回路,并识别出能对新型肥胖和糖尿病药物产生反应的特殊细胞。
【9】Nat Commun:特殊的肝脏蛋白或能作为抵御肥胖和糖尿病发生的“关键选手”
doi:10.1038/s41467-024-53835-9
与胰岛素抵抗和代谢综合征相关的脂肪营养不良(lipodystrophy)和肥胖往往会伴随着脂肪组织功能失调。近日,一篇发表在国际杂志Nature Communications上题为“Hepatic SerpinA1 improves energy and glucose metabolism through regulation of preadipocyte proliferation and UCP1 expression”的研究报告中,来自日本熊本大学等机构的科学家们通过研究识别出了一种名为丝氨酸蛋白酶抑制剂A1(SerpinA1,serine protease inhibitor A1)的肝脏衍生蛋白或能作为机体抵御肥胖和增强葡萄糖代谢的关键调节子,文章中,研究者揭示了激活棕色脂肪组织(BAT,brown adipose tissue)如何为开发改善人类糖尿病和代谢紊乱的创新性疗法铺平道路。
白色脂肪组织(WAT,white adipose tissue)能储存多余的能量,而棕色脂肪组织(BAT)则能燃烧多余的能量从而产生热量;随着人们年龄增长,机体的棕色脂肪组织就会减少,从而就会增加机体的肥胖风险,而由肝脏分泌的肝因子—丝氨酸蛋白酶抑制剂A1则能通过促进白色脂肪组织的褐变和激活棕色脂肪组织来逆转这一过程。
这项研究中,研究人员发现,丝氨酸蛋白酶抑制剂A1能明显增加解偶联蛋白1(UCP1,uncoupling protein 1)的表达,UCP1是一种对于产热至关重要的特殊蛋白。能过表达丝氨酸蛋白酶抑制剂A1的转基因小鼠即使在高脂肪饮食喂养下也能表现出机体能量消耗水平的增加、葡萄糖耐受得到改善以及对肥胖产生一定的抵抗力。相反,缺乏丝氨酸蛋白酶抑制剂A1的小鼠则会表现出线粒体活性下降,从而导致肥胖和对胰岛素产生抵抗。
丝氨酸蛋白酶抑制剂A1能与细胞表面分子EphB2相互作用从而诱发增强UCP1表达和脂肪细胞中线粒体活性的途径,这一发现揭示了一种独立于传统β-肾上腺素能通路的新型信号传导机制。这一研究发现强调了通过刺激机体燃烧热量的天然能力来治疗肥胖和2型糖尿病的潜在治疗性途径,相关研究结果表明,增加丝氨酸蛋白酶抑制剂A1的水平或能提供一种新方法来管理机体的代谢性疾病。
【10】Physiol Genomics:脂肪组织中的基因表达差异或能指导科学家们开发新型肥胖靶向性疗法
doi:10.1152/physiolgenomics.00080.2024
机体内脏脂肪组织(VAT,visceral adipose tissue)的积累与心血管疾病和糖尿病发生密切相关。近日,一篇发表在国际杂志Physiological Genomics上题为“A long-term high-fat diet induces differential gene expression changes in spatially distinct adipose tissue of male mice”的研究报告中,来自特拉华大学等机构的科学家们通过研究发现,在瘦弱和肥胖小鼠的脂肪组织中,与机体代谢、炎症和心脏保护相关的基因表达或许存在着显著差异,这些研究发现或能帮助开发针对机体中不同类型脂肪组织的靶向性疗法,从而有望解决人类的关键健康问题。
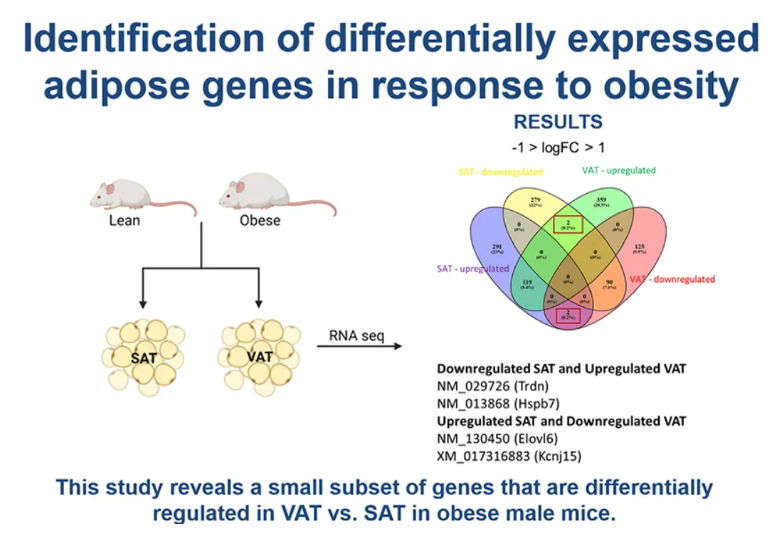
一小类基因在肥胖雄性小鼠机体的腹部脂肪组织和皮下脂肪组织中的调节或存在一定差异
脂肪组织曾经被认为仅仅是脂肪的储存场所,如今被认为是一种关键的内分泌器官,这种组织的功能异常会促进机体的代谢障碍且会造成心脏病发生的重大风险,两种类型脂肪组织参与到了肥胖发生过程中,但却有着不同的关联。内脏脂肪组织包围着腹部器官,且与慢性炎症和胰岛素抵抗有关。而皮下脂肪组织则存在于皮肤下层,与炎症水平增加无关。
这些差异或许能促使研究人员调查两种类型脂肪组织中的基因表达情况,他们分析了两组遵循不同饮食策略一年多的雄性小鼠机体的基因表达情况,这两组小鼠中,其中一组摄入高脂肪饮食,其体重和脂肪组织量都会增加,而另外一组则较瘦,且一直摄入标准的啮齿类动物饮食,研究人员发现:1)308个基因在瘦弱小鼠和肥胖小鼠机体中的皮下脂肪组织中表达存在差异;2)有超过600个基因在两组小鼠机体中的内脏脂肪组织中表达不同;3)大多数在皮下脂肪组织(危险性较低的脂肪组织)中表达上调(表达较为丰富)的基因都是能支持或增强与脂质处理相关的代谢活性;4)肥胖小鼠内脏脂肪组织中上调的大部分基因都与炎性信号通路有关。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


