J. Exp. Med: 核因子-κB信号调控顺式造血干细胞H3K9me3基因表达
来源:生物谷原创 2022-07-29 16:48
在放射治疗等医疗用途中,暴露于电离辐射(IR)是许多以加速衰老为特征的疾病的独立危险因素。
在放射治疗等医疗用途中,暴露于电离辐射(IR)是许多以加速衰老为特征的疾病的独立危险因素。造血组织对IR特别敏感。之前研究已经证明,小鼠的全身照射(TBI)会由于造血干细胞(HSC)储备和功能的丧失而导致长期的造血缺陷。
在HSCs中,IR诱导DNA损伤积累,自我更新丧失,并向髓系偏向分化,导致髓系细胞数量增加和适应性免疫反应下降。这些变化可能导致许多IR诱导的过早衰老障碍,并导致发展髓系白血病的高风险。了解HSC功能丧失对IR的分子机制对于调节其不良影响是必要的。它还可能有助于识别导致血液系统恶性肿瘤的最初事件。

图片来源: https://doi.org/10.1084/jem.20211356
近日,来自法国的研究者们在J. Exp. Med.杂志上发表了题为“NF-κB signaling controls H3K9me3 levels at intronic LINE-1 and hematopoietic stem cell genes in cis”的文章,该研究揭示了肿瘤坏死因子-α/核因子-κB/H3K9me3/L1Md轴对于维持造血干细胞,同时允许免疫基因在髓系再生或损伤诱导的骨髓移植中的表达可能是重要的。
电离辐射(IR)改变了造血干细胞(HSC)的长期功能,但这些影响的机制仍不清楚。研究者最近发现IR诱导L1Md的去表达,L1Md是LINE-1/L1逆转录元件的小鼠年轻亚家族。L1对基因调控网络有贡献。然而,L1MD如何被解压以及对HSC基因表达的影响尚不清楚。
在这里,研究者表明IR触发全基因组H3K9me3的减少,主要发生在L1Md。H3K9me3在含有NF-κB结合位点基序的内含子L1Md上的丢失,而在启动子上没有丢失,与HSC特异性基因的抑制有关。这与NFKB1抑制子表达减少有关。在体内,肿瘤坏死因子-α治疗挽救了所有这些效应,防止了IR诱导的肝星状细胞功能丧失。
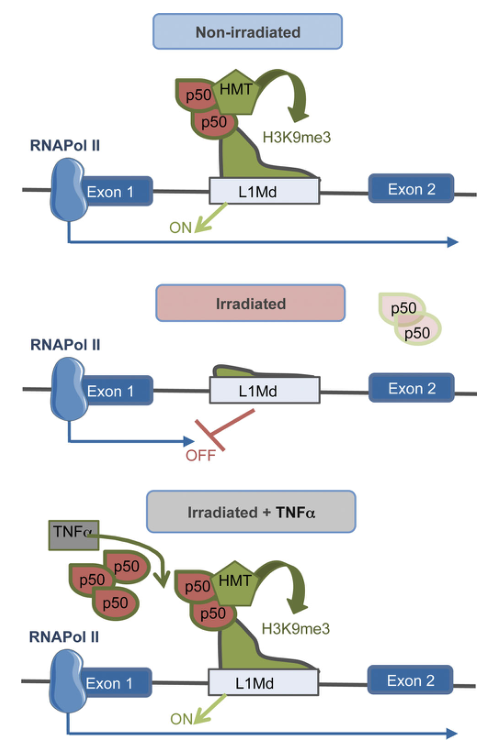
机制总结图
图片来源: https://doi.org/10.1084/jem.20211356
本研究表明L1MD中的NF-κB结合位点可能由于免疫连锁的维持而被活跃地选择在关键的肝干细胞基因的内含子中。这种调节可能通过将更多的基因,包括肝星状细胞维持基因整合到核因子-κB调控网络中来扩大核因子-α和肿瘤坏死因子-κ活性。
在肿瘤坏死因子α-核因子-κB诱导的骨髓再生或损伤诱导的骨髓去除过程中,这种活性对于维持造血干细胞的同时允许免疫基因的表达可能是重要的,并进一步强调了炎症诱导途径在造血干细胞中的复杂作用。恶性血液病患者肿瘤坏死因子-α水平升高,骨髓增生异常综合征/急性髓系白血病恶性造血干细胞特异性肿瘤坏死因子-α信号上调。
探索控制TE表达的机制,以及炎症信号和衰老如何影响它们在正常和恶性HSC中的表达,可能会导致识别AML的新的选择性依赖性和新的治疗策略。(生物谷 Bioon.com)
参考文献
Yanis Pelinski et al. NF-κB signaling controls H3K9me3 levels at intronic LINE-1 and hematopoietic stem cell genes in cis. J Exp Med. 2022 Aug 1;219(8):e20211356. doi: 10.1084/jem.20211356.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


