Science:发现人类基因组中的古老病毒DNA可以防止现代病毒的感染
来源:生物谷原创 2022-11-09 09:42
根据一项新的研究,人类基因组中的病毒DNA是在古代感染病毒时嵌入的,可以作为抗病毒剂,保护人类细胞免受某些现代病毒的侵害。相关研究结果发表在2022年10月28日的Science期刊上。
根据一项新的研究,人类基因组中的病毒DNA是在古代感染病毒时嵌入的,可以作为抗病毒剂,保护人类细胞免受某些现代病毒的侵害。相关研究结果发表在2022年10月28日的Science期刊上,论文标题为“Evolution and antiviral activity of a human protein of retroviral origin”。

以前的研究已表明,小鼠、鸡、猫和羊的基因组中的古老病毒DNA片段---内源性逆转录病毒---通过阻止源自体外的现代病毒进入宿主细胞而对它们产生免疫力。尽管这项新的研究是在实验室中利用体外培养的人类细胞开展的,但它表明内源性逆转录病毒的抗病毒作用很可能对人类也存在。
这项新的研究很重要,因为进一步的研究可能会发现一系列天然抗病毒蛋白,导致没有自身免疫副作用的治疗。它揭示了可能存在一种基因组防御系统,这种防御系统尚未被鉴定,但可能相当广泛。
论文通讯作者、美国康乃尔大学农业与生命科学学院分子生物学与遗传学教授Cedric Feschotte说,“这一结果显示,在人类基因组中,我们有一个蛋白库,有潜力阻止广泛的病毒。”
内源性逆转录病毒约占人类基因组的8%---至少是构成蛋白编码基因的DNA数量的四倍。为了让逆转录病毒进入宿主细胞,病毒包膜蛋白与宿主细胞表面的受体结合,就像一把钥匙插入一把锁。逆转录病毒将它们的RNA引入宿主细胞,然后它们的RNA经逆转录后转化为DNA并整合到宿主的基因组中。宿主细胞遵循它们的基因指令,制造更多的病毒。
通过这种方式,病毒劫持了细胞的转录复合物来进行自我复制。通常情况下,逆转录病毒感染的细胞不会代代相传,但有些逆转录病毒感染生殖细胞,如卵子或精子,这就为逆转录病毒DNA从亲代传给后代并最终在宿主基因组中持续存在打开了大门。
在这项新的研究中,这些作者使用计算基因组学来扫描人类基因组,并对所有可能保留受体结合活性的潜在逆转录病毒包膜蛋白编码序列进行分类。他们随后进行了更多的测试,以检测这些基因序列中哪些是活跃的,即在特定的人类细胞类型中表达逆转录病毒包膜基因。
Feschotte说,“我们发现了明确的表达证据,表明许多逆转录病毒包膜基因在早期胚胎和生殖细胞中表达,还有一部分在感染时的免疫细胞中表达。”
一旦这些作者确定了在不同情况下表达的抗病毒包膜蛋白,他们就把重点放在了一种叫Suppressyn的蛋白上,因为已知它能结合一种称为ASCT2的受体,该受体是一组称为D型逆转录病毒的病毒的细胞进入点。Suppressyn在胎盘和非常早期的人类胚胎发育中显示出高水平表达。
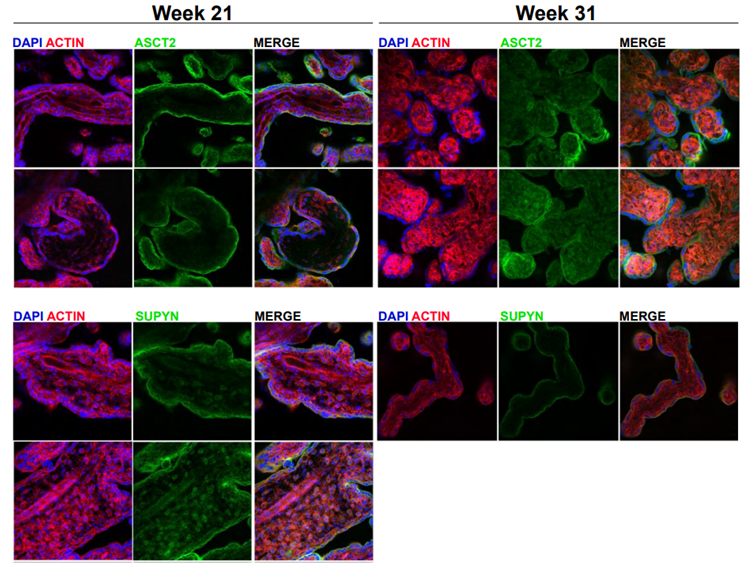
ASCT2和Suppressyn在人胎盘中的表达。图片来自Science, 2022, doi:10.1126/science.abq7871。
他们随后在人类胎盘样细胞中进行了实验,因为胎盘是病毒的一种常见的入侵目标。这些细胞被暴露在一种叫做RD114的D型逆转录病毒中,已知该病毒会天然地感染猫科动物,如家猫。虽然其他不表达Suppressyn的人类细胞类型很容易被RD114感染,但胎盘和胚胎干细胞却没有被RD114感染。当他们通过实验提出胎盘细胞的Suppressyn时,它们变得容易受到RD114的感染;当让这些细胞重新表达Suppressyn时,它们又恢复了抵抗力。
此外,这些作者做了相反的实验,使用通常对RD114敏感的胚胎肾细胞系。当他们通过实验将Suppressyn引入这些细胞时,这些细胞变得对这种病毒有抵抗力。
这项新的研究显示了一种源自逆转录病毒的人类蛋白如何阻断一种细胞受体,该细胞受体允许一系列在许多非人类物种中流通的逆转录病毒进入和感染宿主细胞。Feschotte说,通过这种方式,整合到人类基因组中的古老逆转录病毒提供了一种保护发育中的胚胎免受相关病毒感染的机制。他说,未来的研究工作将探索人类基因组中编码的其他包膜蛋白的抗病毒活性。(生物谷 Bioon.com)
参考资料:
John A. Frank et al. Evolution and antiviral activity of a human protein of retroviral origin, Science, 2022, doi:10.1126/science.abq7871.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


