NEJM:又见CAR脱轨!科学家首次发现,CAR会插入并抑制抑癌基因TP53表达,或驱动继发T细胞淋巴瘤
来源:奇点糕 2025-02-08 11:00
虽然Mailankody团队只报道了一个病例的分析数据,但是它为插入突变是CAR-T细胞治疗后继发T细胞淋巴瘤的诱因,提供了支撑。
当年5月底,美国宾夕法尼亚大学J. Joseph Melenhorst和Carl H. June领衔的团队,在《自然》上发表了一篇研究论文[1]。他们意外发现,在改造T细胞的时候,CAR被无意插到TET2基因里,造成该基因功能障碍。然而,患者却“因祸得福”,因为注入患者体内的这种CAR-T细胞增殖能力更强、抗癌能力更强、活得也更久,最终患者也因此实现了临床治愈。
不过,意外往往充满了不确定性,有好的一面,就会出现坏的一面。仅仅4个月之后,Melenhorst和June团队又在《自然·医学》上发表了一篇让人震惊的研究论文[2]。这一次,在制作CAR-T细胞时,意外地将CAR整合到癌细胞基因组中,形成了“CAR-癌细胞”,导致患者最终因癌症复发而死亡。
近日,由纪念斯隆-凯特琳癌症中心Sham Mailankody领衔的研究团队,在顶级医学期刊《新英格兰医学杂志》发表了一个罕见的病例报道[3]。他们在一例接受CAR-T治疗后继发CD4阳性T细胞淋巴瘤的患者肿瘤组织中,首次发现了CAR整合到T细胞抑癌基因TP53中的现象,并推测这个现象是继发T细胞淋巴瘤的驱动因素之一。

▲ 论文首页截图
研究报道的是一名72岁女性患者,她因患难治性/复发性多发性骨髓瘤,接受了自体BCMA特异性CAR-T细胞(ciltacabtagene autoleucel)治疗。患者在输注CAR-T细胞的一个月之后,实现了微小残留病灶(MRD)阴性的完全缓解。
然而,在CAR-T细胞输注约2个月之后,患者却出现了持续恶心、呕吐、厌食和难治性水样非血性腹泻,最终住院治疗。不过,患者没有发现感染的迹象,腹部和盆腔的CT扫描也未发现任何临床上明显的异常;上消化道内镜和柔性乙状结肠镜检查,在食道、胃、十二指肠近端和整个结肠中也没有发现明显异常(两次检查均获得了活检样本)。
组织活检的结果显示,可能是一种不明原因的免疫介导的小肠结肠炎。因此,患者又接受了多种治疗方案的治疗。在治疗后,患者的食欲有所改善,腹泻次数也减少了,甚至有望出院;然而,在出院前不久,患者出现败血症,最终因此死亡。
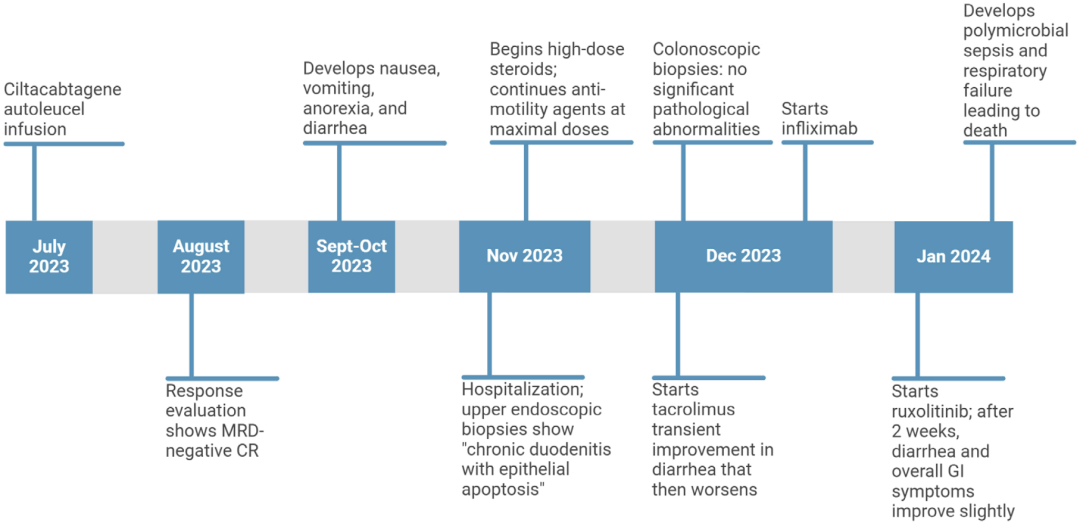
▲ 患者就医历程
也就是说,医生并不知道患者的真正死因。不久之后,医院里搭建了检测样本中ciltacabtagene autoleucel的CAR构建体的液滴式数字PCR平台,研究人员又借助于这个平台,从患者的十二指肠活检样本中检测到了高丰度的CAR。
这一发现引起了Mailankody团队的注意。于是,他们又重新启动了病理检测。检测结果显示,患者的死因可能是消化道惰性CD4阳性T细胞淋巴瘤或淋巴增生性疾病。在分析TCR序列之后,发现TCR Vβ11-02克隆占到了83.59%。值得注意的是,这个克隆在CAR-T细胞输注之前不存在,在输注之后,在外周血中的占比从第28天的0.01%,发展到第74天的16.99%。不难看出,这个CAR-T细胞克隆在患者体内大量扩增。
在分析CAR在T细胞基因组中插入位点时,发现了两个显性位点:一个是TP53基因的第一个内含子,插入频率为29%;另一个是TANGO2基因的第一个内含子,插入频率为23%。TP53我们都熟悉,是大名鼎鼎的抑癌基因,在检测组织样本中p53表达情况时,研究人员也发现,约90%的T细胞p53蛋白表达较弱或不表达;而TANGO2虽然也有CAR插入,但是转录和表达没有受到影响,此外,也没有研究发现它与癌症有关。
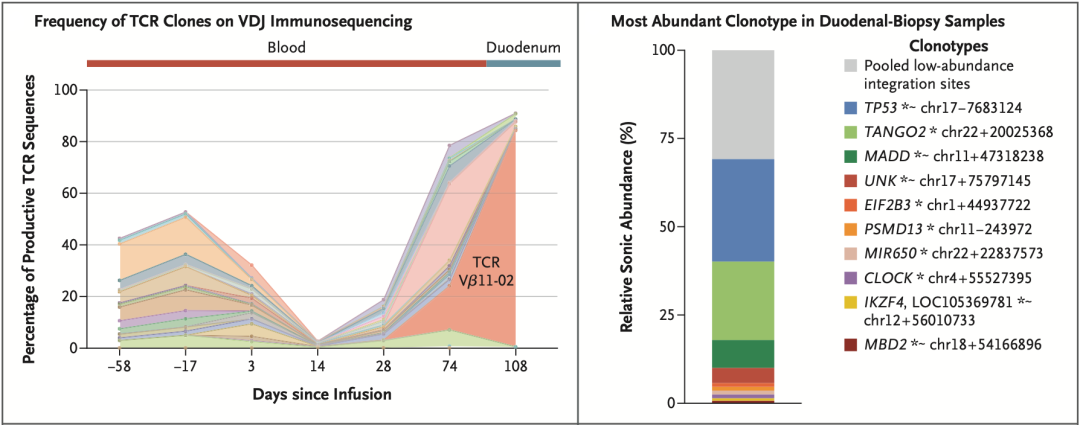
▲ 分子检测结果
很显然,CAR插入到TP53基因中,抑制了抑癌基因的表达,可能就是驱动T细胞淋巴瘤的关键原因。不过,Mailankody团队在分析58名接受CD19靶向CAR-T细胞治疗的患者数据之后,也在TP53基因中发现了19个独特的整合位点,但没有一个与T细胞的克隆扩增相关,这表明仅TP53的单等位基因整合,可能不足以将CAR-T转化为恶性细胞。
于是,Mailankody团队又分析了T细胞中的基因突变情况,发现JAK-STAT通路的负调控因子SOCS1(抑癌因子)的S206F突变,随着输注时间的推移,逐渐增加,且在时间上与TCR Vβ11-02克隆相吻合。此外,免疫组化分析也证实JAK-STAT通路被激活,而且这名患者在使用JAK2抑制剂芦可替尼(ruxolitinib)治疗后,继发的临床症状明显好转。
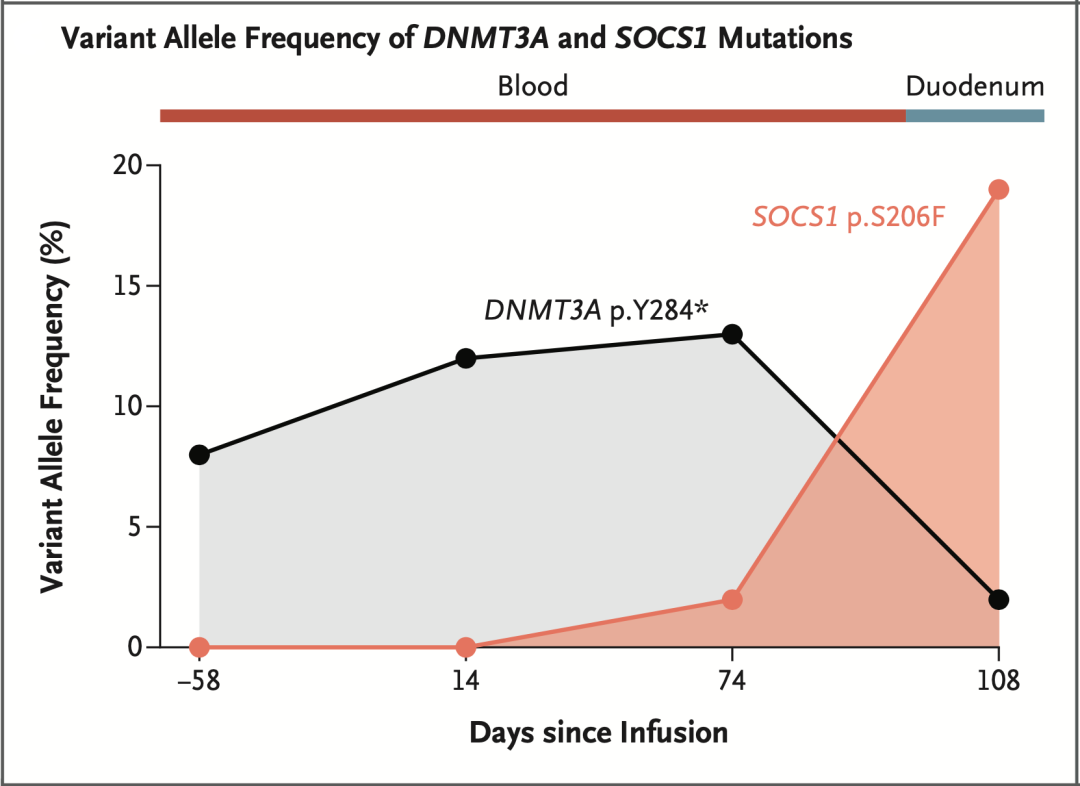
▲ SOCS1突变浮出水面
基于以上研究数据,Mailankody团队认为,对于这位患者而言,CAR-T细胞输注后可检测到的SOCS1基因突变,以及CAR与TP53基因的整合,可能共同导致了CAR-T治疗后继发的CAR阳性T细胞淋巴瘤的发生。
我们稍微理一下推理逻辑:CAR插入TP53基因,导致这个抑癌基因表达下调,赋予了CAR-T细胞恶变的潜能;而SOCS1基因突变,会激活JAK-STAT信号通路,进一步推动CAR-T细胞恶性转化;最终表现就是TCR Vβ11-02克隆飙升,导致患者死亡。当然,背后的分子机制,还有待进一步研究证实。
总的来说,虽然Mailankody团队只报道了一个病例的分析数据,但是它为插入突变是CAR-T细胞治疗后继发T细胞淋巴瘤的诱因,提供了支撑。更重要的是,它也提醒临床研究人员,要进一步优化CAR的整合方式,并做好CAR-T细胞疗法的长期安全性监测。
参考文献:
[1].Fraietta JA, Nobles CL, Sammons MA, et al. Disruption of TET2 promotes the therapeutic efficacy of CD19-targeted T cells. Nature. 2018;558(7709):307-312. doi:10.1038/s41586-018-0178-z
[2].Ruella M, Xu J, Barrett DM, et al. Induction of resistance to chimeric antigen receptor T cell therapy by transduction of a single leukemic B cell. Nat Med. 2018;24(10):1499-1503. doi:10.1038/s41591-018-0201-9
[3].Perica K, Jain N, Scordo M, et al. CD4+ T-Cell Lymphoma Harboring a Chimeric Antigen Receptor Integration in TP53. N Engl J Med. 2025;392(6):577-583. doi:10.1056/NEJMoa2411507
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


