Sci. Transl. Med:空军军医大学唐都医院屈延团队发表颅脑损伤研究成果
来源:brainnews 2025-06-02 15:20
该研究首次揭示了IRF1+星形胶质细胞在创伤性脑损伤(Traumatic brain injury, TBI)继发脑水肿中的关键作用机制,为临床治疗TBI继发脑水肿提供了病因学治疗新靶点。
北京时间5月29日,空军军医大学唐都医院神经外科屈延教授团队在Science Translational Medicine(《科学·转化医学》)在线发表题为:“Interferon regulatory factor-1-expressing astrocytes are epigenetically controlled and exacerbate TBI-associated pathology in mice”的研究论文。文章图片被Science Translational Medcine遴选为特色图片,在杂志官方网站首页置顶展示。

该研究首次揭示了IRF1+星形胶质细胞在创伤性脑损伤(Traumatic brain injury, TBI)继发脑水肿中的关键作用机制,为临床治疗TBI继发脑水肿提供了病因学治疗新靶点。《Science Translational Medicine》是Science杂志官方子刊,其发表的前沿研究成果在推动基础研究成果向临床应用转化方面发挥着关键作用。
TBI死亡率高达38%,全球年发病超过2700万例。脑水肿是TBI的核心病理特征,更是引发颅内高压及脑疝等致死性并发症的主要原因。由于脑水肿致病机制未完全阐明,临床缺乏针对病因的治疗手段。现有疗法如高渗疗法(甘露醇/高渗盐水)及去骨瓣减压术,虽可短期内降低颅内压,但因无法逆转脑水肿病理进程,治疗效果不佳。因此,亟待明确脑水肿发病机制及开发针对病因的治疗策略。
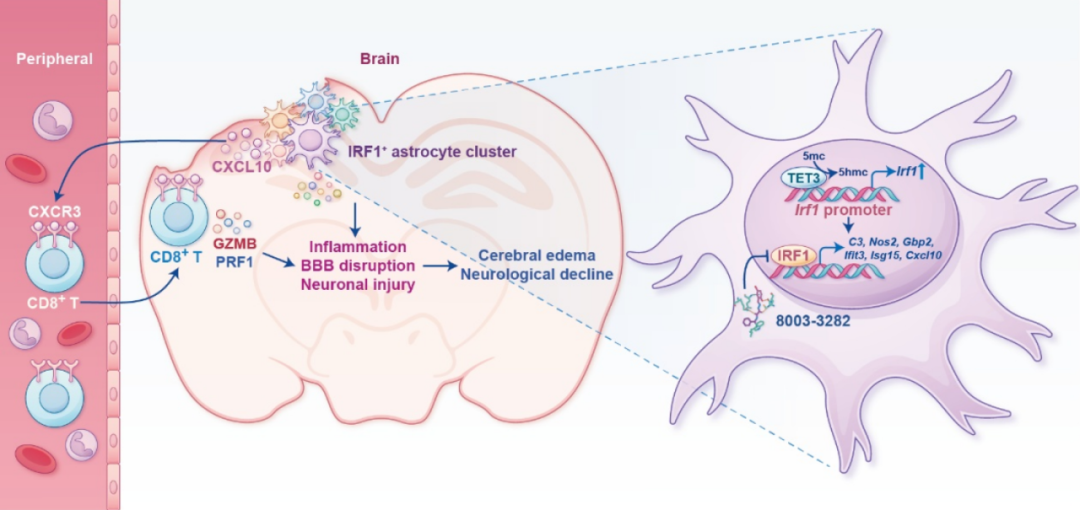
本团队在TBI患者脑水肿组织中,鉴定出特征性IRF1阳性星形胶质细胞亚群,并发现该亚群丰度与患者临床严重程度及预后不良指标呈显著正相关。通过构建星形胶质细胞特异性IRF1基因敲除动物及TBI模型,确认IRF1基因缺失可显著抑制星形胶质细胞的病理性活化表型,同时有效减轻血脑屏障通透性增加及脑水肿程度。进一步机制研究揭示,星形胶质细胞通过IRF1转录因子正向调控促炎因子分泌,进而趋化外周CD8+ T细胞向中枢神经系统特异性浸润,加剧神经炎症级联反应并诱发脑水肿。而TET3促进IRF1启动子DNA羟甲基化,是驱动IRF1阳性星形胶质细胞亚群扩增的关键机制。基于上述发现,我们筛选获得的小分子IRF1抑制剂8003-3282,在TBI治疗中显示出显著的神经保护效应,可有效改善TBI后继发脑水肿。该研究不仅解析了IRF1阳性星形胶质细胞在TBI继发脑水肿中的关键调控作用,更为针对继发脑水肿的病因治疗,提供了创新性治疗靶点。
屈延教授为该论文通讯作者,葛顺楠教授、刘海啸副研究员为共同通讯作者;崔文兴博士为第一作者,白浩博士和郭成铉硕士为共同第一作者。
原文链接:
https://doi.org/10.1126/scitranslmed.adr5300
参考文献:
Cui W, Bai H, Guo C, Zhou J, Feng D, Zhang S, Gao F, Han L, Tian Y, Dong J, Wei F, Bai J, Wu X, Shi Y, Guo H, Wang L, Li Z, Guo W, Zhao T, Heng L, Cai Q, Liu H, Ge S, Qu Y. Interferon regulatory factor-1-expressing astrocytes are epigenetically controlled and exacerbate TBI-associated pathology in mice. Sci Transl Med. 2025 May 28;17(800):eadr5300. doi: 10.1126/scitranslmed.adr5300. Epub 2025 May 28. PMID: 40435213.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


