AD:上海市东方医院团队发现尿石素A改善阿尔茨海默病小鼠认知的机制!
来源:生物探索 2024-06-14 09:36
研究确定了中长期UA治疗AD的潜在机制,涉及到海马和前额叶皮层区域的多种神经病理学,对突触功能、Aβ沉积、p-tau、神经炎症、溶酶体功能和DNA损伤等都具有改善功能。
近日,同济大学生命科学与技术学院/同济大学附属东方医院侯羽君教授团队发表了最新研究成果,发现长期UA治疗显著改善了AD小鼠的学习、记忆和嗅觉功能,减少Aβ和tau病理。
进一步研究发现,UA是通过增强溶酶体功能诱导线粒体自噬的,UA治疗可以使溶酶体组织蛋白酶、尤其是组织蛋白酶z正常化,从而恢复AD小鼠的溶酶体功能。
美国国立卫生研究院Vilhelm Bohr教授为共同通讯作者。研究发表在Alzheimer’s & Dementia上。

在AD主要病理出现之前,可能已经发生了线粒体自噬受损,因此,对线粒体自噬进行早期干预是十分重要的。APP/PS1小鼠一般会在6个月时出现Aβ病理和行为缺陷,因此,研究人员将2月龄的APP/PS1小鼠暴露于UA并持续5个月,之后对小鼠的行为表现和大脑样本进行检测。
水迷宫实验结果表明,UA处理成功改善了APP/PS1小鼠的记忆和学习能力,小鼠表现与野生型小鼠基本一致。停止用药后的1个月再次进行测试时,经过UA治疗的小鼠相比于APP/PS1小鼠依然表现出更好的记忆能力,展现出UA治疗对AD终点的持久影响。
为了更好地模拟人类AD特征,研究人员开发了DNA修复缺陷的ADP小鼠模型,这种小鼠模型通常在12个月左右出现Aβ和tau病理。在ADP小鼠12个月开始进行UA口服给药,持续5个月,可以观察到ADP小鼠的记忆力和认知能力显著改善。
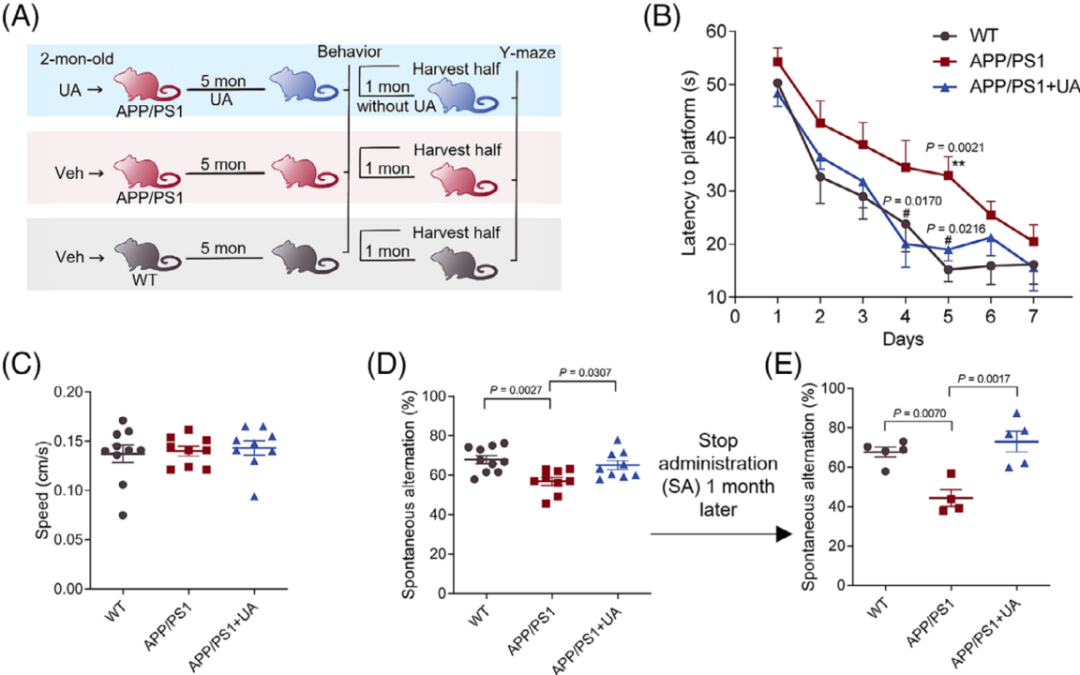
长期UA治疗改善AD小鼠的学习和记忆能力
对于AD患者经常出现的嗅觉障碍,在长期UA治疗后也得到了显著改善,小鼠不再表现出明显的嗅觉障碍。电生理实验研究显示,ADP小鼠的突触功能受损也得到显著改善。
进一步观察发现,UA治疗后,APP/PS1小鼠的前额叶皮层Aβ沉积水平降低,前额叶皮层和海马异常激活小胶质细胞数量较少,ADP小鼠大脑p-tau水平降低。
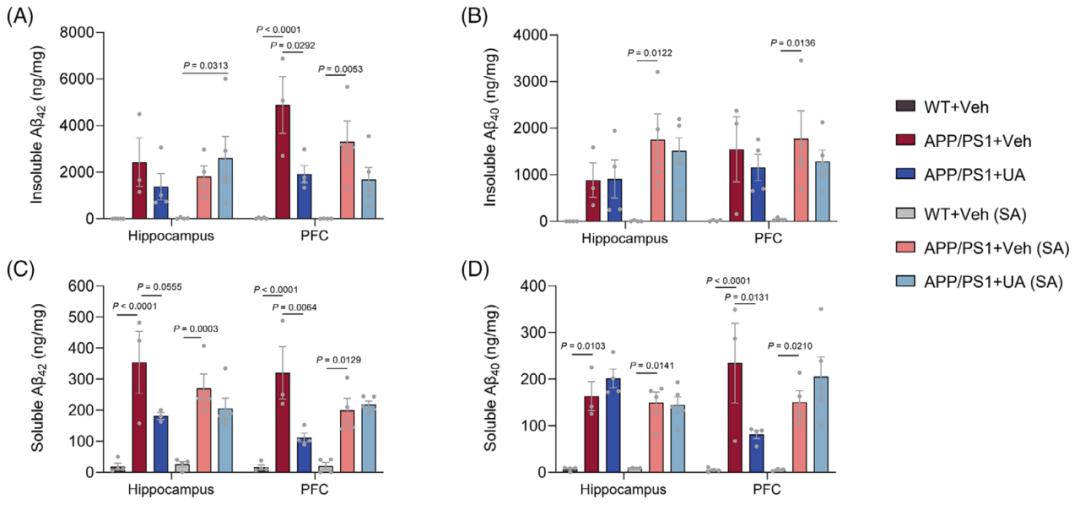
UA治疗降低AD小鼠Aβ沉积水平
为了探索UA治疗AD的潜在机制,研究人员对APP/PS1小鼠的海马组织进行了基因表达的微阵列分析,发现与野生型小鼠相比,溶酶体相关基因发生显著变化,其中组织蛋白酶z(Ctsz)在APP/PS1小鼠中显著上调,UA治疗后恢复至野生型水平。溶酶传感器测试显示,UA治疗显著改善了溶酶体功能,促进了溶酶体酸化,敲低Ctsz表达会影响UA诱导的溶酶体功能改善。
除了溶酶体的变化,研究人员还发现UA调节特定炎症因子(IL-1β、IL-10)的表达、降低促炎细胞因子和炎症信号通路(如NF-κB、AIM2、pSTAT3/STAT3的表达,并通过提高线粒体自噬相关蛋白表达来改善线粒体功能,还有助于减少DNA损伤。
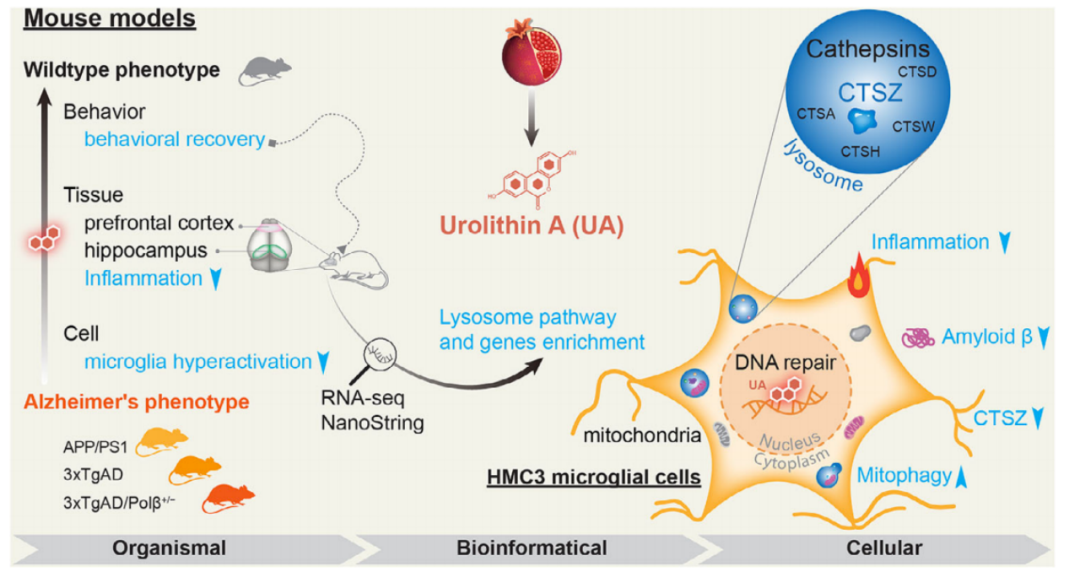
UA改善AD症状的机制
总体来说,研究确定了中长期UA治疗AD的潜在机制,涉及到海马和前额叶皮层区域的多种神经病理学,对突触功能、Aβ沉积、p-tau、神经炎症、溶酶体功能和DNA损伤等都具有改善功能。研究也首次证明了Ctsz在UA治疗AD中的重要作用。
研究强调了溶酶体功能障碍在AD发病机制中的重要性,表明UA在AD治疗中的发展前景。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


