渐冻症患者诱导多能干细胞建立了新的神经肌肉类器官疾病模型
来源:网络 2024-05-23 12:00
研究人员相信该模型能够用于未来ALS或者其他神经肌肉接头类疾病的药物测试及相关分子机制的研究。
西湖大学雷凯团队在Cell Reports在线发表了题为“Neuromuscular organoids model spinal neuromuscular pathologies in C9orf72 amyotrophic lateral sclerosis”的研究成果。
该研究报道了一种利用患者诱导多能干细胞(induced pluripotent stem cells, iPSCs)构建神经肌肉类器官(Neuromuscular Organoids, NMOs)的方法,用于研究渐冻症(amyotrophic lateral sclerosis, ALS)的体外疾病模型。研究团队使用C9orf72突变的ALS患者的iPSCs,成功地诱导出NMOs。这些NMOs模拟了包括骨骼肌收缩障碍,神经肌肉接头退化和蛋白异常堆积等疾病相关的病理特征。同时,研究团队还展示了这种类器官模型对测试ALS治疗药物的功效。

文章截图
渐冻症即肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS),是一种多因素共同作用的神经退行性疾病,其主要特征是运动神经元的退行性改变。一般情况下,ALS患者的生存年限不超过两年,仅有10%的患者存活超过5年。目前已确定与ALS发病直接相关的基因有30多种,而家族性患者仅占总病例数的约10%。这些因素限制了小鼠等动物模型的开发,从而限制了ALS的机制研究与药物研发。因此,开发新的能模拟疾病表型且满足高通量筛选的体外疾病模型,对于ALS及其他神经退行性疾病的治疗手段的开发将起到巨大作用。
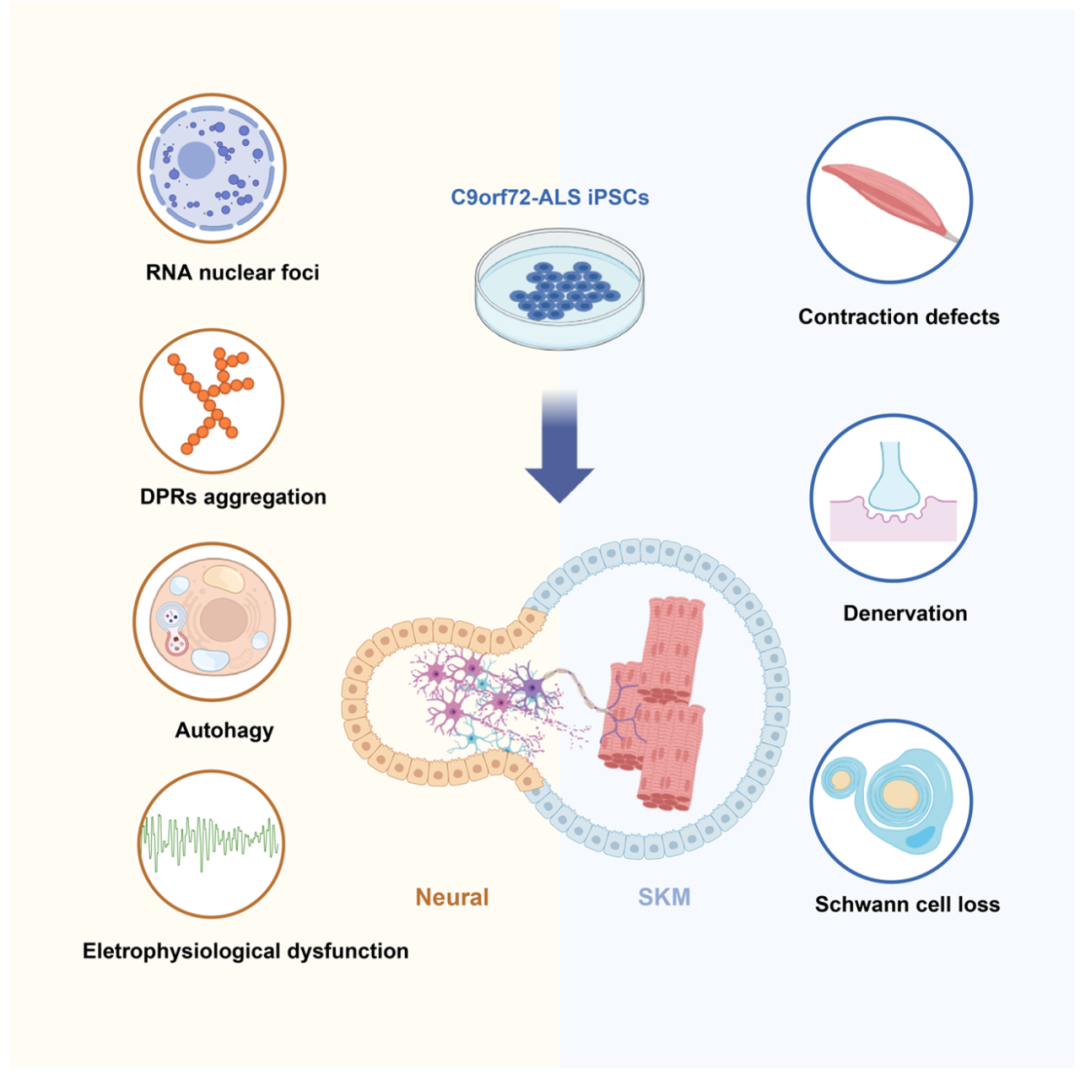 图1. C9orf72-iPSCs构建形成神经肌肉类器官
图1. C9orf72-iPSCs构建形成神经肌肉类器官
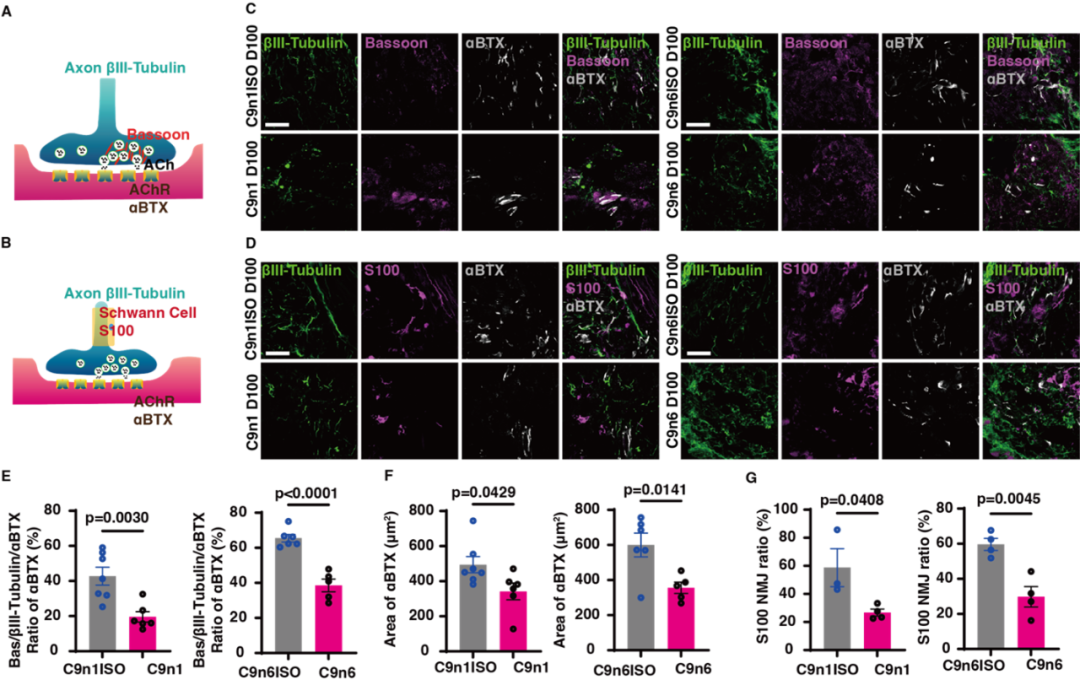

图2. C9orf72-NMOs对ALS相关的骨骼肌失神经的模拟
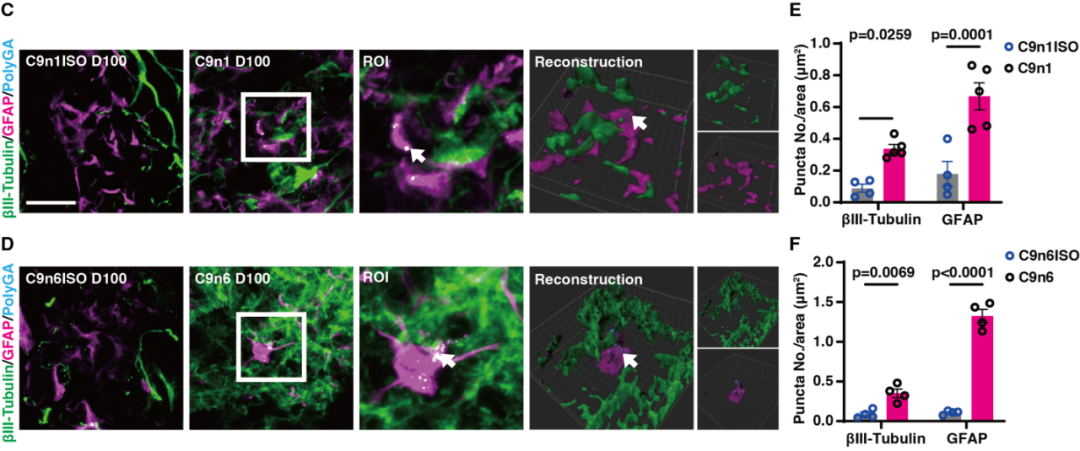 图3. C9orf72-NMOs对其特异性病理指征的模拟效应
图3. C9orf72-NMOs对其特异性病理指征的模拟效应
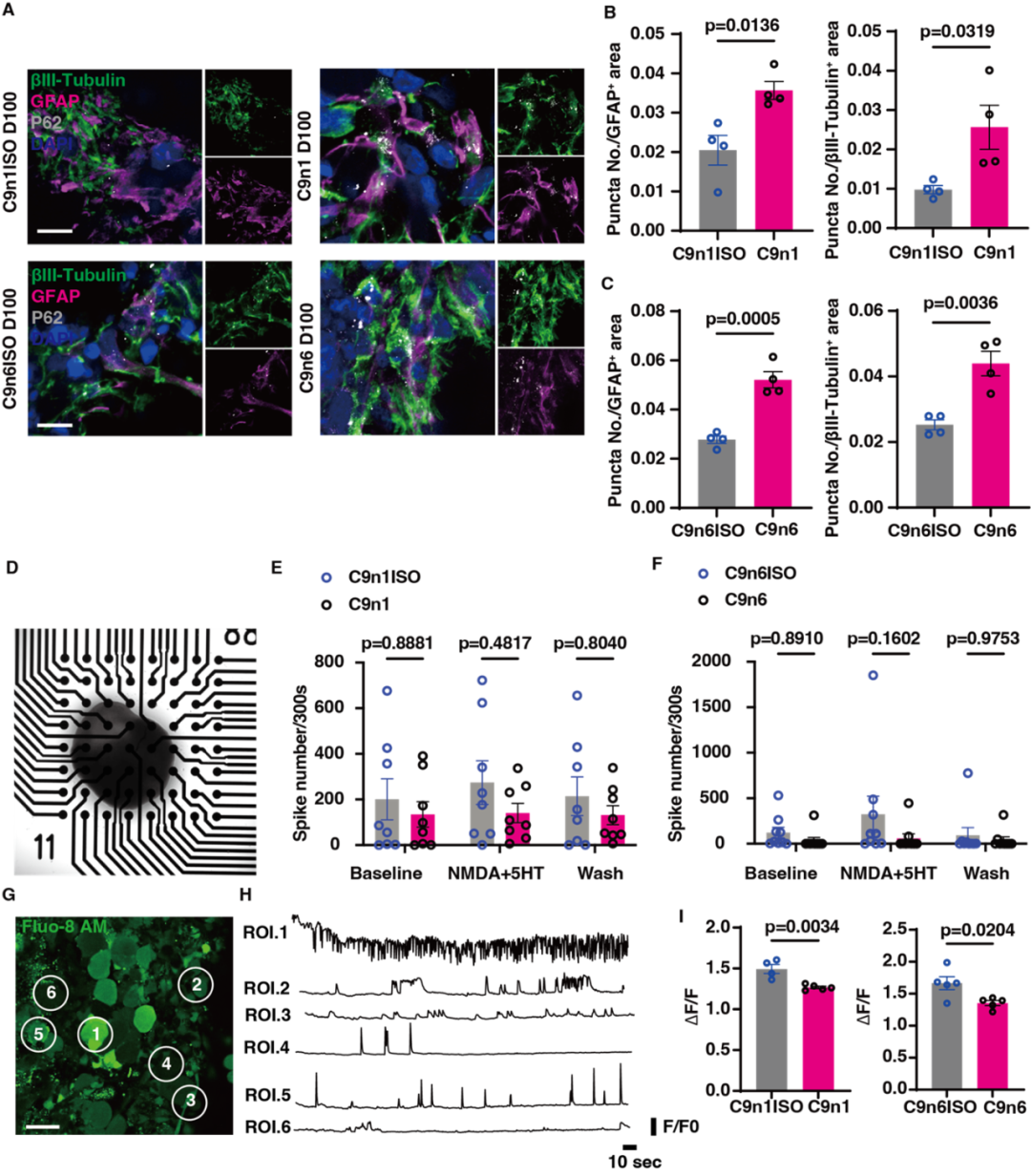
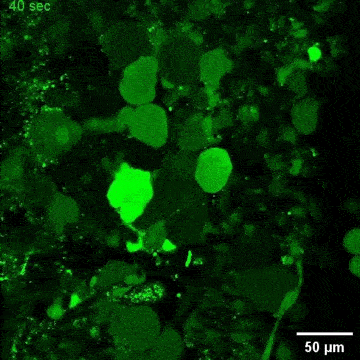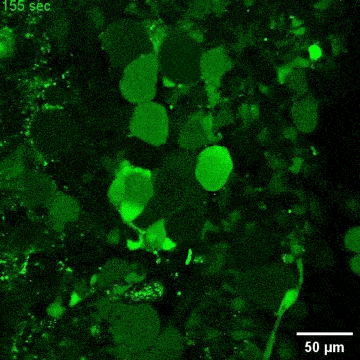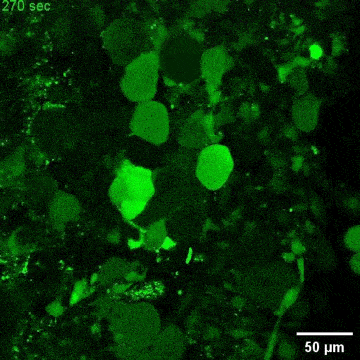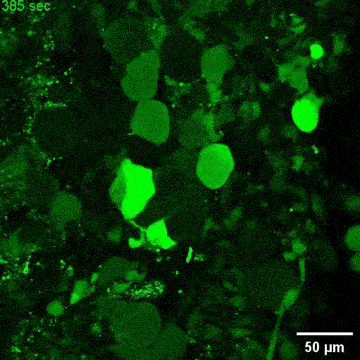 图4. C9orf72-NMOs对ALS相关的神经退行性改变的模拟效应
图4. C9orf72-NMOs对ALS相关的神经退行性改变的模拟效应
西湖大学生命科学学院的研究员雷凯为本文的通讯作者;原西湖大学博士后、现浙大城市学院副教授高充为本文的第一作者。其他合作者还包括西湖大学的石清华、潘雪、陈佳佳、文杉、张玉红、郎佳丽,西湖大学研究员刘晓东,复旦大学脑科学转化研究院研究员程田林;课题得到了浙江省“尖兵领雁+X”研发攻关计划、西湖实验室(生命科学和生物医学浙江省实验室)、国家自然科学基金,西湖大学教育基金会、上海市自然科学基金和科技计划项目的资助;项目实施还得到了西湖大学生物医学实验技术中心、西湖大学裴端卿实验室、常兴实验室、马丽佳实验室、南京医科大学刘妍实验室、德国柏林Max Delbrueck 分子医学中心Mina Gouti团队的支持与帮助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


