研究揭示钙敏感受体CaSR非对称激活的分子机制
来源:中国科大 2023-12-19 09:45
综合前期研究成果,研究人员提出了完整的CaSR非对称激活机制,完善了人们对C家族GPCR激活机制的理解,同时为靶向CaSR的精准调控药物研发提供了重要理论基础。
钙离子敏感受体(CaSR)是C家族G蛋白偶联受体(GPCR)的一员,广泛分布于甲状旁腺、肠道、骨骼和肾脏等组织器官中。CaSR感应血液中钙离子的浓度,并通过平衡钙离子的吸收和外排从而维持人体中的钙离子平衡。由于钙离子参与信号传递、凝血、肌肉收缩、骨骼生成等众多重要生理活动,CaSR维持血钙稳定对人体生命活动至关重要,其功能异常将会导致各种疾病。
CaSR是人体中非常重要的药物靶标蛋白,目前已经有多个正向变构调节剂药物成功获批上市,它们分别结合在CaSR受体不同的靶点上:小分子药物cinacalcet和evocalcet结合在跨膜结构域,多肽药物Etelcalcetide结合在胞外VFT结构域,小分子药物Upacicalcet则结合在胞外的芳香族氨基酸结合口袋中。CaSR激活的分子机制研究将进一步助力靶向该受体的药物研发。
针对CaSR这一重要的药物靶标蛋白,该团队开展了长期系统性研究,2021年在国际上首次解析了全长CaSR蛋白的三维结构,揭示了受体在钙离子和芳香族氨基酸两种激动剂协同作用下,从非活性构象转变成活性构象的结构机制。在此之后,国际上多个团队分别发表了CaSR受体在无配体、多个配体或别构调节剂结合的三维结构,分别提出了对称激活假说以及非对称激活假说。然而,由于缺少CaSR与下游信号蛋白G蛋白三聚体的复合物高分辨结构,其完整的激活机制仍然缺失。
经过近2年多努力,田长麟团队再次获得了CaSR-Gq复合物的高分辨冷冻电镜三维结构,结合细胞信号转导和NMR等实验揭示了CaSR在激活状态下结合Gq并启动下游信号传导的非对称激活机制。CaSR-Gq复合物结构也是目前第一个C家族GPCR与Gq结合的三维结构,揭示了其独特特点:(1)有别于A家族或B家族GPCR的Gq蛋白结合模式,其中Gq蛋白的α5螺旋没有插入CaSR胞内侧的跨膜螺旋深处,而是结合在受体胞内侧的一个非常浅的口袋中(主要由受体胞内loop和TM3胞内末端组成);(2)CaSR-Gq的结合模式与mGLuR-Gi, GABAB-Gi复合物的差异,体现了Gq与受体的特异性结合界面。
该团队结合冷冻电镜与NMR技术,首次揭示了正向别构调节药物分子cinacalcet在受体信号复合物中的多样结合模式:cinacalcet以伸展(extended)和弯曲(bent)两种不同的构象,分别结合在二聚体CaSR受体的两个跨膜结构域的胞外侧结合口袋中,其中只有结弯曲-cinacalcet的跨膜结构域的胞内能够偶联下游信号蛋白Gq。和其他GPCR(包括A家族、B家族、C家族等)类似,CaSR仅结合一个下游信号蛋白,且CaSR-Gq复合物整体处于非对称构象,而且受体的局部跨膜结构域也处于非对称构象,cinacalcet以两个完全不同的构象结合在两个跨膜结构域中。同时,CaSR单独受体(不含Gq蛋白)与cinacalcet的三维结构表明,尽管cinacalcet在两个跨膜结构域中都处于bent构象,但是CaSR受体本身仍然是处于非对称构象。
综合前期研究成果,研究人员提出了完整的CaSR非对称激活机制,完善了人们对C家族GPCR激活机制的理解,同时为靶向CaSR的精准调控药物研发提供了重要理论基础。
相关研究工作得到国家自然科学基金、科学技术部、中国科学院和安徽省自然科学基金的资助。
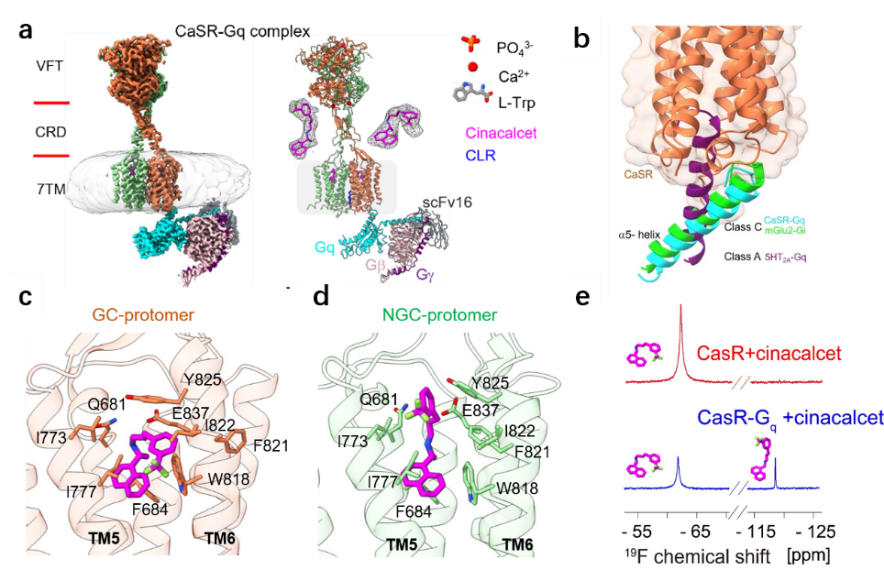
图1 CaSR在激动剂、别构调节剂作用下与下游信号转导蛋白Gq的非对称结合模式
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


